
研究背景:
老年人群体中,损伤愈合过程中细胞行为失调会影响组织再生。修复早期,促炎巨噬细胞引发免疫失衡,修复后期,衰老干细胞导致再生能力下降。靶向细胞代谢有望成为调控细胞行为的潜在策略。烟酰胺腺嘌呤二核苷酸(NAD⁺)作为代谢反应核心辅因子,其水平下降与衰老相关的干细胞功能障碍及免疫失衡密切相关,可用于重编程这两类功能异常细胞。然而,NAD⁺膜通透性有限,且实现修复不同阶段对巨噬细胞、干细胞的精准靶向调控仍面临挑战,因此亟需构建时空自适应的NAD⁺递送系统,以衔接细胞代谢、纳米医学与再生治疗。

针对上述问题,浙江大学方向前/赵玥绮/唐睿康/刘昭明团队构建了一种“时空自适应”纳米递送系统,在修复早期把 NAD⁺ 精准送进促炎巨噬细胞,代谢重编程使其转向抗炎修复表型;晚期再将 NAD⁺ 靶向衰老干细胞,恢复其分化潜能。单药(NAD⁺)分阶段作用于两种功能障碍细胞,成功逆转骨质疏松小鼠的骨缺损并加速皮肤创面愈合,为代谢-纳米-再生一体化治疗提供新平台。该文章于2025年10月1日以《Spatiotemporal-adaptive nanotherapeutics promote post-injury regeneration in ageing through metabolic modulation》为题发表于《Nature Nanotechnology》(DOI:10.1038/s41565-025-02017-9)。
(1)NAD⁺作为恢复巨噬细胞与干细胞代谢稳态的潜在靶点
对老龄小鼠皮肤损伤模型在早期(4 dpi)与晚期(7 dpi)的单细胞转录组分析显示,F4/80⁺巨噬细胞与Prrx1c细胞中NAD⁺消耗酶(CD38、PARPs)显著上调(Fig. 1a–d),提示二者存在共同的NAD⁺耗竭机制。NAD⁺作为细胞代谢关键辅酶(Fig. 1e),其下降与干细胞功能衰退及免疫失衡相关。炎性巨噬细胞中CD38/PARP过度激活导致NAD⁺合成失衡与SIRT1下调(Fig. 1f,g);SIRT1抑制NF-κB介导的炎症反应(Fig. 1h),因此NAD⁺补充有助于重编程巨噬细胞表型。然而,NAD⁺膜通透性有限(Fig. 1i),需依赖合理纳米载体实现有效递送。
基于此,构建葡萄糖修饰的巨噬细胞/干细胞杂合膜包覆NAD⁺负载ZIF-8纳米颗粒(NZM),实现炎症期与修复期的时空自适应靶向递送。炎症期NZM优先靶向促炎性巨噬细胞,通过溶酶体逃逸释放NAD⁺,诱导代谢重塑与抗炎转化;修复期NZM富集于衰老干细胞,恢复NAD⁺水平,增强线粒体功能,促进组织再生。该系统同时减弱巨噬细胞与衰老干细胞间的促炎信号互作,并在骨缺损与全层皮肤创伤模型中验证了修复效果。
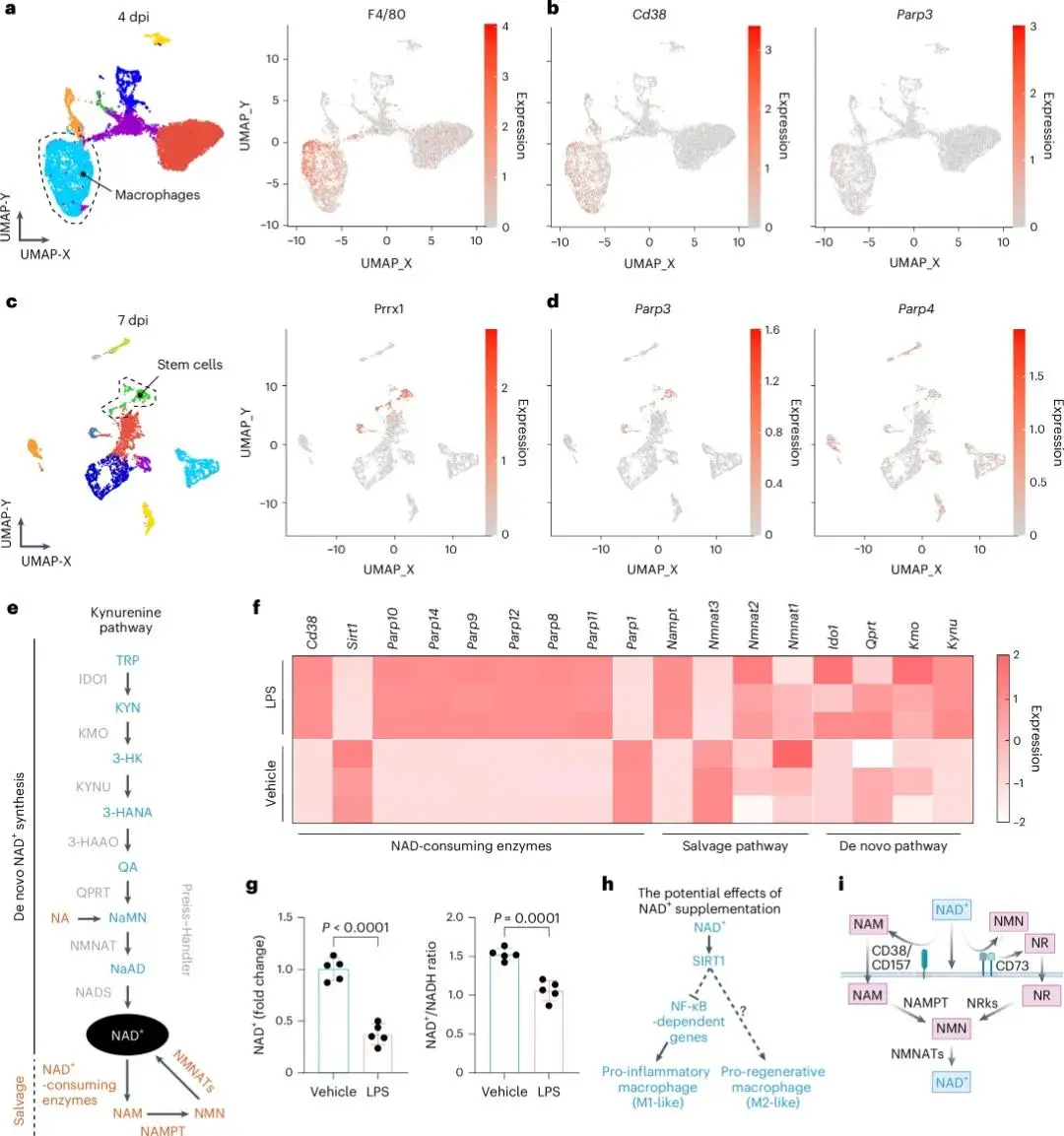
图1.(a)老龄小鼠4 dpi创面UMAP分群及F4/80⁺巨噬Adgre1表达;(b)巨噬NAD⁺消耗酶热图;(c)7 dpi UMAP分群及Prrx1⁺干细胞标记;(d)干细胞NAD⁺消耗酶热图;(e)胞内NAD⁺合成-消耗通路;(f)LPS刺激巨噬NAD⁺代谢基因聚类;(g)LPS组NAD⁺及NAD⁺/NADH下降;(h)NAD⁺补充重塑巨噬表型示意;(i)NAD⁺需经胞外酶降解为NAM/NR再摄取
(2)NZM的构建与时空自适应靶向验证
ZIF-8原位矿化负载NAD⁺(载药量6.2 ± 0.44 %),粒径/晶型与空载体一致;FTIR证实羰基存在,XRD证实晶型保留(图2a、b及图1a–d)。BMSC与BMDM膜经超声-挤出融合成杂合膜(HM),共定位验证融合,冷冻电镜呈囊泡状,ζ电位–25 mV(图1e–g)。HM蛋白组GO显示膜定位富集,含SEC62、Tmed9、Gnai3、Syntaxin-7(图2c、d)。插入葡萄糖脂质得GHM,绿色荧光确认(图2e及图1h)。GHM与NZ共挤出得NZM,粒径增大,ζ电位由正转负;冷冻电镜示核-壳结构,Western blot验证膜蛋白保留(图2f–h及图1i、j)。PBS中7 d无聚集,pH 5.5下72 h NAD⁺释放达80 %(图2i、j)。炎症模型(M1:MΦ:MSC:NIH3T3=3:1:4)中,NZM对M1巨噬细胞摄取率分别是MSC与成纤维细胞的4.1倍与3.8倍;修复模型(1:3:4)中,NZM对MSC摄取率提高3.5倍(图2k–p)。在高成纤维背景正常微环境中,NZM仍保持M1/MSC选择性,未修饰颗粒无差异。
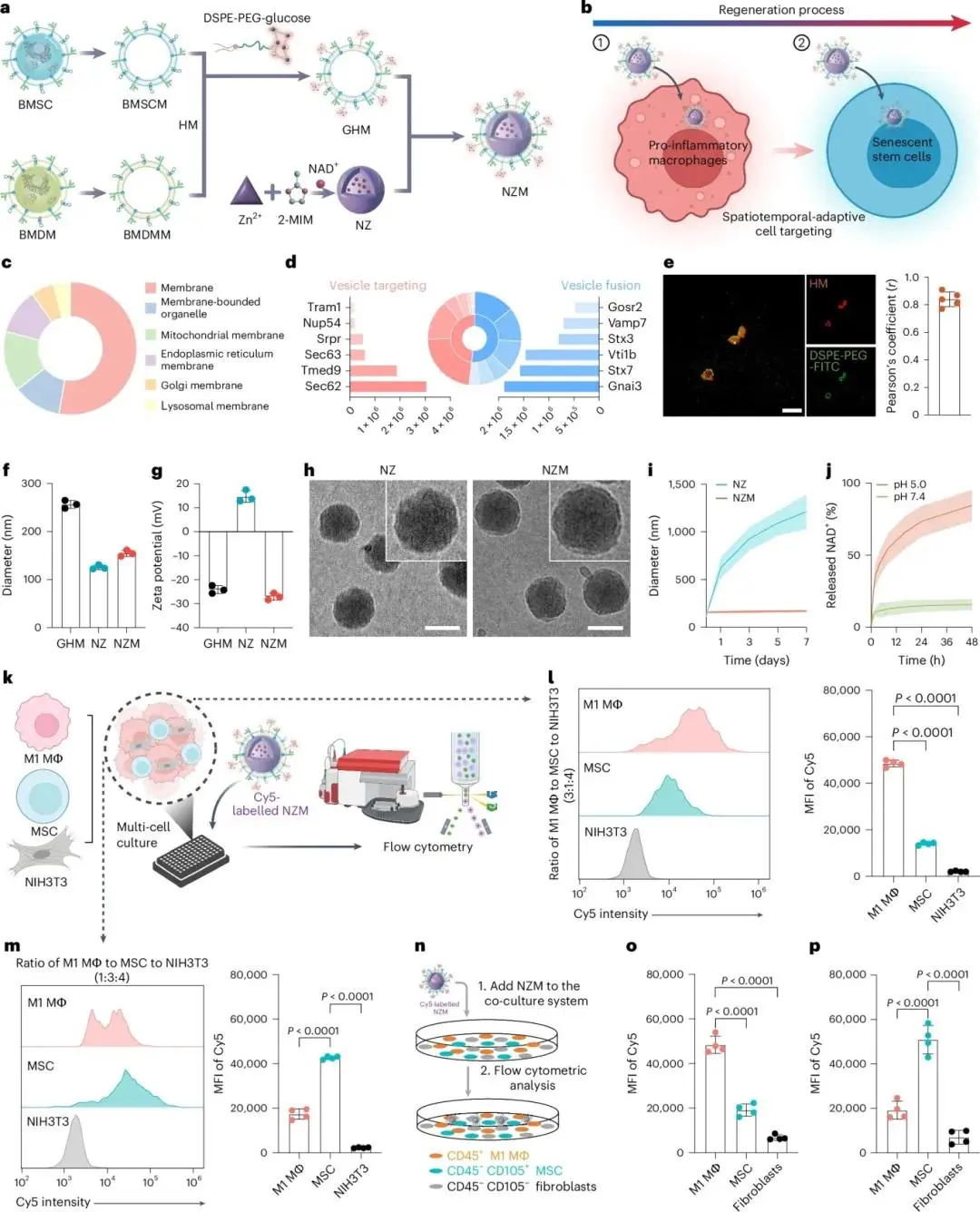
图2.(a)NZM制备示意图;(b)NZM在早期炎症期靶向巨噬细胞、晚期修复期靶向干细胞的模式图;(c)杂合膜蛋白GO细胞组分分类;(d)囊泡靶向与融合相关蛋白列表;(e)HM/DSPE-PEG2000-FITC荧光共定位及Pearson系数,标尺10 μm;(f–g)GHM、NZ、NZM的粒径与ζ电位;(h)NZ及NZM的cryo-TEM图像,标尺100 nm;(i)NZM与NZ在PBS中的胶体稳定性;(j)pH 7.4与5.0下NZM的NAD+释放曲线;(k)共培养模型模拟炎症与修复阶段的流式评估示意图;(l–m)炎症期(M1:MSC:NIH3T3=3:1:4)与修复期(1:3:4)Cy5-NZM细胞摄取流式图及MFI;(n–p)以原代成纤维细胞替换NIH3T3的炎症与修复模型中Cy5-NZM摄取MFI,n=4
(3)NZM对炎性巨噬细胞的靶向和调节作用
RNA-seq显示LPS激活的M1巨噬细胞GLUT1(Slc2a1)表达升高(图3a、b);GHM包被Cy5-NZM在M1细胞内的摄取量高于未修饰NZ或HM-NZM,且该优势被GLUT1抑制剂phloretin取消(图3c、d)。NZM经能量依赖的clathrin介导内吞进入溶酶体,酸触发降解后时间依赖性释放NAD⁺至胞质,溶酶体完整性及酸化未受干扰(图3e、f)。NZM使LPS刺激的巨噬细胞NAD⁺及NAD⁺/NADH比值恢复,ATP升高,葡萄糖消耗与乳酸输出减少,脂质累积降低,代谢由糖酵解转向氧化磷酸化(图3g–k)。表型上,iNOS下调、ARG1上调(图3l),促炎基因Nos2、Cd86降低,抗炎基因Arg1、Cd206升高(图3m);IL-1β、IL-6、TNF-α分泌减少,IL-10、TGF-β1、VEGF增加,CD206、CD301表达升高,LPS损伤的吞噬功能恢复(图3l–m)。
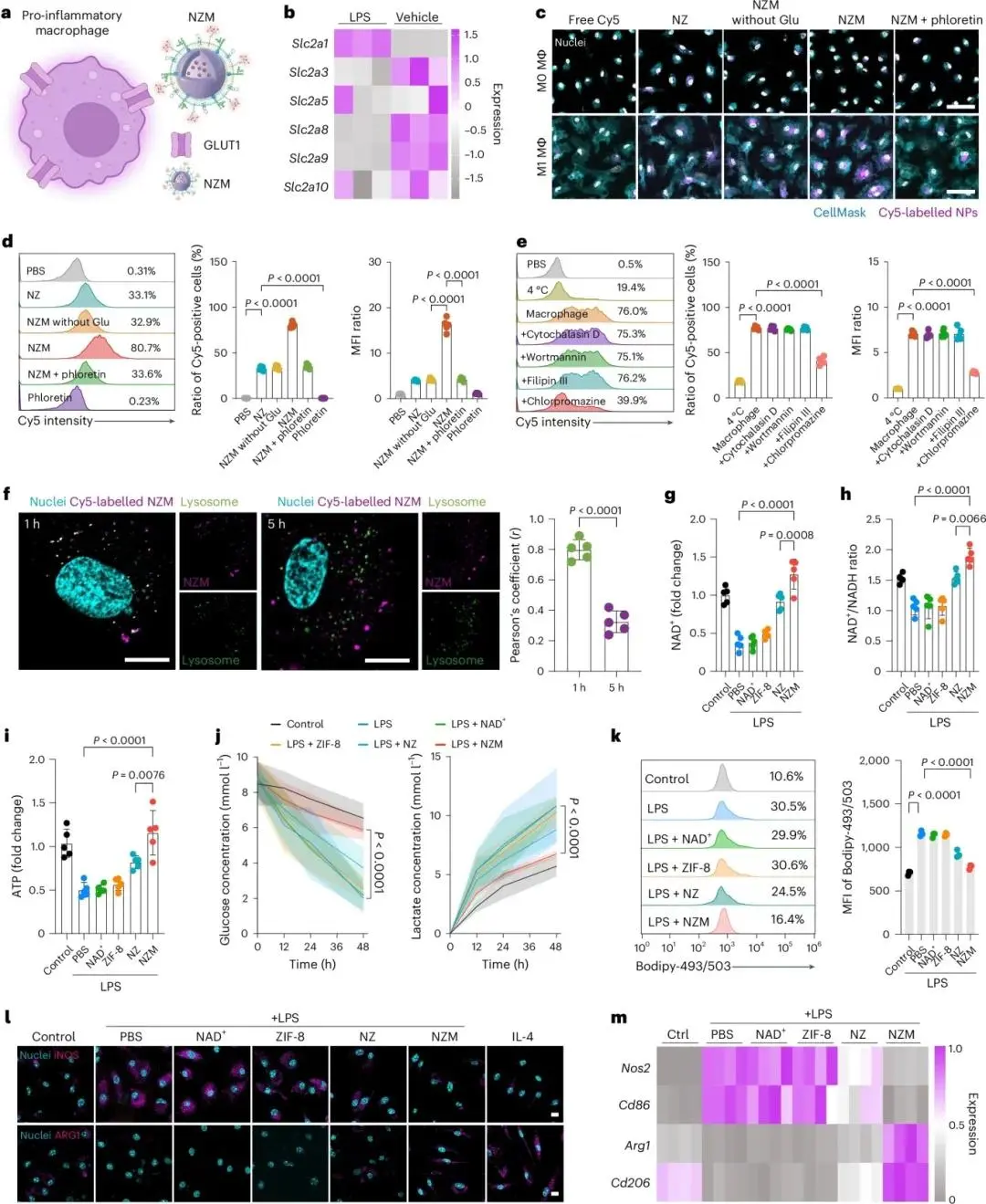
图3.(a)GLUT1介导NZM摄取示意图;(b)LPS刺激巨噬葡萄糖转运体转录组聚类;(c)Cy5染料、NZ、无糖基NZM、NZM及NZM+phloretin摄取图像,标尺50 μm;(d)流式定量Cy5阳性巨噬比例,n=5;(e)4 °C或内吞抑制剂预处理后NZM摄取流式定量,n=5;(f)Cy5-NZM与溶酶体共定位及Pearson系数,1 h与5 h,标尺10 μm,n=5;(g–h)经游离NAD⁺或NPs处理后巨噬胞内NAD⁺及NAD⁺/NADH比值,n=5;(i)胞内ATP水平,n=5;(j)实时葡萄糖与乳酸浓度,n=3;(k)Bodipy-493/503脂滴荧光强度,n=3;(l)iNOS与ARG1免疫荧光,标尺10 μm;(m)RT-PCR检测Nos2、Cd86、Arg1、Cd206表达,n=4
(4) NZM调节巨噬细胞代谢和免疫生态位
转录组显示,29 544个基因中6 276个差异表达;PCA将对照、LPS及LPS+NZM三者清晰分开(图4a–c)。GO/GSEA表明LPS抑制TCA循环、氧化磷酸化、脂肪酸及谷氨酰胺代谢并激活NF-κB/TNF信号,NZM则上调Ndufb10、Cox6b2、Idh2、Acox1等氧化代谢基因,下调IL-6通路Socs3、Stat3(图4e、f)。细胞外通量检测证实NZM恢复线粒体呼吸并抑制糖酵解(图4g、h);线粒体膜电位及呼吸链复合体活性同步改善。¹³C-葡萄糖示踪显示糖酵解中间产物进入TCA循环的比例升高,柠檬酸、富马酸、苹果酸及衣康酸的碳交换率显著增加(图4i)。代谢组学筛选(P < 0.05,VIP > 1)发现NZM相比LPS组增加16种、减少44种代谢物;KEGG注释主要涉及有机酸、酰基脂质及氨基酸代谢(图4j)。差异代谢物显著富集于花生四烯酸代谢,NZM降低血栓烷B₂、PGE₂、11,12-EET、6-keto-PGF₁α、(±)15-HETE及PGJ₂等脂质炎症介质水平(图4j)。同时,TCA循环中琥珀酸累积减少,单酰甘油MG(20:4/0:0/0:0)、MG(0:0/20:4/0:0)及游离脂肪酸FFA(12:0)含量下降,提示脂肪酸降解加速、促炎脂质信号受抑(图4j–l)。机制上,NZM提升NAD⁺后显著增强SIRT1活性,抑制p65核转位并提高PGC1β表达(图4m)。SIRT1通过去乙酰化灭活NF-κB p65,减少促炎基因转录,同时激活PGC1β以增强线粒体氧化代谢。SIRT1抑制剂EX527可逆转NZM诱导的TCA循环、氧化磷酸化及脂肪酸氧化相关基因表达上调,并削弱抗炎效应(图4n)。此外,NZM处理巨噬细胞的条件培养基可抑制破骨细胞分化,挽救LPS受损的成骨潜能,并增强内皮细胞血管生成活性,表明其通过重塑分泌谱构建促再生微环境。

图4.(a)LPS vs LPS+NZM差异基因热图,n=3;(b)差异基因Venn图(|log2FC|≥1,adjP<0.05);(c)PCA分离两组转录谱;(d)GO富集;(e)氧化磷酸化及脂肪酸氧化相关基因火山图;(f)GSEA示TCA、OXPHOS、FAO上调,NF-κB、IL-6、IL-17信号下调;(g–h)ECAR与OCR应激曲线,n=3;(i)U-[13C]葡萄糖示踪m+3/m+2/m+1比例,n=4;(j)差异代谢物热图,n=4;(k)KEGG通路富集;(l)脂质代谢火山图;(m)SIRT1、PGC1β核定位及p65入核定量,标尺10 μm,n=4
(5) NZM促进线粒体,防止MSC衰老
膜修饰NZM在MSC内的摄取量高于NZ。H₂O₂诱导衰老模型中,MSC的NAD⁺、NAD⁺/NADH及ATP水平下降,NZM显著回升且无明显毒性(图5a–c)。流式及SA-β-Gal染色显示NZM减少凋亡与衰老,γH2AX、p16、p21信号降低(图5d、e)。衰老/炎症基因Cdkn1a、Il6下调,周期基因Cdk4、Mki67上调。NZM降低胞质及线粒体ROS,恢复膜电位并提升OCR(图5f–j);MitoTracker示线粒体质量增加,呼吸链复合体蛋白水平升高。线粒体调控蛋白SIRT1、PGC-1α、NRF1/2、mtTFA上调,p16、p21、p53下调(图5k)。mt-mKeima检测显示NZM增强线粒体自噬,PHB表达升高(图5l)。RNA-seq示NZM上调1 135、下调751个基因,PCA明显分离;氧化磷酸化及TCA循环基因(mt-Atp6、Ndufa4l2)富集,衰老相关Cdkn1a下调,线粒体自噬基因同步上调(图5m–o)。
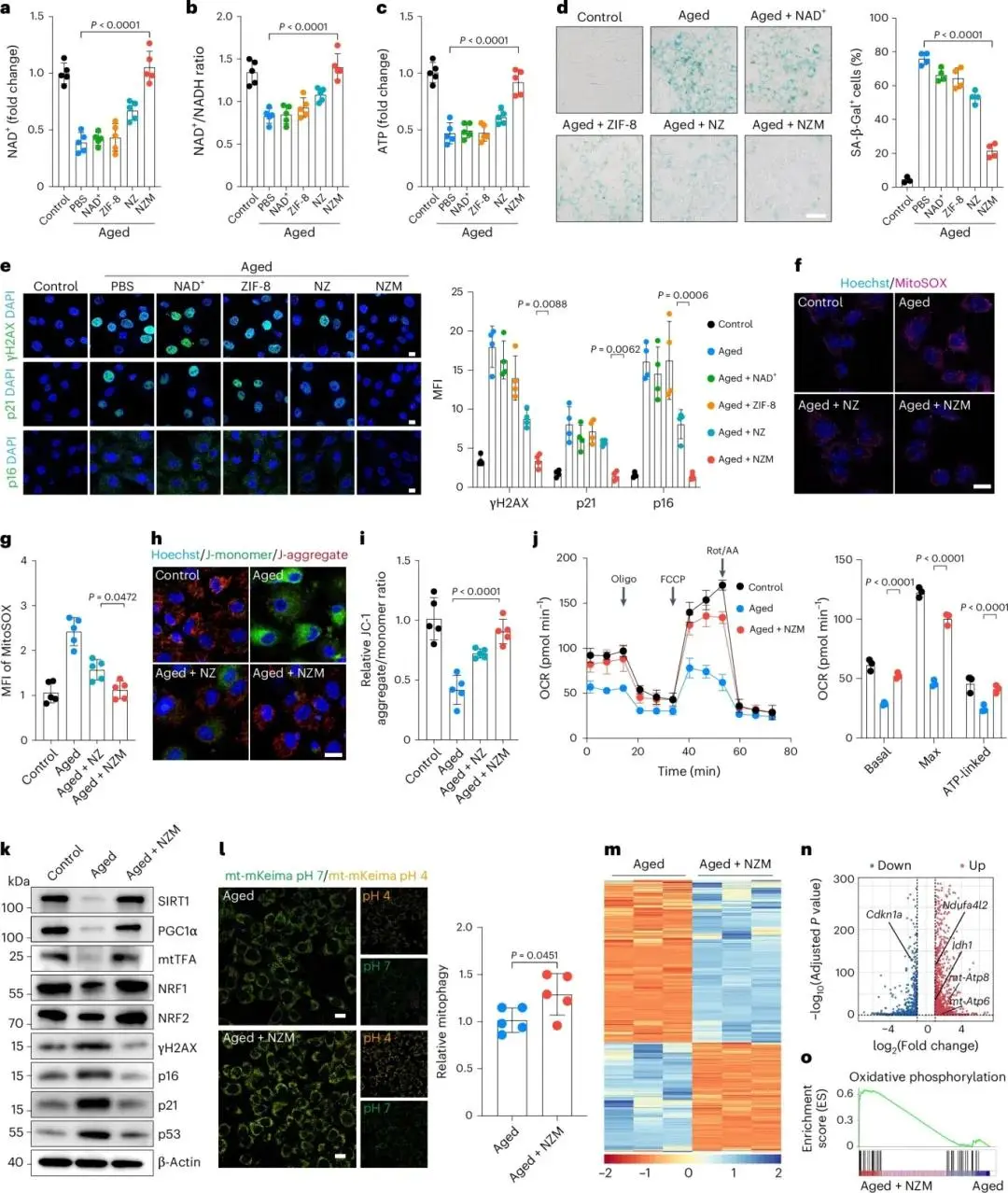
图5.(a–b)游离NAD⁺或NPs处理后MSC胞内NAD⁺水平及NAD⁺/NADH比值,n=5;(c)胞内ATP,n=5;(d)SA-β-Gal染色阳性率与图像,标尺100 μm,n=4;(e)γH2AX、p21、p16免疫荧光,标尺10 μm,n=4;(f–g)MitoSOX荧光强度,标尺10 μm,n=5;(h–i)JC-1红/绿比,标尺10 μm,n=5;(j)OCR基础、最大及ATP偶联呼吸,n=3;(k)Western blot示SIRT1、PGC-1α、mtTFA、NRF1/2及γH2AX、p16、p21、p53;(l)mt-mKeima报告线粒体自噬,标尺10 μm,n=5;(m)H₂O₂衰老模型⁺NZM差异基因热图,n=3;(n)氧化磷酸化与衰老相关基因火山图(|log2FC|≥1,adjP<0.05);(o)GSEA氧化磷酸化基因集富集
(6)NZM恢复骨质疏松症患者的骨再生能力和促进伤口愈合
体外衰老MSC经NZM处理后碱性磷酸酶活性及钙结节量显著高于NAD⁺、ZIF-8或NZ组(图6a–d),成骨蛋白与mRNA同步上调。可注射水凝胶负载Cy5-NZM,3 dpi时荧光与巨噬细胞共定位,Ly6Chigh单核/巨噬细胞Cy5-MFI高于干细胞及其他细胞(图6a、b);14 dpi时荧光与干细胞共定位,干细胞Cy5-MFI反超其他细胞(图6c、d)。骨质疏松骨缺损模型中,NZM@Gel组4周骨愈合优于空白凝胶及NZ@Gel组;NZM-CXCL12@Gel组BV/TV与BMD最高(图6f、h)。微CT显示骨量持续增加(图6g)。4周后G5组H&E及Masson示结缔组织与类骨组织最多(图6i),病灶区NAD⁺及NAD⁺/NADH升高,OCN表达增强,ROS降低(图6j)。流式示Ly6Chi促炎单核/巨噬细胞比例由≈84%降至≈62%,CD206⁺ M2比例升高(图6k、l);免疫荧光示iNOS下调、ARG1上调。CXCL12协同NZM招募干细胞并减少CD45⁺免疫细胞浸润,实现早期免疫调控与晚期干细胞功能恢复。全层皮肤缺损模型中,水凝胶负载NZM局部注射后滞留于创面,无全身扩散(图6m)。NZM@Gel组(G3)愈合速度显著快于未处理组(G1)及空白凝胶组(G2),NZM-CXCL12@Gel组(G4)再加速(图6n)。组织学示G3/G4再上皮化增厚、真皮再生且瘢痕减少(图6o);Masson染色胶原沉积增加,G4新生毛囊数量最高。CD31免疫荧光显示G3/G4血管密度升高,G4干细胞招募最多。5 dpi时,G3/G4创面CD45⁺浸润减少,Ly6Chi单核/巨噬细胞比例下降,CD206⁺细胞比例上升;iNOS荧光减弱,ARG1增强(图6p)。ELISA示IL-1β、IL-6、TNF-α下调,TGF-β、IL-10上调。结果表明,该平台可序贯调控免疫、促进血管与基质重塑,显著加速创面愈合。
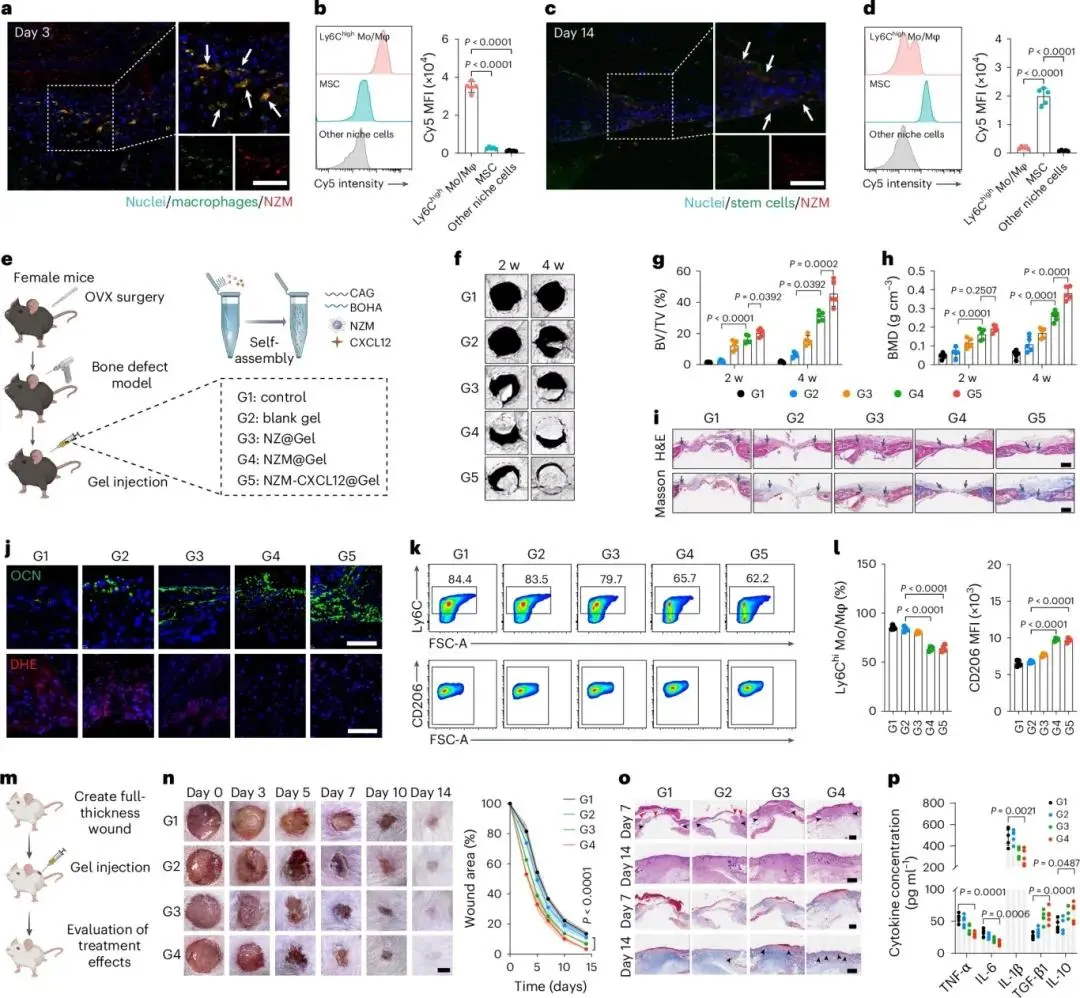
图6.(a)3 dpi荧光示NZM富集巨噬,(b)流式验证其跨细胞类型分布,n=5,标尺100 μm;(c)14 dpi荧光示NZM转向干细胞,(d)流式示干细胞摄取增加,n=5,标尺100 μm;(e)骨质疏松颅骨缺损实验流程;(f)颅骨缺损CT代表性图像,(g–h)2 w与4 w BV/TV及BMD定量,n=5;(i)4 周H&E与Masson染色,标尺200 μm;(j)OCN与DHE免疫荧光,标尺50 μm;(k–l)流式Ly6Chi M1比例与CD206 MFI,n=4;(m)皮肤创面实验流程;(n)0–14 d创面面积图像及定量,n=5,标尺2 mm;(o)H&E与Masson染色,标尺500 μm(d7)、400 μm(d14);(p)治疗后第5天创面TNF-α、IL-6、IL-1β、TGF-β1、IL-10水平,n=5
本研究构建了一种时空自适应纳米治疗系统,以葡萄糖修饰的杂合细胞膜囊泡为基础,能够在组织再生的不同阶段选择性地靶向巨噬细胞和干细胞。通过协同递送 NAD⁺ 至关键细胞群体,该系统实现了多细胞再生微环境的动态重塑,从而显著促进多组织修复。该策略为组织再生提供了一种可推广的细胞特异性与阶段特异性调控新范式,利用内源性代谢物实现高安全性与临床可转化性。总体而言,该时空自适应纳米治疗平台将纳米医学与再生医学有机融合,为精准干预组织修复提供了一种具有应用前景的创新思路。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

