
骨科手术中常出现难以控制的出血与术后骨缺损部位骨再生能力差现象。目前临床上广泛使用的传统蜂蜡基骨蜡虽具有良好的止血效果,但其不可降解的特性会阻碍组织愈合进程,并可能引发慢性炎症反应,甚至导致骨愈合延迟和纤维包封等并发症。
尽管近年来已开发出部分可吸收骨蜡(如基于磷酸钙水泥CPC的产品或商品化产品Ostene、BoneSeal等),但这些材料普遍存在降解不完全、稳定性依赖水化反应、止血功能单一且骨修复效果不佳等问题,无法实现止血与骨再生的协同促进。此外,一些可吸收材料在体内转化为缺钙羟基磷灰石,反而会延迟细胞和血管的早期浸润,影响骨重塑过程。因此,临床上亟需一种新型止血材料,能够在实现快速、有效止血的同时,主动促进骨组织再生,兼具良好的生物相容性与可控的降解性能,从而真正实现“止血-降解-成骨”的协同治疗策略。

针对上述挑战,暨南大学郭瑞团队提出了一种“止血-降解-成骨”协同设计的新范式,开发出一种基于聚合物分散基质的新型可生物降解骨蜡,即季铵化阳离子淀粉(QS)与β-磷酸三钙(β-TCP)双相促进基质(PST骨蜡)。该材料以QS和β-TCP为核心功能组分,其中QS凭借其高密度正电荷可静电吸附红细胞并激活血小板糖蛋白受体,同时其微孔结构通过毛细作用富集凝血因子,显著增强止血效能;β-TCP则模拟天然骨矿物质组成,降解过程中持续释放Ca²⁺和PO₄³⁻离子,促进骨髓间充质干细胞(BMSCs)的成骨分化,并原位形成纳米羟基磷灰石(HA)晶体,为新骨形成提供天然矿化支架。材料采用Poloxamer 188(P188)和PEG-PPG共聚物作为分散基质,确保QS与β-TCP均匀分散,同时赋予材料类似传统骨蜡的可塑性和黏附性,便于术中按压填充,并调控降解速率以避免过载等副作用。体外实验表明该骨蜡具有优异的密封性与持久止血能力,体内兔和比格犬模型验证了其高效的止血效果与显著的骨再生促进作用,最终通过QS与β-TCP的协同作用实现了即时止血与长期骨修复的统一,展现出良好的生物相容性与临床应用前景。该文章以《Novel Bioresorbable Bone Wax for Potentiated Hemostasis and Osteogenesis》为题,于2025年10月13日发表于《Advanced Science》期刊(DOI: 10.1002/advs.202514616)。
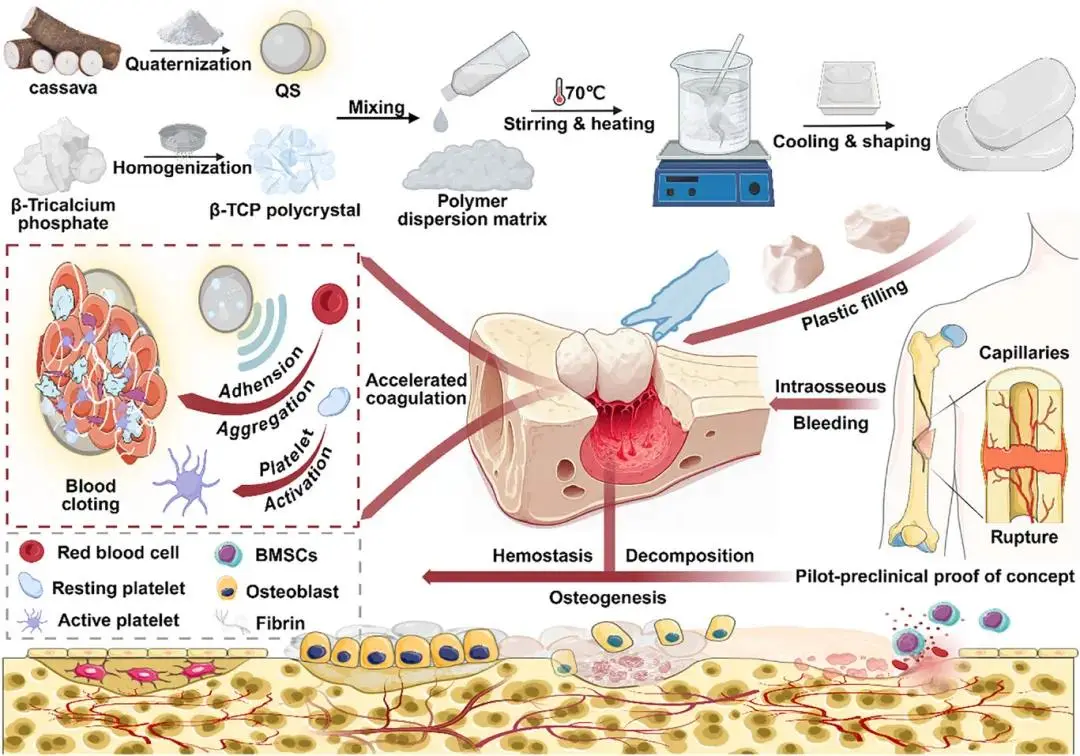
合成的生物可吸收骨蜡止血和成骨材料示意图。新型可吸收骨蜡的制备方法及其通过血细胞聚集加速凝血和促进骨再生的机制
(1)PST骨蜡的合成表征
图1A展示了季铵化阳离子淀粉(QS)的扫描电子显微镜(SEM)图像(比例尺:10 μm),显示其具有均匀的球形形貌;同时该图还比较了不同组分骨蜡的表面形态,发现仅含β-TCP的PT骨蜡表面粗糙且疏松,而添加QS后的PST骨蜡则呈现出更均匀、致密的结构,这有利于更好地封堵骨缺损处破裂的血管。图1B提供了QS的粒径分布测量结果,证实其粒子尺寸集中在4–10 μm范围内,为材料的均匀分散和功能发挥奠定了基础。图1C展示了QS的Zeta电位测定结果,其值为14.5 ± 0.66 mV,归因于其分子上的季铵盐基团所带的稳定正电荷,这种正电性有助于增强其在聚合物基质中的分散稳定性,并促进红细胞聚集以加强止血效果。为了评估材料的临床可操作性,研究进行了质地分析,如图1D所示为质地分析的示意图,模拟手指按压揉捏时材料的抗压阻力;对应的图1E展示了质地分析曲线,结果显示随着QS和β-TCP含量的增加,PST骨蜡的初始硬度显著提升,其中PST3样品达到1.17 ± 0.18 N/mm,与强生(J&J)商用骨蜡相当,且粘附变形从5.32 ± 0.58 mm显著降低至2.49 ± 0.46 mm,最大粘附力也随β-TCP增加降至约0.42 N,粘附能从3.1 ± 0.6 mJ大幅下降至约1 mJ,表明材料更不易粘连手术器械,具备理想的塑性和低黏性。此外,所有PST骨蜡均可快速塑形成均匀膏体,具有良好延展性。最后,为评估止血持久性,研究设计了骨髓毛细血管栓塞模拟实验,其装置示意图见图1F,对应的图1G展示了液体密封持续时间的结果:PT骨蜡密封时间约为4小时,加入QS后延长至约20小时,而随着β-TCP含量增加,PST骨蜡的密封时间进一步延长至近32小时,证明其具备优异的长期封堵能力,能够有效抵抗骨内生理血压,维持止血效果。综上所述,该部分通过图文结合的方式全面论证了PST骨蜡在微观结构、电学性质、机械性能、加工性能及密封效能等方面的优越特性,为其后续作为兼具高效止血与成骨诱导功能的多功能生物材料的应用提供了坚实的理化基础。
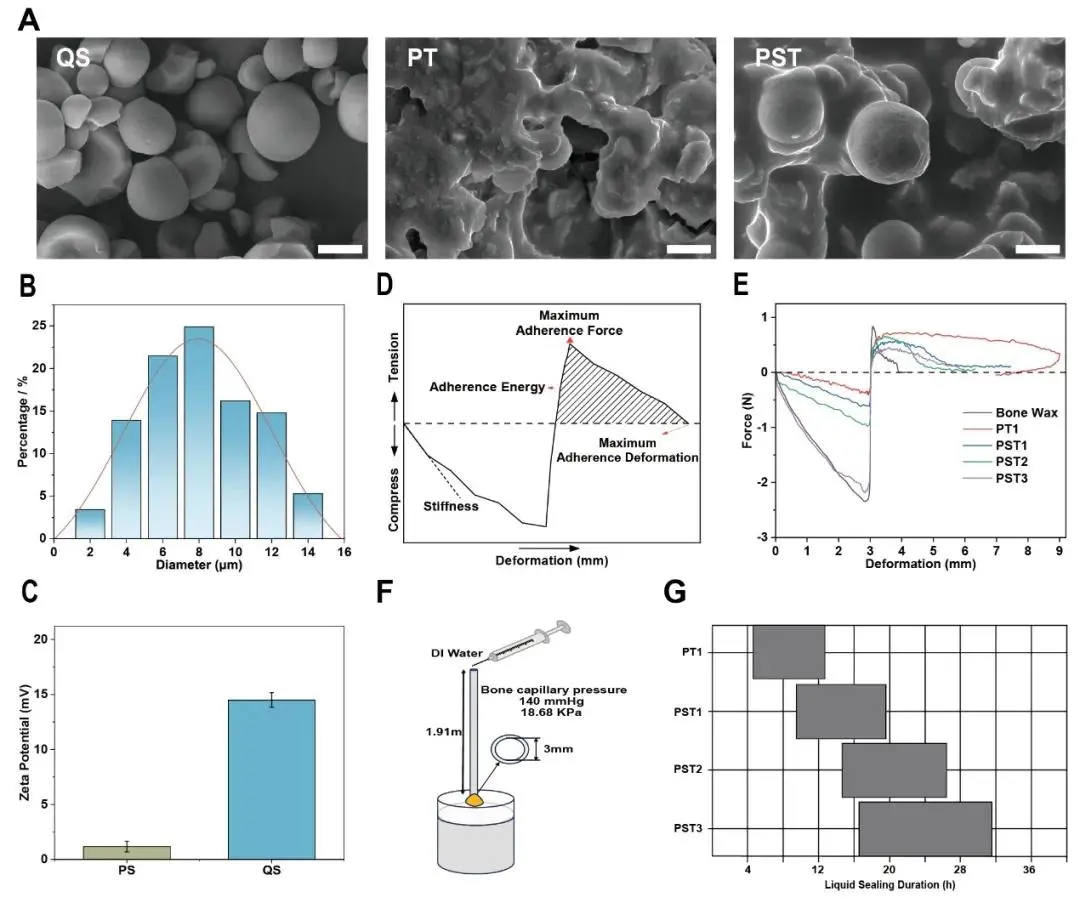
图1.PST骨蜡的特性。A)扫描电子显微镜观察可吸收骨蜡的表面形态(标尺,10μm;QS:季铵盐化阳离子淀粉;PT:含有仅含β-TCP的聚合物分散基质的骨蜡;PSt:含有QS和β-TCP的聚合物分散基质的骨蜡)。B)QS的粒度分布。C)Zeta势OFP和QS(PS:预糊化淀粉)。D)骨蜡质构分析示意图。E)骨蜡质构分析曲线。F)骨毛细血管压力封闭的体外模拟示意图。G)骨蜡液体封闭时间
(2)合成PST骨蜡的吸收和矿化行为
图2A展示了PST系列骨蜡在轻微振荡的PBS缓冲液中完全浸没后的溶解行为,结果显示随着QS的初始添加和β-TCP含量的增加,溶解速率逐渐减慢,尽管材料在8小时内完全溶解,表明其具有良好的可完全吸收性,同时QS和β-TCP的引入有效抑制了烷氧基共聚物在水中的快速完全溶解,防止骨蜡过早崩解。图2B呈现了体外可吸收性测试结果,显示PST骨蜡在48小时内缓慢溶解10–20%,而在28天内降解率超过80%,并残留一定量的矿化粉末,证明其具备可控且持久的降解特性。为追踪聚合物基质的降解情况,研究对降解过程中第1、4、7和10天的PBS上清液进行了FT-IR分析(图2C),发现PEG-PPG和P188的特征振动峰(-CH伸缩、-CH弯曲、-CO伸缩)仅在前7天可检测到,且透射强度持续下降,至第10天已低于检测限,表明聚合物分散基质在10天内几乎完全降解。图2D和2E通过ICP-MS分析了Ca²⁺和PO₄³⁻离子的释放动力学:Ca²⁺释放量在初始添加QS时无显著变化(最低2.67 ± 0.30 mg L⁻¹),但随着β-TCP含量增加,每日释放量提升0.23–0.43 mg L⁻¹,21天后累积达7.62 ± 0.42 至 14.53 ± 0.72 mg L⁻¹;PO₄³⁻释放趋势类似,初始不变,随β-TCP增加日均释放4.99–7.09 mg L⁻¹,21天后达186.0 ± 11.07 至 288.60 ± 15.8 mg L⁻¹,证实β-TCP是矿化离子的主要来源。此外,pH监测显示PST骨蜡降解过程中pH值在7天内从7.41–7.49轻微下降至7.35–7.43,随后两周回升至7.41–7.54并保持稳定,变化始终处于生理中性范围,且不受淀粉含量影响,说明材料降解不会引起局部酸化,生物安全性良好。进一步通过SEM观察PST骨蜡随时间的相组成演变(图2F),发现降解过程中有1–3 μm的微粒从溶液中析出,聚合物基质逐渐消失,留下QS和β-TCP残余。特别地,图2G展示了21天后残留物的SEM图像及EDS元素映射,显示均质化的QS(黄色)带有孔隙,并附着大量聚集的纳米晶体(绿色)、棒状、撕裂片状和针状晶体(蓝色),EDS确认Ca和P为主要元素,表明形成了磷酸钙类矿化产物。XRD分析(图2H)进一步证实,在7、14和21天时均可观察到羟基磷灰石(HA)的特征衍射峰,且峰强度随时间增强,表明PST骨蜡在降解过程中持续向HA转化。尤为关键的是,Scherrer公式计算显示(图2I),HA晶体尺寸在初始添加QS后显著从5.96 ± 1.5 nm增长至20.37 ± 4.56 nm,且XRD谱图显示21天后HA衍射峰强度明显增强,揭示QS不仅自身不降解,反而显著加速了HA的成核与晶体生长,促进功能性矿化。
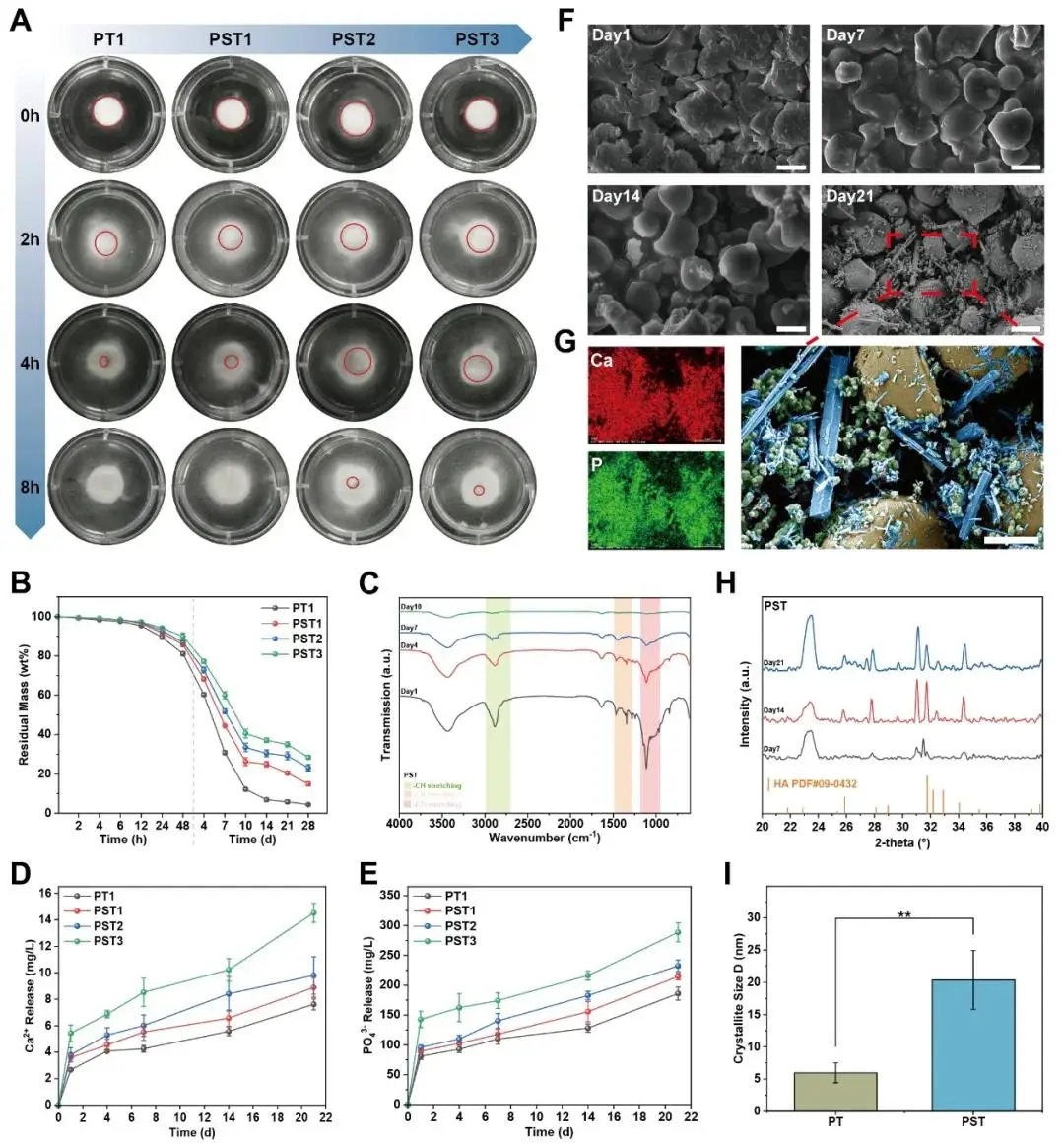
图2.PST骨蜡的吸收和矿化行为。A)骨蜡在PBS中的溶解度(红圈标记未完全塌陷的骨蜡)。(2)骨蜡吸收28天内的残余质量曲线。C)PST骨蜡吸收10天的FT-IR光谱。D)PST骨蜡吸收过程中钙离子和E)PO43−的释放。F)骨吸收后1、7、14、21天(标尺,10μm)扫描电子显微镜观察PST骨蜡的残留成分。G)骨吸收21d后PST骨蜡的元素分布和扫描电子显微镜假彩色图像(黄色:QS;绿色:β-Tcp;蓝色:β-Tcp矿化的羟基磷灰石;标尺,5μm)。H)PST骨蜡在21天的吸收过程中的X射线衍射,羟基磷灰石的特征峰(PDF参考文献)。09-0432)。1)基于Korsmeyer-Peppas模型的羟基磷灰石晶相参数的拟合
(3)PST骨蜡的细胞相容性和成骨性能性能
通过活/死细胞染色法检测BMSCs在1、3、5天后的存活状态(图3A),结果显示所有PST骨蜡组均表现出优异的细胞相容性,死细胞极少,且随着β-TCP含量增加,细胞增殖密度显著提高,表明材料无细胞毒性并能促进细胞生长。进一步通过CCK-8法评估BMSCs在7天内的细胞活力(图3E),发现与空白对照组相比,经PST骨蜡处理的BMSCs相对细胞活力显著增强,且该促进作用随β-TCP含量升高而加强,证实其对细胞代谢活性具有积极影响。此外,细胞迁移实验显示,在48小时内,随着β-TCP含量的增加,BMSCs的迁移面积明显扩大(图3B,F),进一步验证了PST骨蜡组分对细胞迁移能力的促进作用,强化了其良好的生物相容性和促修复潜力。为评价钙盐沉积效率和成骨分化能力,研究进行了碱性磷酸酶(ALP)染色(代表早期成骨分化)和茜素红S(ARS)染色(代表无机钙结节形成)。结果表明,添加QS并提高β-TCP含量的PST骨蜡显著增强了BMSCs的ALP活性,尤其以PST3组最为突出(图3C,G)。同样,ARS染色显示PST骨蜡促进了更多矿化结节的形成,其中PST3组的矿化程度最高(图3D,H),说明该材料具备强大的诱导矿化能力。为进一步从基因层面确认成骨促进效应,采用RT-PCR分析BMSCs中成骨相关基因的表达水平,结果显示PST骨蜡能够以β-TCP浓度依赖的方式上调Runt相关转录因子2(RUNX2)、骨桥蛋白(OPN)、骨钙素(OCN)、I型胶原蛋白(COL1)和ALP的mRNA表达,且初始添加QS进一步增强了这一上调作用(图3I),表明QS与β-TCP协同强化了成骨信号通路。免疫荧光染色针对成骨标志蛋白OPN的结果与此一致,PST3组显示出最强的OPN蛋白表达荧光信号(图3J,K),从蛋白水平再次验证了成骨分化的增强。综合来看,这些结果通过多维度实验充分证明PST骨蜡不仅具有卓越的细胞相容性,还能有效促进BMSCs的增殖、迁移和成骨分化,其机制主要归因于降解过程中持续释放的Ca²⁺和PO₄³⁻离子(结合图2D,E),最终实现“止血-降解-成骨”的功能一体化设计(图3L)。
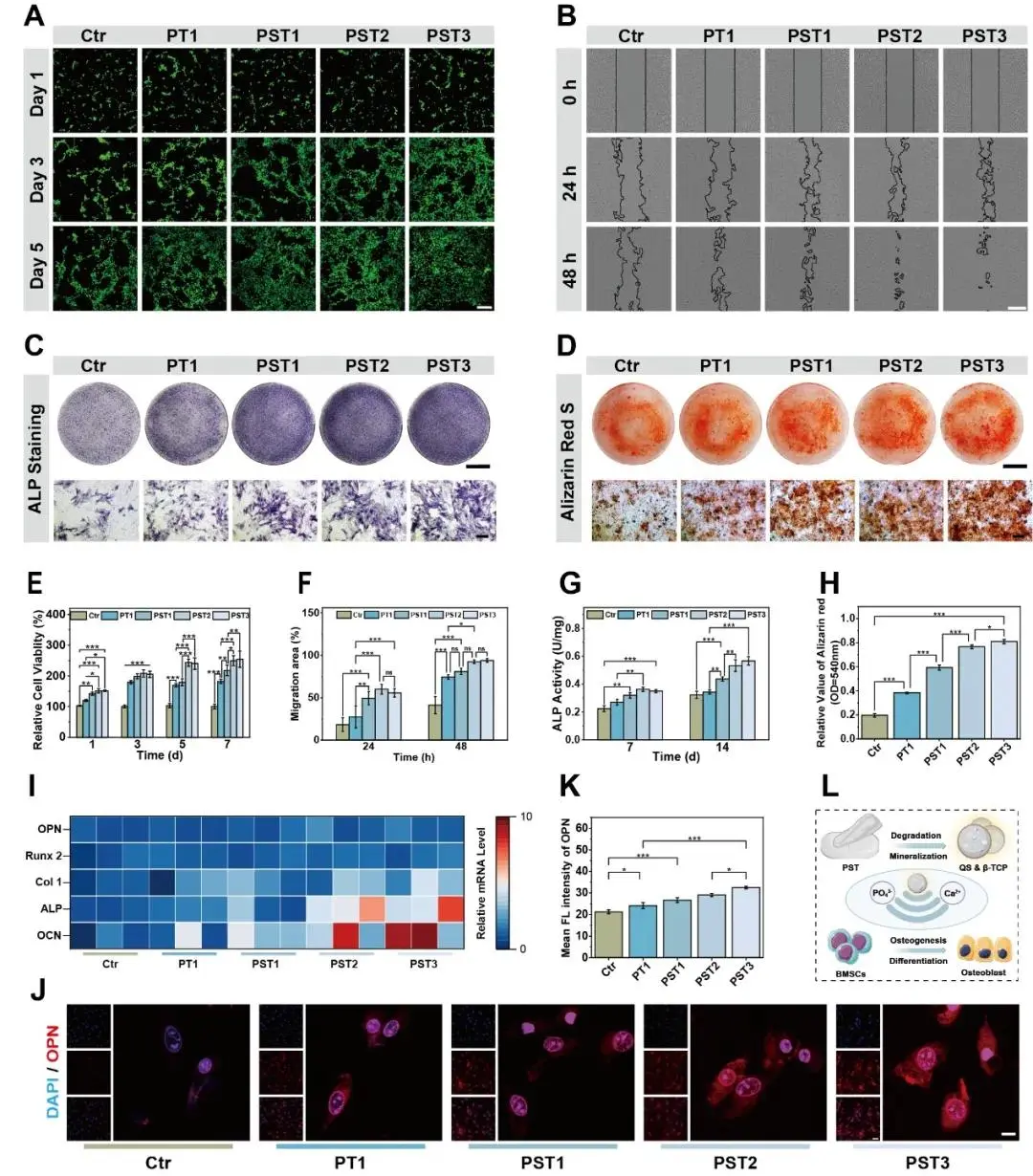
图3.PST骨蜡的细胞相容性和成骨性能。A)用骨蜡提取液培养1、3、5天的BMSCs进行活/死实验。活细胞显示为绿色,死亡细胞显示为红色(比例尺,200μm)。骨髓间充质干细胞经骨蜡提取液培养24和48h后的细胞迁移(标尺,400μm)。C)碱性磷酸酶染色:骨髓间充质干细胞与骨蜡提取物共培养14d(标尺,上1 cm;下500μm)。D)骨髓间充质干细胞与骨蜡提取物共培养21d(标尺,上1 cm;下500μm)进行ARS染色。用CCK-8检测骨蜡提取物对骨髓间充质干细胞增殖的影响。F)骨蜡提取液培养24 h和48 h的BMSCs细胞迁移面积的定量分析。H)ARS染色的钙结节的定量分析。1)骨蜡提取液培养14天的BMSCs成骨基因表达水平。(J)骨蜡提取物培养14天的骨髓间充质干细胞骨桥蛋白的免疫荧光染色(标尺,10μm)。K)定量分析OPN荧光强度。L)示意图,阐明了骨蜡促进BMSCs增殖和成骨的机制
(4)PST骨蜡的血液相容性和凝血性能
图4A示意图展示了PST骨蜡的止血过程:其季铵化阳离子淀粉(QS)所带正电荷与β-TCP释放的Ca²⁺协同作用,促进红细胞(RBCs)聚集和血小板(PLTs)激活,从而加速血凝块形成。为评估血液相容性,进行溶血实验,结果显示所有PST骨蜡组的溶血率均低于5%(图4B),符合生物材料安全标准,证实其良好的血液相容性。在体外全血凝血实验中,通过检测上清液中血红蛋白(HGB)吸光度来反映未参与凝集的RBC数量,所有骨蜡组均表现出促凝效果,上清液比对照组更澄清;随着QS和β-TCP含量增加,血液聚集能力增强,表现为更低的吸光度值(PST3 < PST2 < PST1 < PT1),其中PST3在20分钟内即实现完全凝血,吸光度接近零且上清液几乎透明,而缺乏QS的PT骨蜡促凝效果明显较弱,突显QS在增强促凝活性中的关键作用(图4C,D)。进一步通过扫描电镜(SEM)观察PST骨蜡对RBCs聚集和PLTs黏附/活化的影响,结果显示:与纱布对照组仅有零星RBC黏附相比,PT组在β-TCP周围出现更多RBC聚集;而添加QS的PST骨蜡则展现出显著更强的RBC聚集能力,且聚集程度随β-TCP含量升高而增加(图4E)。在血小板行为方面,PT组已表现出明显的PLTs在β-TCP上的黏附与激活,而PST骨蜡因含QS进一步显著增强了PLTs的黏附;PLTs形态从静息态的“双凸盘状”转变为激活后的“星形”树突状,伪足延伸并铺展于QS表面,最终形成由交织伪足和纤维蛋白网络构成的“蜂窝状”结构,表明PST骨蜡能有效激活并聚集血小板(图4F)。此外,乳酸脱氢酶检测显示PST组非黏附血小板数量显著减少,进一步验证其卓越的血小板聚集能力;钙离子荧光检测显示PST组胞内Ca²⁺水平(荧光强度)高于对照组和PT组(图4G),表明其诱导了更强的血小板激活。为进一步评估体外止血性能,采用血凝指数(BCI)实验,结果显示无论是否添加CaCl₂,所有PST骨蜡的BCI值均显著低于纱布对照组,且随QS和β-TCP含量增加而降低;特别是PST2和PST3在有无CaCl₂条件下BCI值相近,表明其止血功能不依赖外源性凝血因子,具有独立于凝血系统的止血能力;其中PST3的BCI值最低,止血性能最优。最后,活化部分凝血活酶时间(APTT)和凝血酶原时间(PT)测试表明,与对照组和PT骨蜡相比,添加QS并提高β-TCP含量显著缩短了APTT,而PT无显著差异(图4H,I),提示PST骨蜡主要通过激活内源性凝血途径发挥促凝作用。
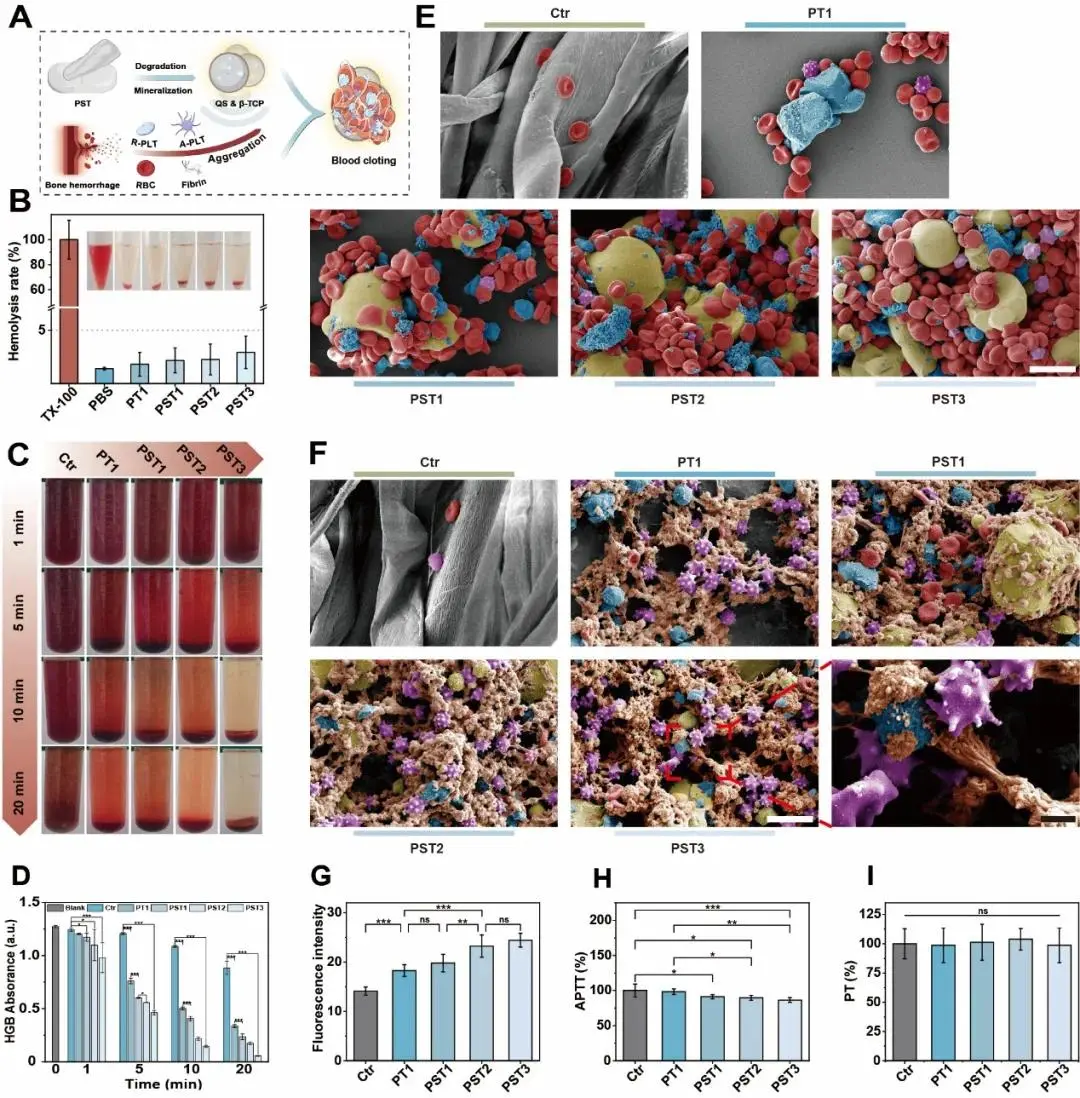
图4.PST骨蜡的血液相容性和血细胞聚集特性。A)PST骨蜡促进红细胞聚集和血小板活化的示意图。B)PST骨蜡溶血试验(TX-100:Triton X-100)。C)在红细胞悬液中与PST骨蜡共同孵育20分钟后的红细胞聚集。D)PST骨蜡与稀释的红细胞悬液共同孵育20分钟后上清液中HGB含量。E)PST骨蜡聚集红细胞的扫描电子显微镜伪彩色图像(比例尺,10μm)。扫描电子显微镜下PST骨蜡(标尺,10μm)及其局部放大图像(标尺,2μm;红色:红细胞,蓝色:β-Tcp,黄色:QS,紫色:PLT,橙色:纤维蛋白包裹的β-Tcp)的血小板聚集和激活的扫描电子显微镜伪彩色图像。(G)PST骨蜡激活的PLT细胞内钙荧光强度。H)PST骨蜡APTT试验。1)PST骨蜡PT试验
(5)PST骨蜡的体内止血和促进成骨作用
进一步地,通过兔胫骨松质骨缺损模型系统评估了PST骨蜡的体内止血与成骨修复能力。首先,实验建立了兔胫骨缺损模型,并在术后即刻及术后第1、4、7天采集血液样本以评估止血效果和全身反应(图5A)。术中应用PST骨蜡后,缺损部位出血立即停止;与纱布对照组在3分钟内失血达2.32 ± 1.2 mL相比,所有骨蜡组均几乎无血液流失;尤为突出的是,商用J&J骨蜡在3分钟后仍存在轻微渗血,而所有PST骨蜡组均在3分钟内完全实现止血,这归因于其优异的可塑性和黏附性,能够有效封闭骨髓裂隙和窦状隙,阻断血流(图5B,C)。术后监测外周血指标显示,所有组别的血红蛋白(HGB)水平均维持在正常范围(80–160 g L⁻¹),但PST3组在术后第4天和第7天的HGB水平显著高于空白组和其他骨蜡组(图5H),表明其术中出血更少,有利于术后HGB的恢复与生成。血小板(PLT)水平方面,各组在术后第1天均升高以促进初期止血,随后逐渐回落至正常范围(150–400×10⁹ L⁻¹);其中PST1和PST3组恢复最快,提示其能更有效地控制持续性出血并维持血液稳态,而PT1组在第4天出现PLT异常升高,可能提示存在短暂的继发性出血(图5I)。此外,通过监测白细胞(WBC)及其亚群(淋巴细胞Lym、嗜酸性粒细胞Eos、中性粒细胞Neu)评估术后炎症反应,结果显示纱布组WBC显著升高,而商用J&J骨蜡组的WBC、Lym、Eos和Neu均超出正常生理范围,表明引发明显炎症反应;相比之下,PT、PST1和PST3骨蜡组各项指标均保持在正常范围内(图5J–M),证明其具有良好的生物相容性且无短期免疫排斥。为进一步评估长期骨修复能力,术后4周和8周取胫骨样本进行组织学与影像学分析。H&E和Masson染色结果显示(图5D,E),空白组和J&J骨蜡组在第4周时缺损区存在大量炎症细胞(黄色三角标记),第8周仍可见部分残留;且J&J骨蜡因不可降解导致明显的纤维组织包裹(白色三角标记),持续阻碍新骨形成;而PT、PST1和PST3组炎症细胞极少。更重要的是,PST骨蜡组显著促进骨再生:术后4周,PT1、PST1和PST3组已形成具有不规则孔隙的新生小梁骨网络结构(红色三角标记),其中PST3组骨网络最致密;至第8周,该结构进一步成熟为致密的皮质骨。免疫组化定量分析成骨标志物OCN、OPN和RUNX2的表达,结果显示PST骨蜡组显著高于空白组和J&J组(图5P–R),进一步证实其卓越的骨再生能力。同时,对炎症与免疫调控相关因子TNF-α和IL-6的检测显示(图5F,G),J&J骨蜡组在第4周呈现明显阳性表达,纱布组也有一定表达(可能因持续出血所致),而PT、PST1和PST3组则无显著表达;定量分析进一步证实J&J组TNF-α和IL-6阳性面积百分比显著高于纱布组和PST3组(图5N,O),结果与H&E染色一致,表明PST骨蜡在骨再生过程中引发极低的炎症与免疫反应。此外,PST骨蜡组的血液学与生化指标均在正常范围,心、肝、脾、肺、肾的H&E染色也显示正常组织结构,充分验证其体内生物安全性。
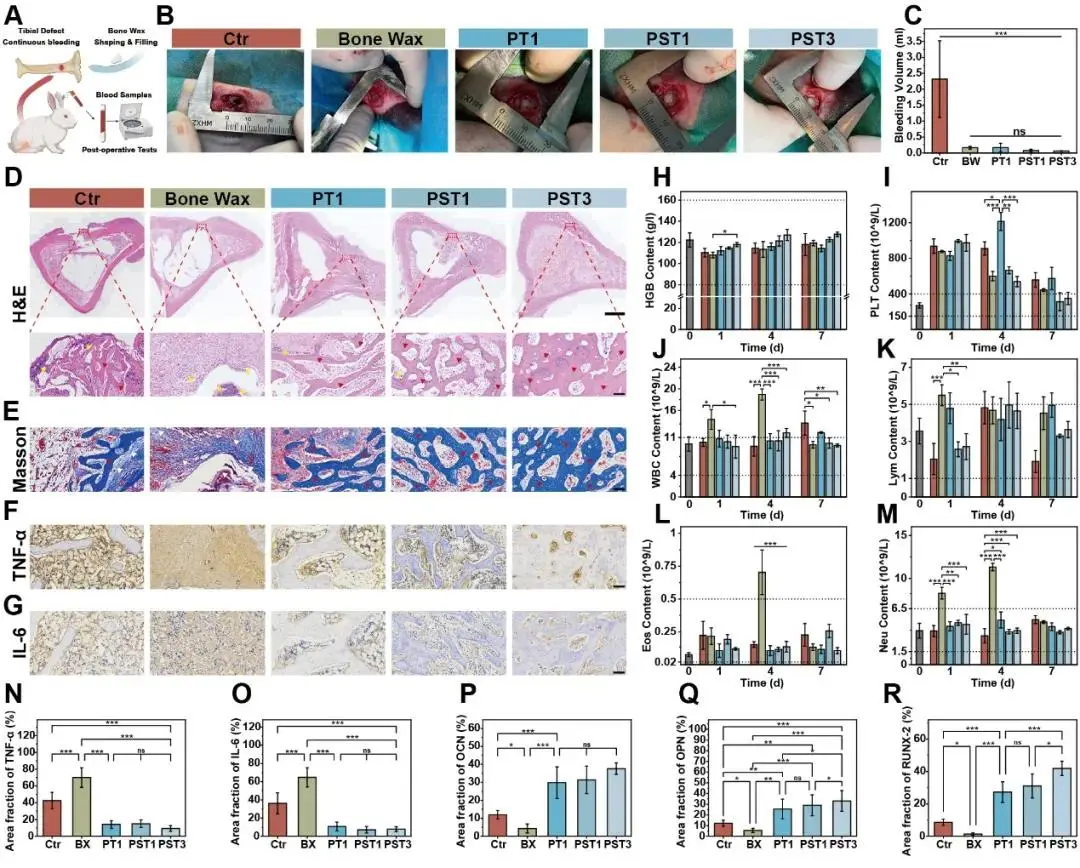
图5.兔松质骨缺损模型中PST骨蜡的治疗。A)PST骨蜡在兔胫骨缺损模型中的应用示意图。B)术中使用不同骨蜡对骨缺损处止血的数字图像。C)在缺损处涂抹骨蜡后3分钟内失血。D)用不同的骨蜡处理4周后的骨切片进行HE染色(标尺,1000μm),并放大缺损区的视野(标尺,100μm;黄色三角形,炎性细胞;红色三角形,新骨组织)。E)4周后取骨切片进行Masson三色染色(标尺,100μm;白色三角形,肌纤维)。F)和G)治疗4周后取骨切片进行免疫组织化学染色。H)治疗后7天内全血标本中HGB、I)PLT、J)WBC、K)LYM、L)EOS和M)Neu含量的变化。N)肿瘤坏死因子-α,O)IL-6,P)OCN,Q)OPN,R)RUNX2免疫组织化学染色定量
进一步,利用micro-CT技术对骨再生过程进行了全面量化分析。图6A展示了术后第4周和第8周各组兔子胫骨的micro-CT三维重建图像(比例尺:5 mm),结果显示从术后第4周起,除强生(J&J)商用骨蜡组外,所有实验组均表现出新骨从缺损边缘向中心逐渐长入的趋势;而J&J骨蜡组在第8周仍存在持续性骨空腔,甚至出现异位骨增生现象,表明其不可降解特性严重阻碍了正常骨愈合进程。相比之下,PST3骨蜡组在第8周即实现缺损区域的完全修复,形成致密的新骨结构,显著优于空白对照组、PT1组和PST1组,凸显其卓越的骨再生能力。进一步通过冠状面和横断面的micro-CT切片图像(图6B,C)显示,PST各组的缺损区域明显缩小,骨密度显著增加,而对照组则仍存在未愈合的空腔,直观反映了PST骨蜡对骨组织再生的促进作用;大体标本观察也证实PST处理的缺损区表面光滑完整。在定量分析方面,图6D展示了骨矿密度(BMD)的测量结果,PST骨蜡表现出随QS和β-TCP含量增加而增强的成骨效应:PST3组在术后4周和8周的BMD分别达到0.30 ± 0.01 g/cm³和0.34 ± 0.01 g/cm³,显著高于空白对照组的0.23 ± 0.02 g/cm³和0.27 ± 0.01 g/cm³,表明其能更快地实现骨质矿化。此外,图6E–G分别展示了骨体积分数(BV/TV)、骨小梁数量(Tb.N)和骨小梁厚度(Tb.Th)的统计结果,三者均随着PST骨蜡中QS和β-TCP含量的增加而持续升高,说明新形成的骨组织不仅体积更大,且微观结构更加致密和成熟。
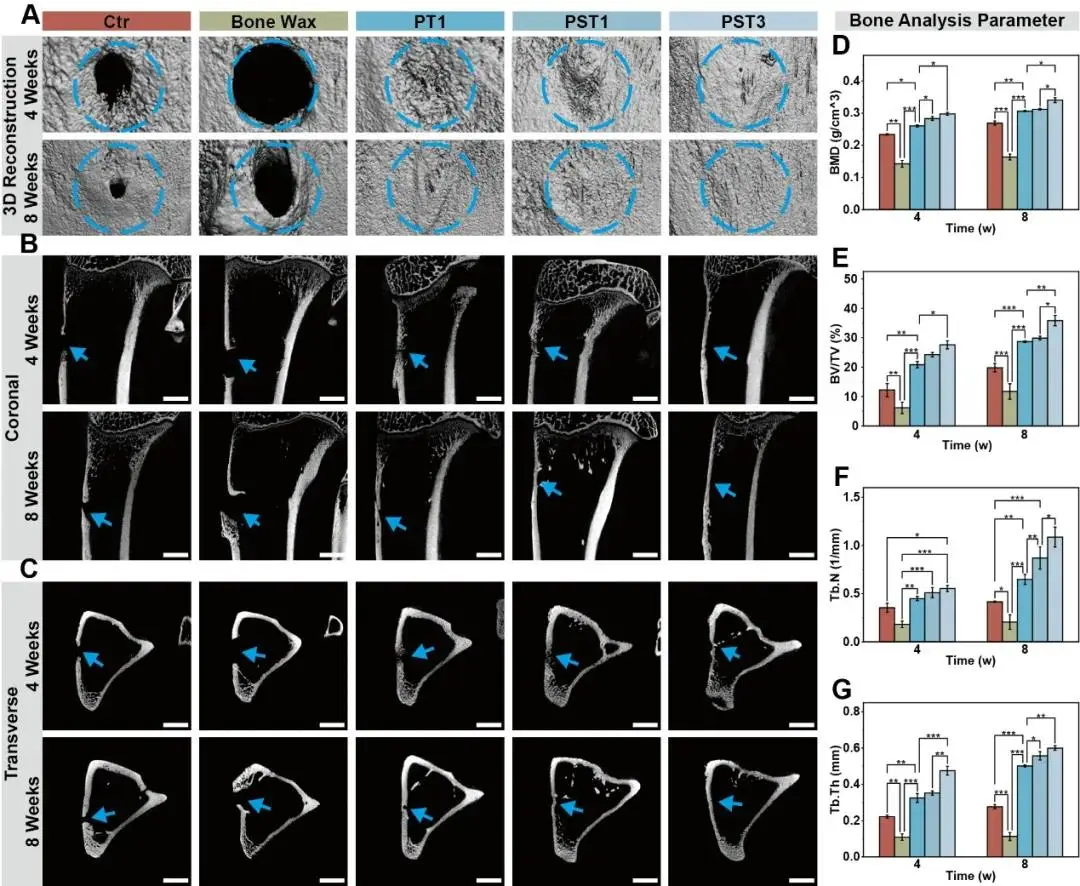
图6.PST骨蜡再生能力的放射学评估。A)植入后4周和8周兔胫骨缺损处的Micro-CT三维重建图像(蓝色圆圈,直径4 mm)。B)冠状和C)胫骨缺损区的横断面显微CT图像(比例尺,4 mm;蓝色箭头,骨缺损区)。D)骨密度(BMD),E)骨体积/总体积(BV/Tv),F)骨小梁数量(Tb.N),G)骨小梁厚度(Tb.Th)。每组n≥3。误差条表示平均值±SD;*p<;0.05、**p<;0.01和*p<;0.001
进一步验证其PST骨蜡在大动物体内的多功能疗效。首先,图7A展示了实验设计示意图,即在比格犬胫骨建立松质骨缺损模型,作为关键的临床前研究模型;在术中止血评估中,PST3组在3分钟内出血量仅为0.69 ± 0.47 mL,显著优于纱布对照组(5.0 ± 0.5 mL)和强生(J&J)骨蜡组(1.6 ± 0.62 mL),表明其具有卓越的快速止血能力。在高生理血压条件下,PST3能在3分钟内完全控制出血且材料无崩解,而J&J骨蜡仍有轻微渗血,纱布组则持续出血(图7B)。术后第1天,PST3组伤口渗出量显著低于J&J骨蜡组(3.8 ± 0.81 mL)和空白对照组(8.6 ± 0.56 mL),至第7天仍维持较低水平(PST3: 0.3 ± 0.27 mL vs 空白: 5.1 ± 0.71 mL),证实其能有效抑制顽固性骨缺损出血;同时,空白对照组在第7天出现明显肿胀,J&J组为轻度肿胀,而PST3组无肿胀,进一步验证其持久止血效果。为评估骨再生能力,于术后6周和12周取材进行显微CT(micro-CT)分析,代表性3D重建图像显示(图7G,H),各组(空白、J&J骨蜡、PST3)缺损修复随时间进展,其中PST3组在12周时已形成致密的网状小梁骨桥接结构并实现皮质骨完全覆盖;而空白对照组在6周时缺损仍暴露,12周时仅有松散排列的小梁部分填充缺损;尤为关键的是,不可降解的J&J骨蜡因阻碍组织长入而完全抑制新骨形成。进一步对横断面进行micro-CT分析(图7I,J)显示,空白对照组在6周时(Transverse-2层面)仍存在持续性骨空腔,仅在Transverse-1和-3层面有有限的骨痂形成,而PST3组在冠状面和横断面均实现了更优的缺损填充密度。定量骨形态计量学分析一致证实,PST3组的新骨体积和骨矿密度显著高于各对照组(图7C–F)。大体标本观察结果与影像学一致:空白组仍可见明显缺损,J&J组出现异位纤维组织包封,而PST3组则形成光滑的皮质骨表面,无过度异位组织增生,这归因于其可生物降解性及内在的成骨能力。随后,清除胫骨周围肌肉组织后,对骨样本进行H&E和Masson染色组织学分析,结果显示(图7K,L):J&J骨蜡在6周和12周均引发大量与炎症相关的细胞浸润(黄三角),并出现进行性纤维包封(白三角),表明其生物相容性差;相反,PST3组因固有的可降解性,在6周时炎症反应轻微,至12周时已发展为正常的组织形态(有序的细胞结构,无炎症细胞)并形成复杂交织的骨结构(红三角)。
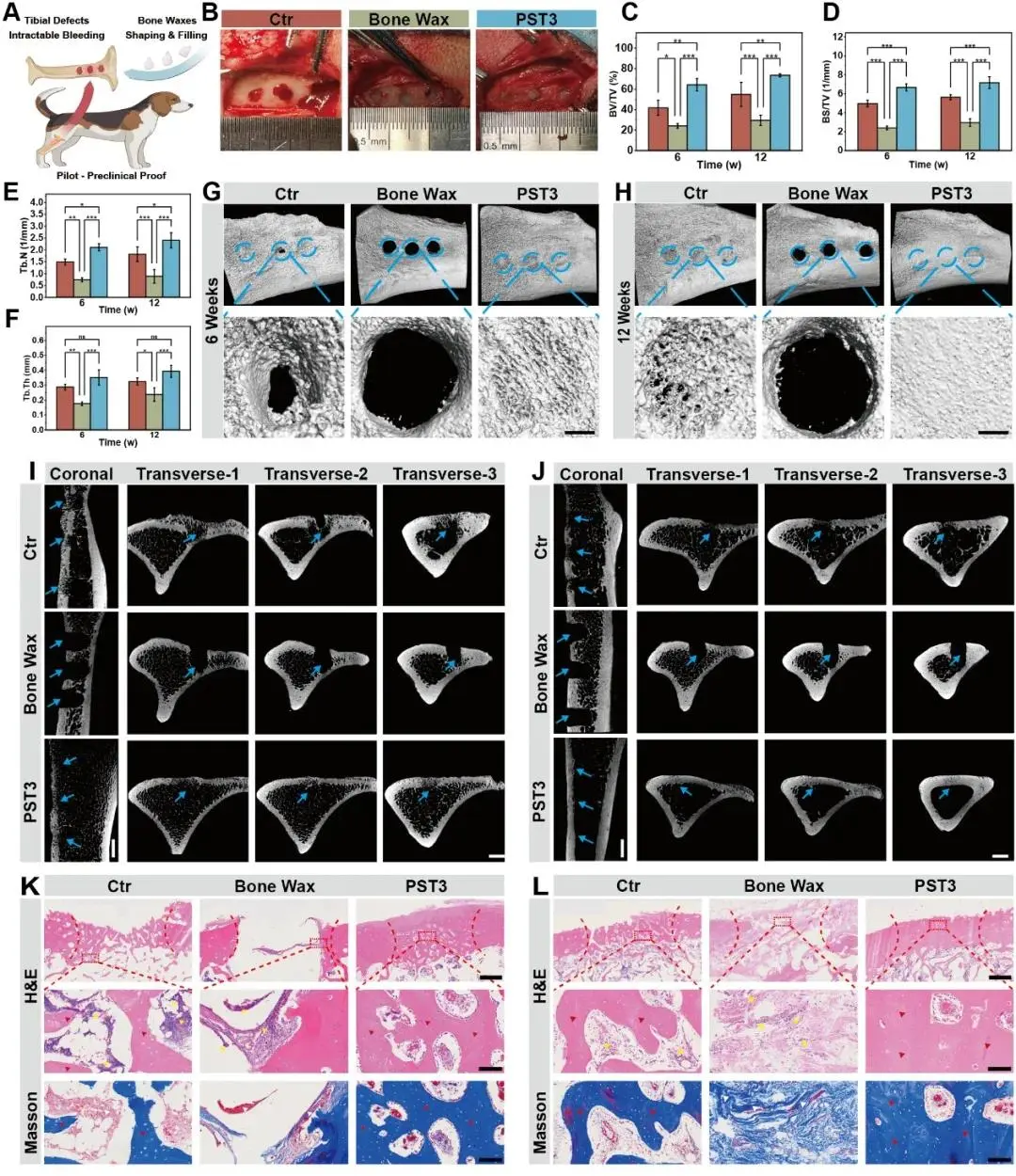
图7.在Beagle松质骨缺损模型中PST骨蜡的治疗。A)PST骨蜡在Beagle胫骨骨缺损模型中的应用示意图。B)术中使用不同的骨蜡在骨缺损部位止血的数字图像。C)BV/TV,D)骨表面与总体积之比(BS/TV),E)Tb.N,F)Tb.Th基于Micro-CT的分析。G)植入后12周(蓝色圆圈,直径4 mm)的Beagle胫骨缺损区的MicroCT三维重建图像,显示缺损区的放大图像(比例尺,1 mm)。I)和J)6周和12周胫骨缺损区的冠状位和横断位的显微CT图像(标尺,4 mm;蓝色箭头,骨缺损区)。(K)用不同的骨蜡(鳞片,1000μm)和缺损区放大观察(鳞片,100μm;黄色三角形,炎性细胞;红色三角形,新骨组织;白色三角形,肌纤维)治疗6周和(L)12周后的骨切片进行H&E和Masson三色染色。每组n≥3。误差条表示平均值±SD;*p<;0.05、**p<;0.01和*p<;0.001
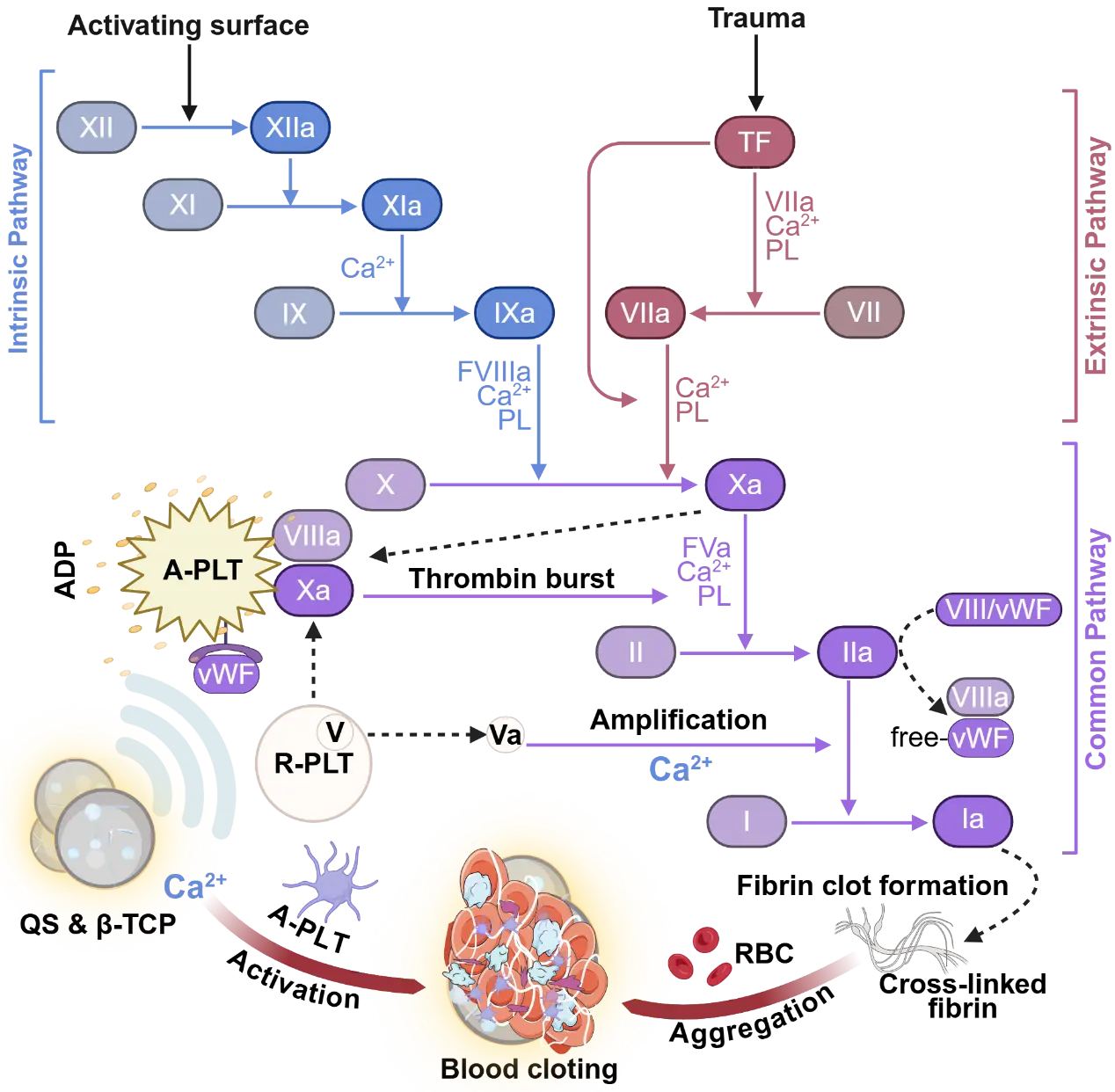
(6)PST骨蜡实现卓越止血效果的多阶段协同凝血机制讨论
如图8所示,PST骨蜡的止血过程被归纳为一个多层次的凝血级联反应:在凝血启动阶段,带正电荷的季铵化阳离子淀粉(QS)表面(由图1C中Zeta电位14.5 ± 0.66 mV证实其稳定正电性)能够吸附组织因子(TF)和骨胶原,促进TF-VIIa复合物的形成,进而催化因子X向Xa的转化;与此同时,QS直接激活血小板(PLTs),驱动其形态从静息态的双凹圆盘状转变为活化的树突状或蜂窝状结构(这一形态转变在图4F的SEM图像中以紫色/橙色高亮清晰展示),并伴随磷脂酰丝氨酸暴露和ADP释放的增强,从而放大凝血信号。进入凝血扩增阶段,β-TCP降解过程中持续释放的Ca²⁺离子(其释放动力学由图2D的ICP-MS数据定量呈现)作为关键辅因子,激活血小板表面的VIIIa-Xa复合物,催化“凝血酶爆发”(thrombin burst),显著加速凝血进程。在凝血放大阶段,Ca²⁺进一步介导纤维蛋白原交联形成纤维蛋白,最终在PST骨蜡表面构建致密的血凝块网络。这种由QS和β-TCP协同驱动的多级联机制产生了显著的生理效应:在大型哺乳动物模型中实现了即时且持久的止血效果,即使在120–160 mmHg的高生理血压下仍能维持结构完整性,无渗漏(图7B);体外实验显示活化部分凝血活酶时间(APTT)显著缩短,证实内源性凝血途径被有效激活(图4H);术后第7天引流量极低(0.3 ± 0.27 mL),边缘无渗出,表明其密封性能优异。
![]()
图8.PST骨蜡利用其带电表面和受控的钙释放,在骨出血部位局部快速启动、传播和放大整个凝固级联,从而实现卓越的防渗漏止血。
本研究针对传统骨蜡不可降解、抑制骨再生及引发慢性炎症等临床难题,创新性地提出“止血-降解-成骨”协同设计范式,开发出一种新型可生物降解的多功能骨蜡(PST骨蜡),该材料以季铵化阳离子淀粉(QS)和β-磷酸三钙(β-TCP)为核心构建双相促进基质(PST),结合聚合物分散体系实现优异的可塑性与黏附性,其创新点在于首次将高效止血与主动促骨再生功能一体化:QS通过正电荷吸附红细胞、激活血小板并启动内源性凝血通路,β-TCP则持续释放Ca²⁺和PO₄³⁻离子诱导BMSCs成骨分化并原位矿化形成羟基磷灰石(HA),同时材料自身可完全降解,避免异物残留。研究通过系统的体外与兔/比格犬体内实验证明,PST骨蜡不仅能在高生理血压下实现快速、持久止血(BCI值低、APTT缩短、术后渗出极少),更显著促进新骨生成,Micro-CT与组织学分析显示其在骨缺损部位实现高密度骨填充且无纤维包封,而传统蜂蜡基骨蜡则导致骨愈合停滞。该材料展现出卓越的生物相容性、可控降解性与pH稳定性,兼具即时止血与长期骨修复双重功效,克服了现有止血产品功能单一的局限,具有极高的临床转化价值,有望成为骨科手术中替代传统不可吸收骨蜡的理想选择,广泛应用于创伤、脊柱、关节置换等存在出血与骨缺损风险的外科场景,推动骨修复材料向智能化、多功能化方向发展。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

