
研究背景:
衰老性骨质疏松(SOP)随增龄隐匿发生,全球患者已逾2亿,骨折风险高、致残率高,成为老龄化社会沉重负担。传统研究将病理核心归于骨髓间充质干细胞(BMSCs)衰老,其成骨-成脂分化失衡导致骨形成减少、骨髓脂肪增多。然而,近年发现衰老单核/巨噬细胞(S-BMDMs)通过分泌SASP因子和胞外囊泡,把DNA损伤、线粒体功能障碍及炎症信号“传染”给BMSCs,形成“衰老-炎症-骨丢失”恶性循环,提示仅靶向BMSCs疗效有限,须重塑免疫-干细胞互作。
线粒体质量控制是维持骨骼稳态的关键;健康线粒体为成骨供能并调控钙磷代谢,而功能障碍线粒体释放过量ROS与mtDNA碎片,激活炎症小体,进一步加剧衰老。线粒体移植已在多器官损伤中显效,但SOP患者自身BMSCs线粒体已受损,不宜作供体。骨髓中丰富的S-BMDMs若能恢复线粒体功能,不仅可逆转自身衰老,还可能通过隧道纳米管等途径将健康线粒体原位递送给BMSCs,实现“免疫-干细胞”双向能量补给。然而,S-BMDMs同样存在ROS蓄积、自噬流阻断及线粒体损伤,如何先行恢复其线粒体稳态成为关键。自噬可清除受损线粒体并重建能量代谢,但其活性随龄下降。
铈纳米颗粒(Ce NPs)具多重ROS清除酶活性,α-酮戊二酸(α-KG)可提高线粒体呼吸并激活自噬。构建α-KG-Ce纳米复合体系,有望原位重塑S-BMDMs线粒体健康,进而驱动其向S-BMSCs线粒体捐赠,为衰老骨髓微环境带来能量与信号双重“青春化”,开辟SOP精准干预新途径。

针对上述问题,四川大学吴尧构建了α-酮戊二酸修饰铈金属有机框架纳米系统(CNS)通过双重机制实现衰老性骨质疏松的逆转:一方面,CNS激活自噬-SIRT1-PGC-1α轴,重建衰老骨髓巨噬细胞(S-BMDMs)的氧化还原稳态并促进线粒体新生,使其转化为抗炎M2表型;另一方面,功能恢复的S-BMDMs作为"线粒体充电站",通过细胞间转移将健康线粒体递送给衰老骨髓间充质干细胞(S-BMSCs),恢复其成骨分化能力并抑制脂肪分化。这种“先重塑免疫细胞线粒体,再拯救干细胞功能”的序贯策略,显著改善骨微环境并促进体内骨再生,为衰老相关骨缺损治疗提供了创新性纳米医学方案。该文章于2025年8月5日以《Autophagic-active nanosystem for senile bone regeneration by in-situ mitochondrial biogenesis and intercellular transfer》为题发表于《Bioactive Materials》(DOI:10.1016/j.bioactmat.2025.07.034)。
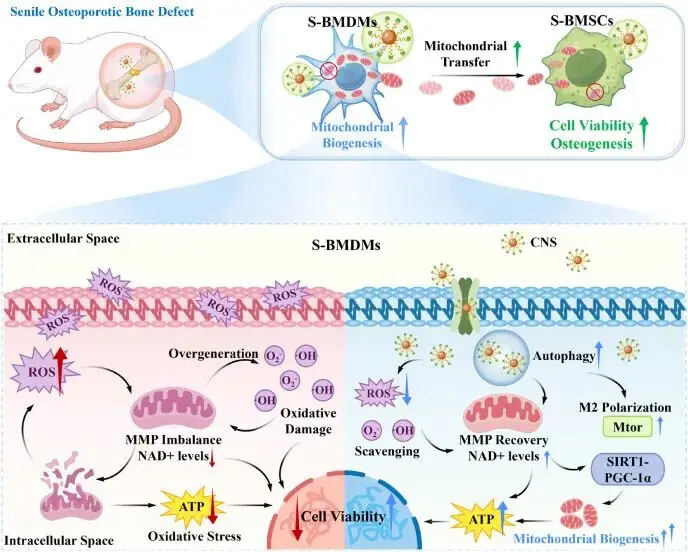
Scheme 1. S-BMDMs胞内改变及CNS保护作用的示意图
(1)CNS的制备与表征
图1A所示合成路线以三嵌段共聚物F127/P123为模板,先制备出~150 nm、介孔结构清晰的八面体CeMOF,再依次接枝PEI与α-KG,得到终产物CNS。SEM/TEM(图1B–C)显示CeMOF与CNS均呈规则八面体、单分散,粒径约150 nm;氮气吸附-脱附等温线(图1D)表明介孔孔道结构在修饰后依然保留,比表面积及孔径分布无显著差异。FTIR在1680 cm-1处出现α-KG酰胺键羰基特征峰(图1E),TGA显示CNS有机组分失重明显高于CeMOF及PEI-CeMOF(图1F)。抗氧化功能评价显示,CNS清除·DPPH的效率较CeMOF提升约1.4倍(图1G–H),·O2-(图1I–J)与H2O2(图1K–L)清除率亦显著优于CeMOF。
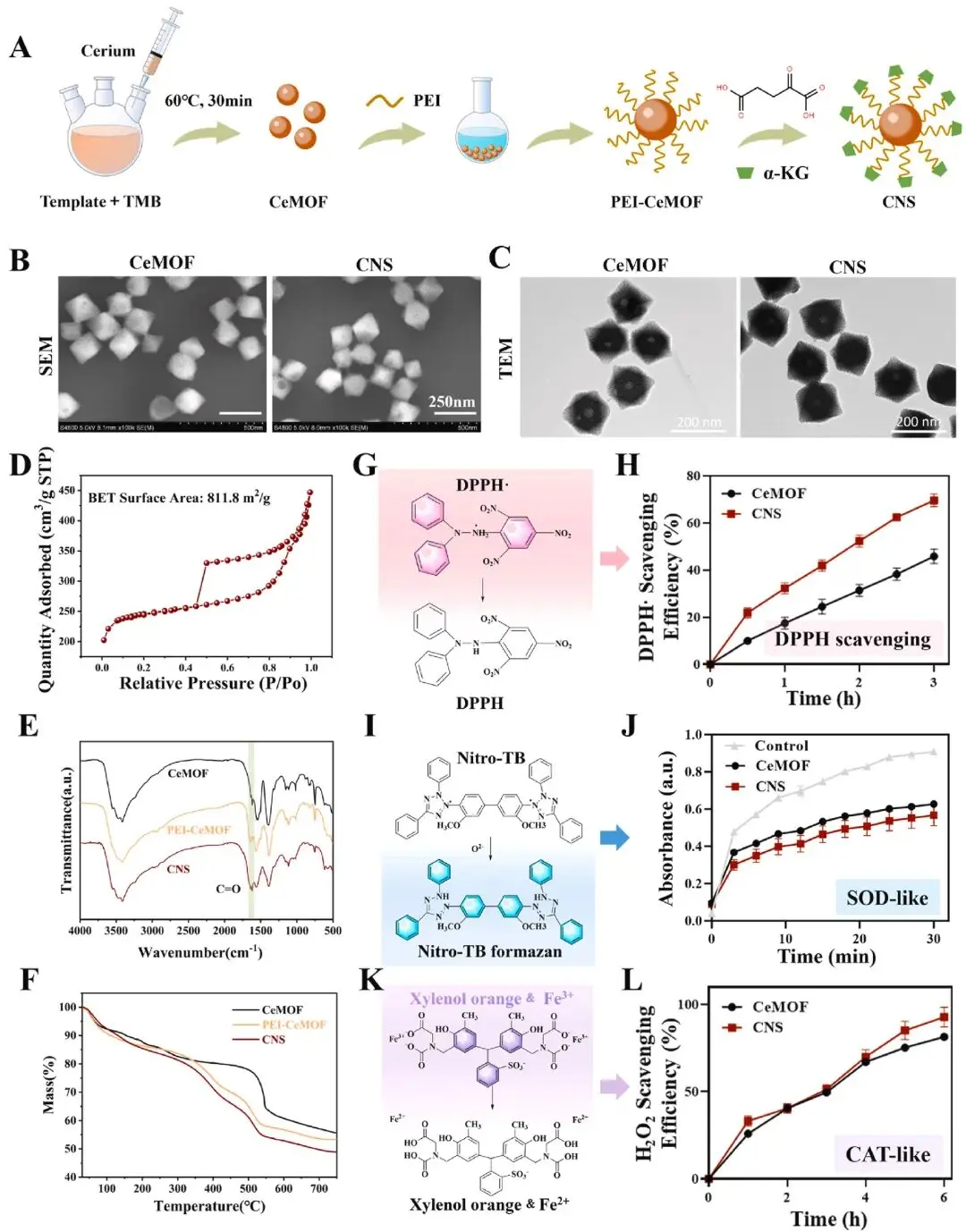
图1. CNS的合成与表征。(A) CNS制备流程示意图;(B) CeMOF与CNS的SEM图像;(C) 显示CeMOF与CNS介孔结构的TEM图像;(D) CNS的N2吸附-脱附等温线;(E) CeMOF、PEI-CeMOF与CNS的FTIR光谱;(F) CeMOF、PEI-CeMOF与CNS的TGA曲线。(G, H) CeMOF与CNS的总ROS清除活性;(I, J) CeMOF与CNS的类SOD活性;(K, L) CeMOF与CNS的类CAT活性
(2)CNS通过激活自噬清除S-BMDMs胞内ROS并恢复细胞活力
MitoSOX荧光成像与DCFH-DA流式检测共同表明,CNS处理组线粒体ROS和总ROS分别被清除至≈98 %和>97 %,效果明显优于CeMOF与α-KG(图2A–B)。CCK-8增殖试验和β-半乳糖苷酶衰老染色显示,CNS使细胞活力恢复至接近正常水平并显著降低衰老阳性率(图2C–D);qRT-PCR进一步证实其下调衰老相关基因P16、P21及SASP因子MMP9、TNF-α的表达,降幅优于CeMOF和α-KG(图2E)。在自噬方面,CNS显著提高LC3B/3A比值及Atg5、Beclin1表达,同时降低P62水平,免疫荧光显示Beclin1蛋白荧光强度最高(图2F–H)。qRT-PCR与免疫荧光显示抗炎基因IL-1RA、IL-10上调,促炎基因iNOS、IL-6下调,CD206荧光显著增强(图2I–K),证实CNS依赖自噬激活逆转S-BMDMs衰老并促其向抗炎表型转换(图2L)。
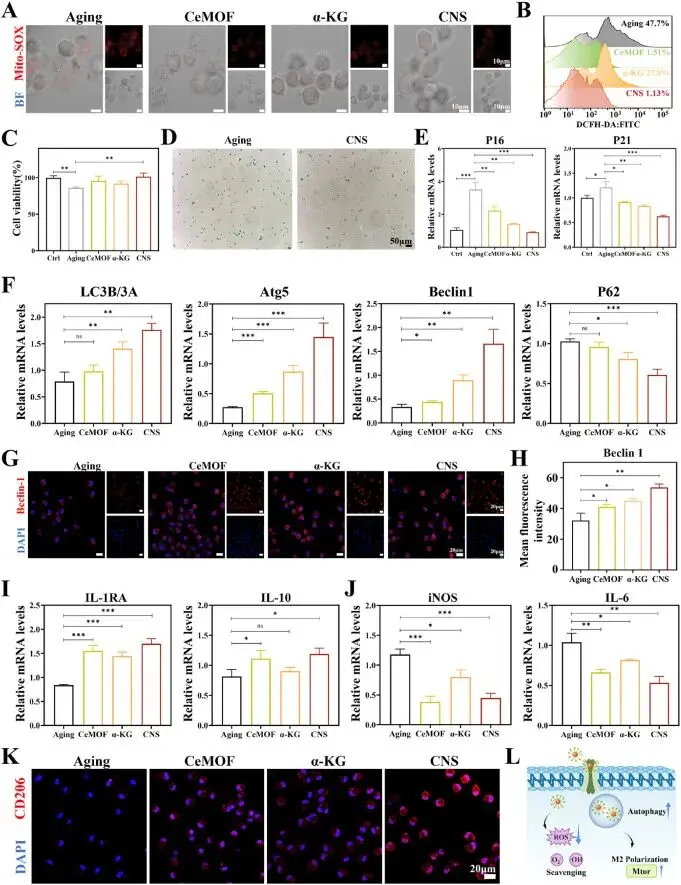
图2. CNS通过激活自噬增强S-BMDMs活性并调控其抗炎表型转换。(A) MitoSOX(红色)检测CeMOF、α-KG及CNS处理后S-BMDMs的mtROS水平;(B) 流式细胞术测定不同样品处理后S-BMDMs胞内ROS含量;(C) CCK-8法检测衰老细胞在各处理组中的活性;(D) β-Gal染色显示衰老与CNS处理S-BMDMs的衰老程度;(E) qRT-PCR检测衰老标志物P16与P21的表达;(F) qRT-PCR检测自噬相关基因LC3B/3A、Atg5、Beclin1及P62的表达;(G) 免疫荧光图像显示各组自噬标志物Beclin1的表达;(H) Beclin1荧光强度的定量分析;(I) qRT-PCR检测抗炎标志物IL-1RA与IL-10的表达;(J) qRT-PCR检测促炎标志物iNOS与IL-6的表达;(K) 免疫荧光图像显示各组抗炎标志物CD206的表达;(L) CNS增强S-BMDMs活性并调控其极化表型的示意图
(3)CNS通过自噬激活改善S-BMDM中的线粒体状态
TEM观察显示,CNS处理组细胞内可见明显自噬体结构(图3A黄色标记),且线粒体形态完整,嵴结构清晰,基质致密;相较之下,衰老组线粒体肿胀、嵴断裂或消失。Mitotracker荧光染色进一步证实,CNS可重建连续的管状线粒体网络,逆转衰老组中因过度分裂导致的点状或短棒状碎片化现象(图3B)。JC-1探针检测线粒体膜电位(ΔΨm)结果显示,CNS组红/绿荧光比值显著高于衰老组,亦优于CeMOF与α-KG组,表明其更有效地恢复线粒体功能(图3C)。ATP生成实验表明,CNS处理使细胞内ATP水平明显升高,而加入自噬抑制剂3-MA后,ATP产量显著下降(图3D–G)。综上,CNS通过增强自噬活性,修复线粒体超微结构,恢复其能量合成能力,并协同促进M2型极化。
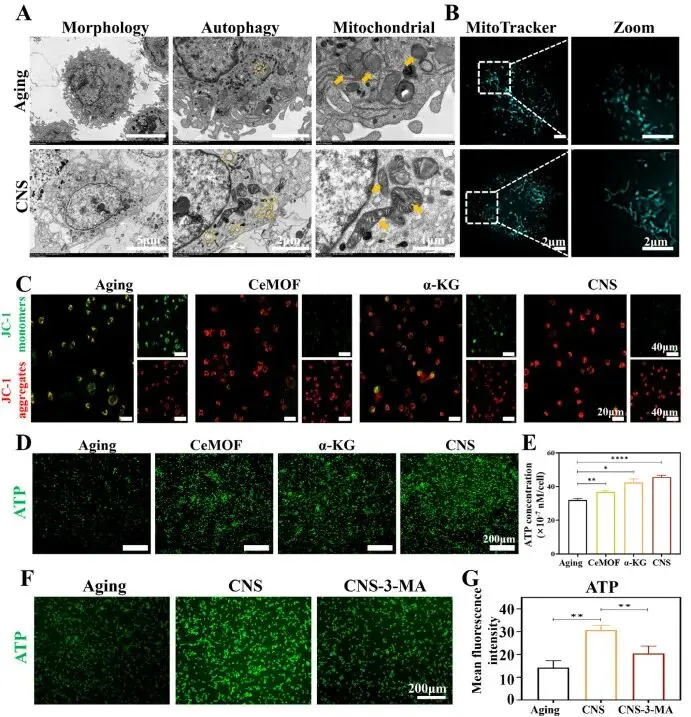
图3. CNS通过激活自噬清除ROS并恢复线粒体稳态。(A) TEM观察CNS处理前后S-BMDMs自噬体(黄圈)与线粒体(黄箭头);(B) CLSM观察CNS处理前后S-BMDMs线粒体形态;(C) JC-1检测不同样品处理后线粒体膜电位的荧光图像;(D) 不同样品处理后ATP荧光染色图像;(E) 不同样品处理后ATP定量检测;(F) 加入3-MA后ATP荧光染色图像;(G) 加入3-MA后ATP荧光相对密度定量分析
(4)CNS通过线粒体转移促进S-BMDM和S-BMSC之间的细胞间串扰
线粒体转移实验采用MitoTracker Deep Red标记S-BMDMs、MitoTracker Green标记S-BMSCs,共培养24小时后共聚焦成像显示,CNS预处理的S-BMDMs(CNS-S-BMDMs)向靶细胞转移的红色线粒体荧光面积和强度均显著高于未处理衰老组,定量共定位分析证实其转移效率提升约1.8倍(图4A–B)。跨孔(0.4 μm)体系显示转移效率下降60 %以上,且Cytochalasin D阻断隧道纳米管(TNT)形成后转移量显著降低,直接捕获到TNT内红色线粒体移动的连续图像,表明接触依赖的TNT是主要转移途径(图4C–E)。在体验证中,将标记好的S-BMDMs经尾静脉注入老龄大鼠,流式检测CD90⁺/CD44⁺ S-BMSCs内的红色荧光信号显示,CNS-S-BMDMs组的线粒体转移效率较衰老组提高约5倍(图4F)。分化功能实验显示,来源于CNS-S-BMDMs的M2型线粒体显著增强S-BMSCs的ALP活性、茜素红矿化结节面积,并抑制油红O脂滴形成;而LPS刺激的BMDMs条件培养基环境则削弱上述成骨优势,提示线粒体转移的促成骨效应依赖于抗炎微环境(图4G–H)。
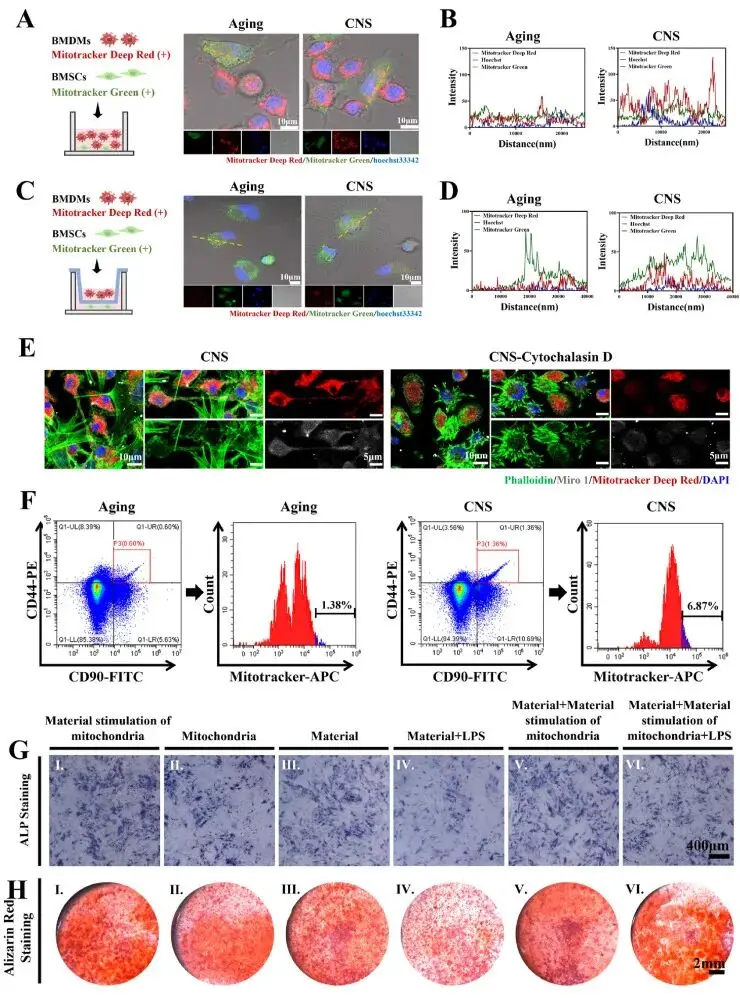
图4. CNS促进骨微环境中S-BMDMs向S-BMSCs的线粒体转移。(A) 共聚焦图像:MitoTracker Green标记S-BMSCs(绿)、MitoTracker Deep Red标记S-BMDMs(红)、Hoechst 33342染核(蓝),24 h共培养±CNS;(B) 直接共培养后随机区三色荧光共定位统计;(C) TW系统共培养24 h共聚焦图像;(D) TW系统共培养后随机区三色荧光共定位统计;(E) 免疫荧光:Miro1(灰)与Deep Red-线粒体(红)在TNT中共定位,鬼笔环肽标记肌动蛋白(绿);(F) 流式定量CNS-S-BMDMs向S-BMSCs的线粒体转移效率;(G–H) ALP与ARS染色监测不同条件下S-BMSCs成骨分化:Ⅰ. CNS-S-BMDMs来源线粒体;Ⅱ. 普通BMDMs来源线粒体;Ⅲ. 单纯CNS;Ⅳ. LPS条件培养基+CNS;Ⅴ. CNS+CNS-S-BMDMs线粒体;Ⅵ. LPS条件培养基+CNS+CNS-S-BMDMs线粒体
(5)CNS激活自噬以调节 S-BMDM 的抗炎表型开关并促进线粒体生物发生
转录组结果显示,CNS组比衰老组多267个上调基因,其中48个集中富集于自噬、线粒体自噬、溶酶体等8条KEGG通路;qPCR验证负调控基因Mtor、Bcl2显著下调,而正调控基因Atg3、Atg5、Atg10、Atg12、Ambra1、Vps34、Bnip3、Ddit3均显著上调,覆盖自噬启动、膜延伸、货物识别及自噬体形成全过程(图5A–E)。免疫-自噬关联分析显示M1型基因与自噬基因呈强负相关,M2型基因与自噬基因呈强正相关,提示自噬是表型转换的核心调控节点(图5F)。差异基因同时富集于氧化磷酸化、谷胱甘肽代谢和NAD+代谢;STRING构建的PPI网络进一步将自噬与线粒体电子传递、NADH-泛醌氧化、质子跨膜信号耦合,预测自噬可增强呼吸链效率并保护NAD+水平(图5G)。CNS处理后S-BMDMs内SIRT1、PGC-1α、TFAM、Nrf2 mRNA水平显著高于衰老组;加入SIRT1抑制剂EX527后,上述基因表达上调被显著抑制(图5H),直接证明CNS通过激活SIRT1-PGC-1α-NRF2-TFAM轴促进线粒体生物发生。
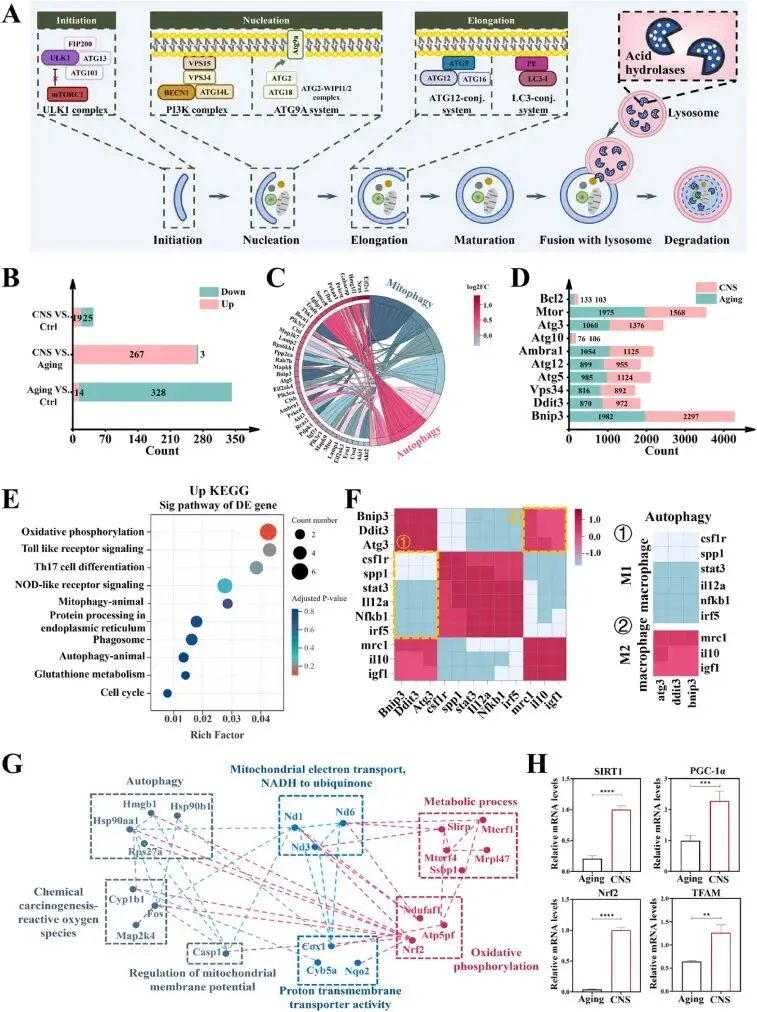
图5. 转录组测序分析。(A) 自噬通路示意图;(B) 对照、衰老与CNS三组间差异基因数量;(C) 48个差异自噬相关基因KEGG富集的环形图;(D) 衰老组与CNS组显著差异基因表达热图;(E) 上调差异基因KEGG通路富集结果;(F) Pearson相关性分析,颜色强度代表相关系数−1至1(绿到红);(G) 差异基因互作网络图;(H) qRT-PCR验证SIRT1、PGC-1α、Nrf2与TFAM基因表达
(6)SPEEK-CNS支架调节SOP中的骨微环境
磺化聚醚醚酮(SPEEK)通过浓硫酸处理在表面生成多孔微结构,并利用聚多巴胺(PDA)中间层实现10 μg/mL CNS的牢固接枝,获得SPEEK-CNS支架。在每周一次多柔比星(Dox)腹腔注射、持续4周建立的加速衰老骨质疏松大鼠模型(图6A),随后于股骨远端制造直径2 mm贯穿缺损并植入支架,分三组:SPEEK(阴性)、SPEEK-牛磺酸(阳性)与SPEEK-CNS。术后2周和4周取材,免疫荧光及定量分析显示:SPEEK-CNS组CD86⁺促炎信号最低,CD206⁺抗炎信号最高,表明局部免疫微环境向M2型极化(图6B–D)。衰老标志物P21在SPEEK-CNS组表达量在各时间点均显著低于其余两组,下降幅度随时间延长而扩大(图6E–G)。结果证实,SPEEK-CNS支架可在衰老骨缺损区持续释放CNS,通过抑制炎症和细胞衰老,创造有利于骨再生的免疫微环境。
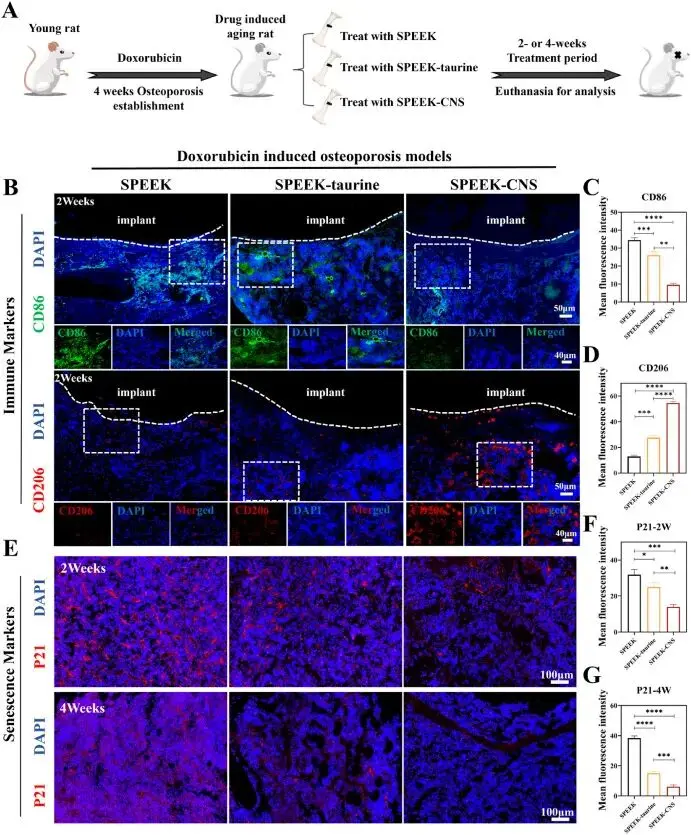
图6. 体内评估CNS对SOP骨微环境的调控能力。(A) 动物实验流程示意图;(B) SPEEK、SPEEK-牛磺酸与SPEEK-CNS支架中抗炎标志物CD206及促炎标志物CD86的免疫荧光图像;(C) CD86荧光相对密度定量分析;(D) CD206荧光相对密度定量分析;(E) 术后2周与4周时,SPEEK、SPEEK-牛磺酸与SPEEK-CNS支架中衰老标志物P21的免疫荧光图像;(F) 术后2周P21荧光相对密度定量分析;(G) 术后4周P21荧光相对密度定量分析
(7)SPEEK-CNS支架的体内成骨整合
免疫荧光显示,SPEEK-CNS组新生骨区域内PGC-1α(绿色)与Miro1(红色)双阳性细胞数量显著多于其余两组,表明线粒体生物发生及转移活性最高(图7A)。术后4周micro-CT三维重建可见该组植入体周围被连续、致密的新骨包裹,骨体积分数(BV/TV)和骨小梁连接密度(Conn.D)均显著升高,骨小梁分离度(Tb.Sp)明显降低,差异具有统计学意义(图7B–E)。H&E组织学切片进一步证实,SPEEK-CNS支架周围新骨形成均匀且连续,成骨质量优于SPEEK和SPEEK-牛磺酸对照(图7F)。
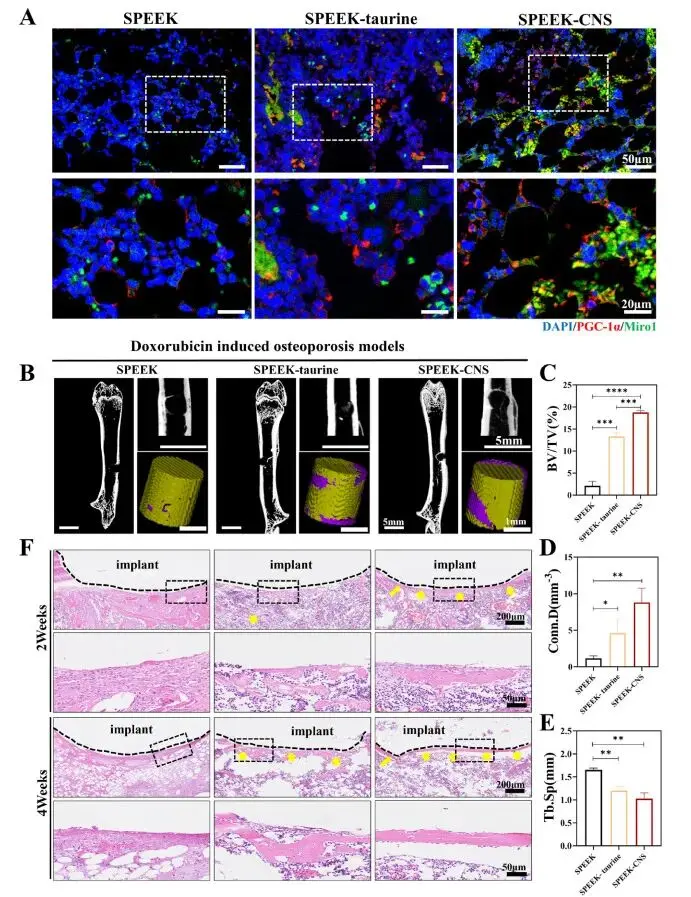
图7. CNS促进SOP骨形成评价。(A) 股骨样本Miro1与PGC-1α双标免疫荧光图;(B) 术后4周SPEEK、SPEEK-牛磺酸及SPEEK-CNS支架新生骨3D micro-CT重建图;(C) micro-CT参数BV/TV定量;(D) micro-CT参数Conn.D定量;(E) micro-CT参数Tb.Sp定量;(F) HE染色观察术后2周与4周三组支架周围新生骨组织
总之,该团队提出“原位提升线粒体新生-转移”策略治疗衰老性骨质疏松:CNS通过激活自噬降低ROS、协同α-KG增强TCA循环恢复NAD+,进而放大SIRT1-PGC-1α信号,驱动S-BMDMs线粒体生物发生;功能重塑的S-BMDMs经隧道纳米管向S-BMSCs高效转移健康线粒体,逆转靶细胞衰老、增强成骨分化并抑制脂肪分化。该工作揭示了生物材料调控骨髓微环境线粒体稳态与成骨免疫平衡的新机制,为年龄相关骨质疏松提供了可转化的“能量充电-细胞间递送”治疗范式。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

