
帕金森病(PD)是第二大常见的神经退行性疾病,以多巴胺能神经元丢失和运动功能障碍为核心特征。现有临床手段(如左旋多巴化疗和手术)仅能短暂缓解症状,无法改变疾病进程;新兴的基因/免疫疗法虽试图降低α-突触核蛋白(α-syn)水平,却因疗效有限且对α-syn生理功能认知不足而伴随长期安全隐患。
近年来,借助“自由基衰老学说”兴起的纳米酶虽具备低成本、高稳定、易修饰等优势,可清除活性氧氮(RONS)并对抗氧化应激(OS)与神经炎症,但传统无机纳米酶(CuO、CeO₂、Pt等)制备复杂、不可降解、靶向差,且需二次功能化,生物风险高。PD病因仍不明确,OS与神经炎症被认为是互为因果、加速病程的关键机制:过量RONS 接杀伤神经元,受损神经元释放的氧化分子又激活小胶质细胞,后者分泌促炎因子并释放更多RONS,形成“氧化-炎症”恶性循环。因此,亟需一种可同步清除RONS、重塑小胶质细胞极化、安全可降解且能穿透血脑屏障(BBB)的新型治疗平台。

针对上述问题,河南大学邹艳、师冰洋教授团队提出以金属-多酚配位聚合物纳米酶为核心的“抗氧化-抗炎”一体化策略。选用FDA批准的天然多酚单宁酸(TA)与 Fe³⁺配位形成疏水Fe-TA复合物,并以牛血清白蛋白(BSA)为模板诱导其自组装成粒径约15 nm的BSA/Fe-TA纳米颗粒(BSA/Fe-TA NPs)。BSA 赋予颗粒优异生物相容性、可降解性及对白蛋白受体(SPARC 等)的主动识别能力,利用PD大脑中BBB Albumin 转运通路增强的“病理窗口”实现高效入脑并富集于多巴胺能神经元与小胶质细胞。原子级分散的Fe-N/O/S配位中心赋予该纳米酶6种天然酶样活性(SOD、POD、CAT、GPx、APx、TPx),协同TA自身抗氧化能力,可广谱清除细胞内/外 RONS,阻断氧化损伤;同时促进小胶质细胞向抗炎M2表型极化,抑制促炎因子释放,打破“OS-炎症”恶性循环。MPTP小鼠模型证实,静脉给予BSA/Fe-TA NPs 可显著改善运动功能、恢复酪氨酸羟化酶水平、减轻氧化损伤与神经炎症;且颗粒可被临床铁螯合剂去铁胺(DFO)快速降解,进一步提升体内安全性。该工作为 PD 提供了一种制备简单、可降解、高效靶向且机制明确的金属-多酚纳米酶治疗新范式(图1)。相关研究在2025年9月11日以“Tannic Acid−Iron Complex-Based Nanozyme Ameliorates Parkinson’s Disease via Relieving Oxidative Stressand Neuroinflammation”为题发表于《ACS Nano》(DOI: 10.1021/acsnano.5c07601)上。
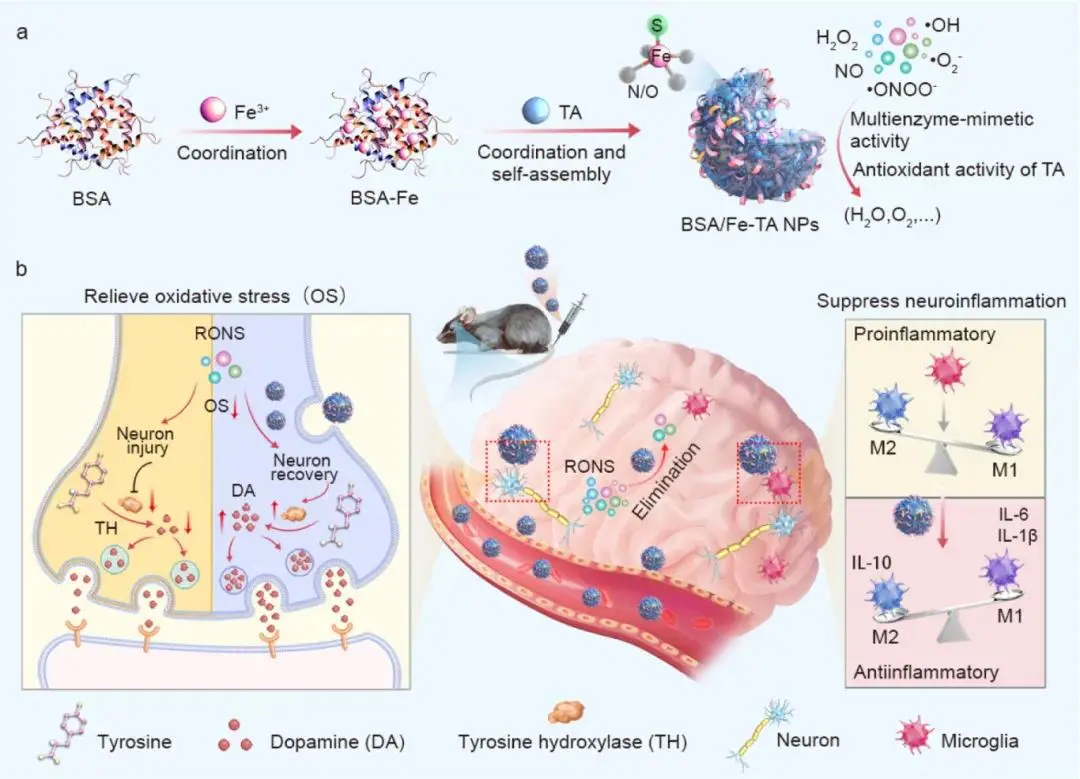
图1 a) BSA/Fe-TA NPs形成示意图。b) BSA/Fe-TA NPs穿过血脑屏障,在神经元和小胶质细胞中积累,以减少细胞内外过量的RONS,从而缓解OS,并另外调节小胶质细胞极化以抑制神经炎症,从而有效治疗PD
(1)BSA/Fe-TA NPs的合成与表征
图2a的TEM首先给出BSA/Fe-TA的整体形貌:15 nm、单分散、无晶格条纹,SAED仅见弥散晕圈,奠定“无定形球形纳米颗粒”的物理基础。同一颗粒的高分辨Fe 2p XPS(图2b)进一步揭示其化学本态——主峰711.3/725.5 eV对应Fe 2p₃/₂与2p₁/₂,去卷积后出现709.7/723.4 eV(Fe²⁺)与711.2/713.7/727.2/730.7 eV(Fe³⁺)两套特征峰,定量说明铁中心以Fe²⁺/Fe³⁺混合价形式存在;该结果与图1c的Fe K-edge XANES相互印证-吸收边位置介于Fe箔(Fe⁰)与Fe₂O₃(Fe³⁺)之间,边缘能量位移0.8 eV,确证价态非整数。为回答“铁是否以原子级分散”这一结构问题,图2d的FT-EXAFS在R空间给出决定性证据:仅1.5 Å(Fe–N/O)与1.9 Å(Fe–S)两个配位壳层,完全缺失金属铁2.13 Å的Fe–Fe键信号;图2e–i的小波变换(WT-EXAFS)在k-R三维空间同样只出现Fe–N/O与Fe–S的强度极大值,未检测到任何Fe–Fe散射路径,层层排除铁团簇或纳米晶存在的可能。由此,从形貌(无定形球)→价态(Fe²⁺/Fe³⁺混合)→近邻结构(Fe–N/O、Fe–S配位)→原子级分散(无Fe–Fe)形成完整证据链,确立BSA/Fe-TA纳米颗粒中单原子铁中心的核心结论。
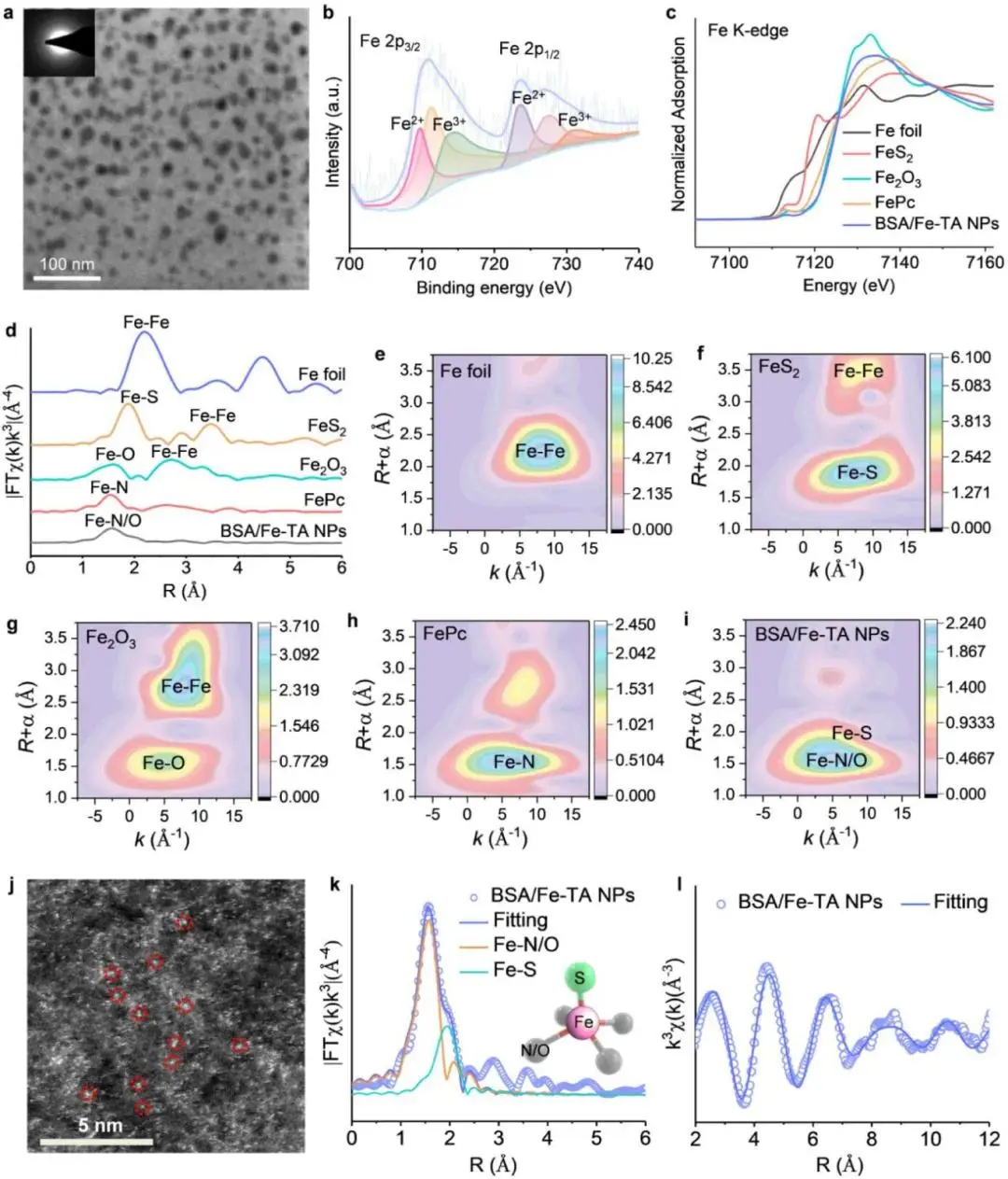
图 2. BSA/Fe-TA NPs的结构和成分表征。a) BSA/Fe-TA NPs的TEM 图像;插图:选区电子衍射(SAED)图案。b) Fe 2p的高分辨率XPS光谱。c) XANES 光谱和 d) Fe箔、FeS 2、Fe 2 O 3 、FePc 和BSA/Fe-TA NPs的Fe K边的相应k³加权傅里叶变换光谱。e) Fe箔、f) FeS 2、g) Fe2O3、h) FePc和 i) BSA/Fe-TA NPs的k边的小波变换 (WT )。j) BSA/Fe-TA NPs的放大HAADF-STEM图像显示分散的单个Fe原子呈亮点。k) BSA/Fe-TA NPs在R空间的相应EXAFS拟合曲线以及纳米粒子中铁中心的可能立体构型的说明。l) BSA/Fe-TA NPs在k空间的 EXAFS拟合曲线
(2)BSA/Fe-TA NPs的多酶样催化活性
研究人员首先利用DCFH-DA探针比较发现,BSA/Fe-TA NPs的荧光强度显著低于TA及BSA-TA,表明其总ROS清除能力更强(图3a);随后通过ESR检测,研究人员观察到DMPO/•O₂⁻与DMPO/•OH信号随颗粒加入而递减,直接证实自由基清除效果(图3b,c)。进一步使用SOD试剂盒测定显示,•O₂⁻清除率随Fe³⁺浓度0–40 μg/mL线性上升(图3d)。在CAT测试中,研究人员记录到溶解O₂产量在0–20 μg/mL范围内呈剂量依赖,0.8 M H₂O₂条件下O₂达15 mg/L(图3e–g)。采用TMB-H₂O₂体系检测发现,652 nm吸光度随颗粒浓度增加而升高,Michaelis-Menten曲线及Lineweaver-Burk图给出POD动力学参数(图3h–j)。通过监测NADPH 340 nm下降曲线,研究人员发现GPx活性随颗粒浓度升高而增强(图3k)。在NO-PTIO ESR实验中,信号被颗粒削弱(图3l);ONOO⁻诱导的焦棓酚红漂白被抑制,吸光度偏移减小(图3m)。对比实验显示,BSA/Fe-TA NPs的SOD、POD、GPx、TPx活性均高于TA、BSA-Fe、BSA-TA、Fe-TA对照。
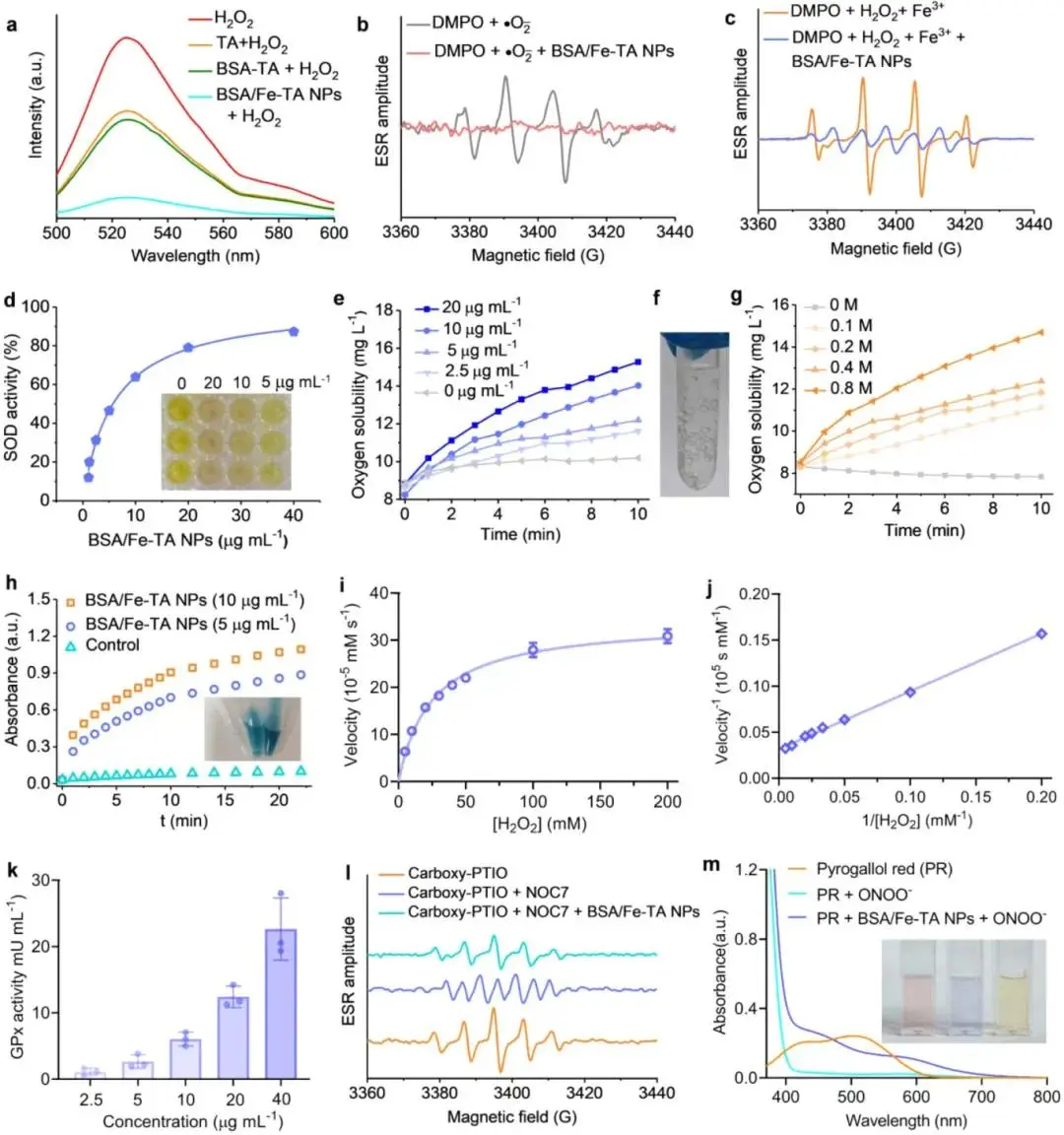
图3.BSA/Fe-TA NPs清除RONS并介导多种酶模拟活性。a) DCF与H2O2、TA、BSA-TA或BSA/Fe-TA NPs溶液混合的荧光光谱。b)在存在或不存在BSA/Fe-TA NPs的情况下,通过使用自旋捕获剂DMPO捕获•O2–获得的DMPO–•O2–的ESR光谱。c)在存在或不存在 BSA/Fe-TA NPs 的情况下, DMPO– •OH的ESR光谱,其中•OH是通过Fe2+和 H2O2之间的Fenton反应生成的。d)不同浓度BSA/Fe-TA NPs的SOD样活性。e)不同浓度BSA/Fe-TA NPs下释放的溶解氧。f)存在H2O2的情况下氧气生成的代表性数码照片。 g) BSA/Fe-TA NPs存在下不同H2O2浓度下的溶解氧生成。h)不同浓度下BSA/Fe-TA NPs的POD样活性。相应的Michaelis-Menten图i)和Lineweaver-Burk图j)在不同浓度的H2O2 (5、10、20、30、40、50、100和200 mM)下,BSA/Fe-TA NPs。k) 不同浓度下BSA/Fe-TA NPs的GPx样活性。l) ESR光谱评估BSA/Fe-TA NPs的NO清除能力。m) 使用指示剂焦性没食子酚红对BSA/Fe-TA NPs的ONOO-清除能力进行UV-vis光谱评估
(3)单原子纳米酶BSA/Fe-TA NPs实现神经元-小胶质双重保护:阻断氧化损伤与神经炎症的机制验证
研究人员系统评估了BSA/Fe-TA NPs对MPTP诱导的PD体外模型的神经保护作用与机制。细胞摄取实验表明,颗粒可被bEnd.3、SH-SY5Y、N2A及BV2细胞高效内化且在80 μg/mL仍无细胞毒性。2 mM MPTP显著降低SH-SY5Y细胞存活率,共孵育BSA/Fe-TA NPs后,细胞活力随颗粒浓度升高而恢复,IC₅₀区间左移,提示剂量依赖性神经保护;在H₂O₂诱导的氧化损伤模型中亦观察到相同趋势。为阐明机制,研究人员采用CLSM与流式细胞术同步检测胞内ROS,结果显示MPTP升高的ROS被BSA/Fe-TA NPs完全拉回正常对照水平(图4a)。线粒体膜电位JC-1检测发现,MPTP导致的红色/绿色荧光比值下降被颗粒显著逆转,表明线粒体功能得到修复(图4b)。Western blot进一步显示,MPTP上调的cleaved caspase-3、cleaved caspase-9及PARP剪切片段在BSA/Fe-TA NPs处理后均被抑制至基线水平(图4c),Annexin V/PI流式定量证实凋亡比例由MPTP组的~35%降至~8%(图4d)。细胞裂解液多酶活性测定表明,颗粒处理后SOD、CAT、POD、GPx活性均提升2–4倍,同时胞内NO荧光探针信号下降60%,ONOO⁻诱导的焦棓酚红漂白被阻断,吸光度损失<10%(图4e,f)。与BSA-TA复合物对比,BSA/Fe-TA NPs在相同蛋白浓度下将MPTP损伤细胞的存活率再提高~20%,验证铁中心对神经保护的增益作用。
在BV2小胶质细胞炎症模型中,研究人员采用流式细胞术检测表面标志:LPS或H₂O₂刺激使CD86⁺ M1型比例由8%分别升至68%与71%,共孵育BSA/Fe-TA NPs后CD86⁺比例回降至22%与25%,同时CD206⁺ M2型由12%提升至48%与52%(图4g–j)。ELISA结果显示,H₂O₂升高的促炎因子IL-1β(~420 pg/mL)与IL-6(~380 pg/mL)被颗粒显著抑制至接近基线,而抗炎因子IL-10由~40 pg/mL升至~240 pg/mL(图4l–n)。综合提示,BSA/Fe-TA NPs通过高效清除RONS,阻断NF-κB、MAPK及NLRP3炎症小体激活,抑制M1极化并促进M2转换,从而协同减轻神经元氧化损伤与神经炎症反应。

图4.BSA/Fe-TA NPs 介导的神经元保护和抗炎活性。(a)SH-SY5Y 细胞经指定处理后,用 DCF 染料检测细胞内 ROS 的 CLSM 图像。(b)通过流式细胞术检测用 MPTP 处理、BSA/Fe-TA NPs(加或不加 MPTP)处理后 SH-SY5Y 细胞中线粒体膜电位的变化。 (c)对SH-SY5Y细胞进行不同处理后的Western印迹分析,检测凋亡相关蛋白caspase-9(C-9)、cleaved caspase-9(CC-9)、cleaved caspase-3(CC-3)和cleaved PARP(C-PARP)的表达。β-actin(Actin)被用作管家蛋白。(d)SH-SY5Y细胞经指定处理后凋亡的诱导。(e)用ONOO –处理后SH-SY5Y细胞的细胞活力。(f)凋亡分析评估BSA/Fe-TA NPs在ONOO –诱导的氧化损伤后的神经元保护作用。采用代表性流式细胞术检测,评估在存在或不存在BSA/Fe-TA NPs的情况下,用LPS(g,i)或H 2 O 2(h,j)处理后,BV2小胶质细胞极化为促炎性M1表型或抗炎性M2表型的情况。(k)小胶质细胞极化及其相应的促炎或抗炎反应示意图。ELISA试剂盒测定BV2细胞经上述处理后,促炎性细胞因子IL-6(l)、IL-1β(m)和抗炎性细胞因子IL-10(n)的表达情况
(4)BSA/Fe-TA NPs跨血脑屏障机制解析与PD病灶精准蓄积
研究人员首先利用单层bEnd.3 Transwell模型测定BSA/Fe-TA NPs的跨膜效率,24 h内透过率达41%,并在下室SH-SY5Y与BV2细胞中检测到颗粒荧光,其强度显著高于游离BSA组(图5b–d)。在7 mg mL⁻¹游离BSA竞争条件下,透过率下降约30%,提示白蛋白介导的转运路径参与。随后,研究人员构建三细胞人源BBB模型再次验证颗粒的高效穿透能力。为明确内吞机制,研究人员用nystatin/genistein预处理bEnd.3、SH-SY5Y与BV2细胞,Cy5标记颗粒的摄取量分别下降约45%、50%与55%,证实小窝蛋白介导的内吞作用(图5e–h)。颗粒的负电性及TA苯环疏水结构促进其与富含胆固醇/鞘脂的小窝结合,从而推动跨膜转运(图5n)。
在体实验阶段,研究人员通过7TMR成像观察到PD小鼠脑内颗粒蓄积明显高于野生型。免疫荧光与Western blot结果显示,脑微血管、神经元、小胶质以及纹状体、黑质均表达白蛋白受体SPARC,为颗粒的受体介导转运提供靶点。药代动力学研究测得颗粒血半衰期为4.59 h,有利于延长BBB作用窗口。DIR标记颗粒的活体荧光在6 h达到峰值并持续至24 h,离体脑荧光与ICP-OES定量结果一致,脑组织蓄积量约为2.3%ID g⁻¹(图5i–k)。脑片荧光成像显示,颗粒主要分布在纹状体与黑质,并与TH⁺多巴胺神经元及IBA-1⁺小胶质细胞共定位,且与SPARC受体共域(图5l,m)。综上,研究人员证实BSA/Fe-TA NPs可通过小窝与SPARC双路径跨越血脑屏障,并有效富集于PD病灶区域的神经元及小胶质细胞。
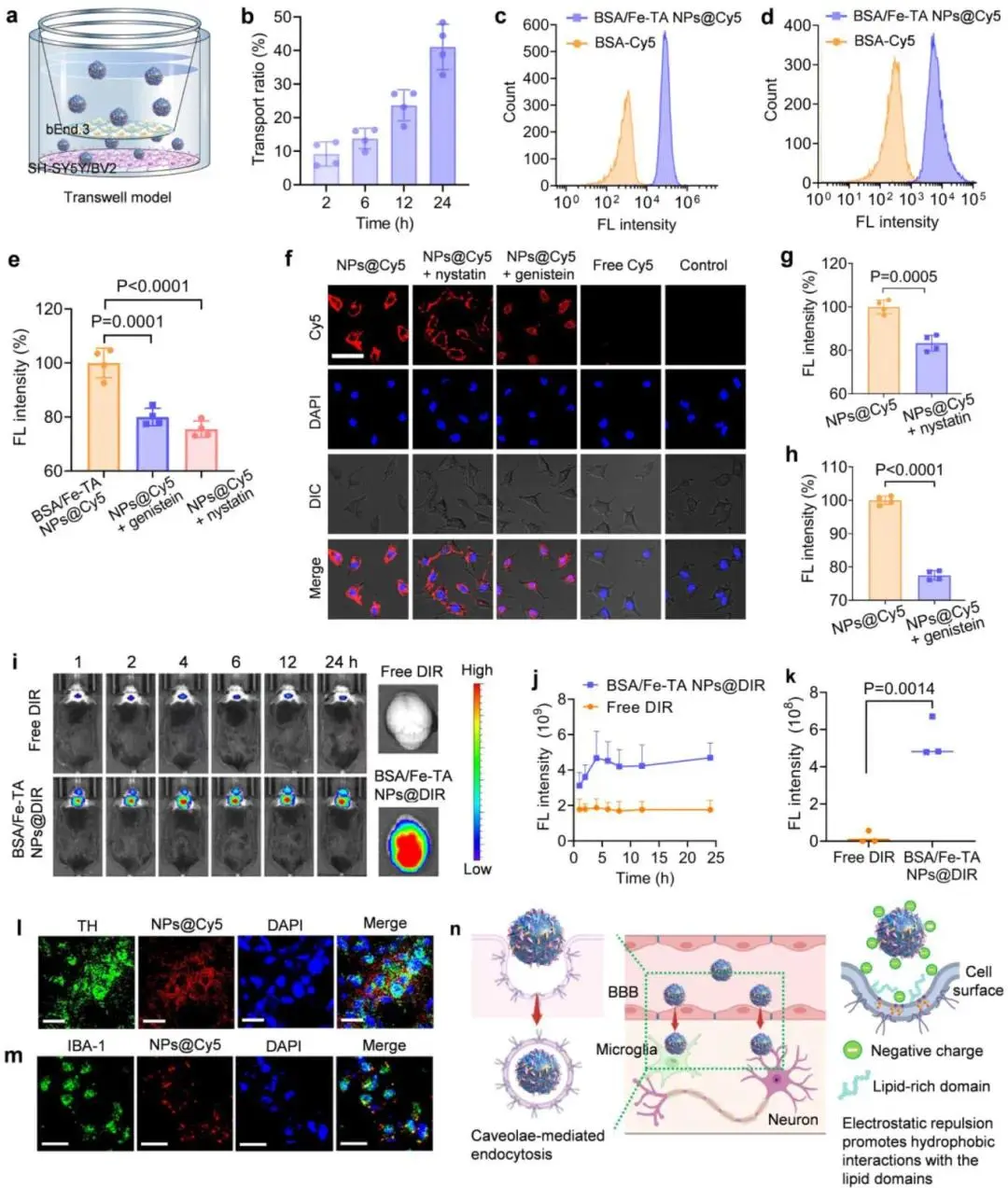
图5.BSA/Fe-TA NPs穿透BBB以及在神经元和小胶质细胞中的蓄积。a)体外BBB transwell模型示意图。b) 不同时间点BSA/Fe-TA NPs在BBB的转运率。流式细胞术评估transwell下室中c) SH-SY5Y神经元细胞和d) BV2小胶质细胞对BSA/Fe-TA NPs的细胞摄取情况。e) 通过流式细胞术评估染料木黄酮和制霉菌素处理前后bEnd.3细胞对Cy5标记的BSA/Fe-TA NPs的细胞摄取情况。f) SH-SY5Y 细胞与 Cy5 标记的 BSA/Fe-TA NPs孵育后,分别加入或不加入细胞膜穴样囊泡介导的内吞抑制剂制霉菌素和染料木黄酮进行 CLSM 图像。通过流式细胞术评估用染料木黄酮 g) 和制霉菌素 h)预处理的 SH-SY5Y 细胞对Cy5 标记的 BSA/Fe-TA NPs的细胞摄取。(i)在静脉注射载 DIR 的 BSA/Fe-TA NPs 或游离 DIR后,在指定时间点拍摄的 PD 小鼠的荧光图像。右图:注射后24小时,PD小鼠脑组织的离体荧光成像。j)体内成像和k)离体脑成像的DIR强度定量分析。注射Cy5标记的BSA/Fe-TA NPs 24小时后,PD小鼠脑切片的CLSM图像,显示了纳米酶在l) 神经元和m) 小胶质细胞中的积累。n) BSA/Fe-TA NPs穿透BBB、神经元和小胶质细胞的示意图
(5)BSA/Fe-TA NPs缓解PD小鼠运动障碍与神经炎症的综合治疗效应
研究人员以MPTP(30 mg kg⁻¹,每日腹腔注射,连续8天)构建亚急性PD模型,并自第1天起每2天静脉注射BSA/Fe-TA NPs(总剂量3次),系统评估其治疗潜力。行为学检测显示:开野实验中,研究人员记录到治疗组小鼠总行程较PBS组增加42%,中心停留时间延长38%;爬杆实验平均耗时由14.3 s缩短至8.1 s;转棒跌落潜伏期由85 s延长至142 s(图6b–d6)。Morris水迷宫第5天,研究人员追踪发现治疗组搜索轨迹集中于目标象限,平台穿越次数提高2.1倍,而游泳速度无差异,证实空间记忆显著恢复(图6e–g6)。免疫组化分析由研究人员独立完成:黑质TH阳性多巴胺纤维密度回升至正常水平的~80%,显著高于PBS组的45%;α-syn荧光强度下降35%(图6h)。与BSA-TA复合物对比,研究人员确认后者对上述行为及TH指标改善幅度不足50%,凸显铁中心的关键作用。机制验证实验由研究人员同步开展:SN区ROS荧光信号较PBS组降低52%,MDA含量下降46%(图6i,j);IBA-1阳性面积由38%降至12%,血清IL-6、IL-1β分别下降约50%与55%,IL-10升高2.2倍(图6k–n)。免疫荧光共定位由研究人员完成,显示CD206⁺ M2型小胶质比例由8%升至31%,且与纳米酶信号高度重叠(图6o,p)。综上,研究人员证实BSA/Fe-TA NPs通过清除RONS、高效穿透BBB并驱动M2极化,显著缓解PD小鼠运动障碍与神经炎症。
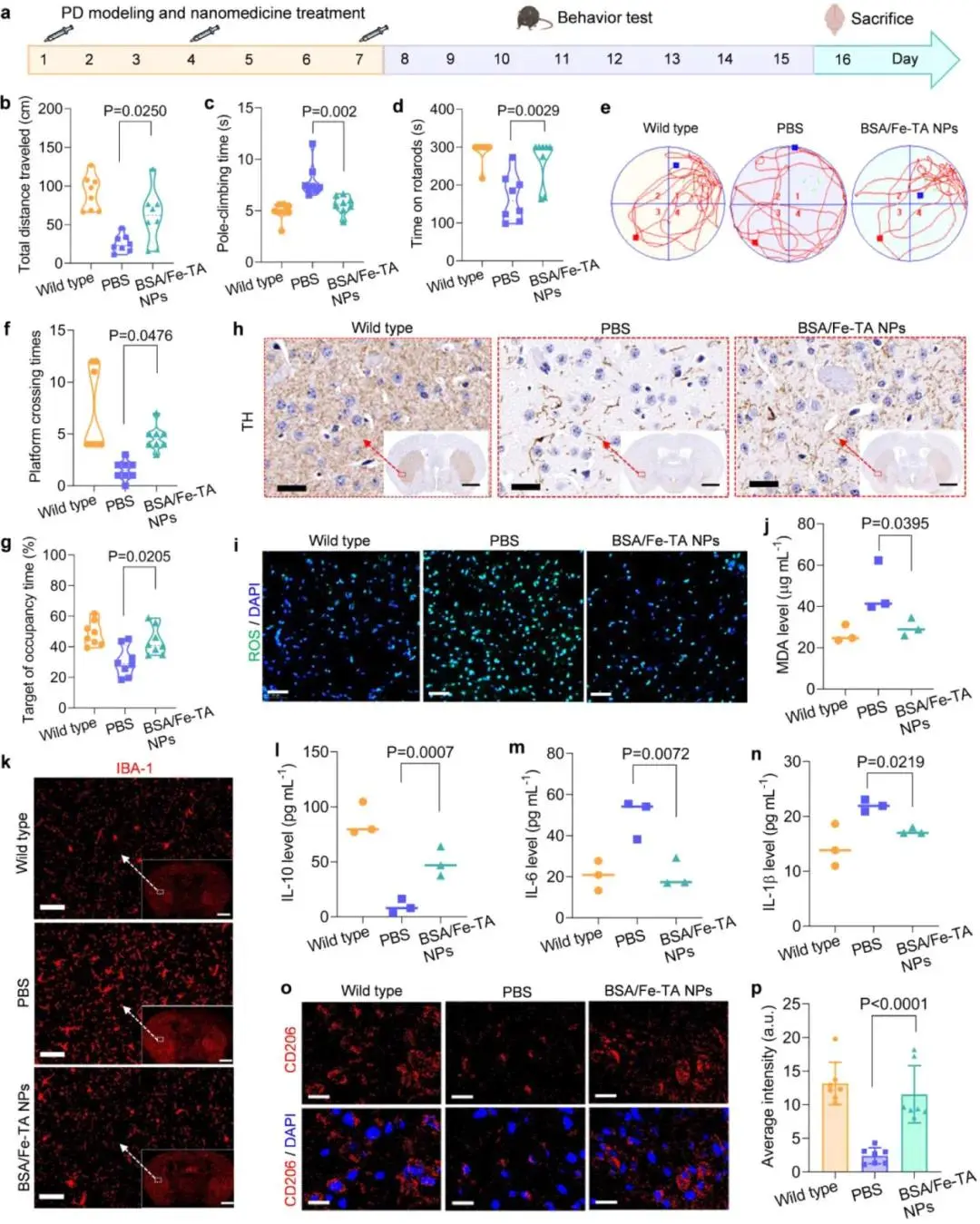
图6.BSA/Fe-TA NPs与MPTP同时注射可有效预防PD进展。(a)BSA/Fe-TA NPs在小鼠模型中预防PD进展的治疗时间线示意图。进行行为测试,包括(b)旷场测试,(c)爬杆测试和(d)转棒测试,以评估BSA/Fe-TA NPs的治疗效果。(e)代表性路径追踪。(f)小鼠在接受纳米酶或PBS对照治疗后在Morris水迷宫测试中穿越平台的时间。(g)小鼠在Morris水迷宫测试中在目标象限(逃生平台的先前位置)所花费的相对时间。(h)免疫组织化学评估小鼠脑中TH的表达(脑切片比例尺:1000μm;放大图像比例尺:50μm)。 (i)使用二氢乙锭(DHE)检测试剂盒对脑切片中的ROS进行荧光标记,检测不同处理后离体脑中的ROS水平(比例尺:50 μm)。(j)接受所示处理后,小鼠离体脑组织中的丙二醛(MDA)水平。(k)免疫荧光测定法评估小鼠脑中IBA-1的表达水平。接受所示处理后,从小鼠体内采集的血清中抗炎细胞因子IL-10(l)和促炎细胞因子IL-6(m)和IL-1β(n)的水平。 (o)M2 表型小胶质细胞的 CLSM 图像,以及(p)接受所示治疗后小鼠脑中 CD206 表达的相应定量荧光强度
总之,研究人员报道了一种基于铁多酚复合物的纳米酶的制备方法,用于帕金森病(PD)治疗。所制备的BSA/Fe-TA纳米颗粒由于其多酶催化活性和TA的抗氧化能力,具有优异的RONS消除能力。全身给药后,BSA/Fe-TA纳米颗粒在BSA的帮助下有效穿过血脑屏障(BBB),并在帕金森病病变部位的神经元和小胶质细胞中蓄积。通过同时缓解脑缺血发作和体内神经炎症,实现有效的帕金森病治疗效果,且无不良反应。更重要的是,BSA/Fe-TA纳米颗粒易于通过简单的制备工艺大规模生产,并可在临床认可的铁螯合剂DFO的帮助下进行分解,从而避免其在RES器官中长期蓄积。鉴于OS和神经炎症是中枢神经系统疾病(包括阿尔茨海默病和缺血性卒中)的共同特征,BSA/Fe-TA NPs具有治疗其他神经退行性疾病的潜力,且此类研究正在进行中。展望临床转化,这些外源性纳米颗粒的有效性及其与生物系统的相互作用有待进一步系统研究。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

