
研究背景:
创伤性脑损伤(TBI)是导致死亡和残疾的重要原因,其病理过程包括原发性机械损伤和继发性神经炎症反应。神经炎症涉及小胶质细胞激活、细胞因子释放及免疫细胞募集,会加剧损伤。然而,目前缺乏有效疗法来减轻中枢神经系统损伤和促进恢复,针对神经炎症的特异性治疗更是空白。因此,开发调节中枢神经系统炎症的新疗法迫在眉睫。

哈佛大学医学院Howard L. Weiner教授团队受粘膜免疫系统启发,研究了鼻内给药抗CD3单克隆抗体(aCD3 mAb)治疗TBI。研究发现,该方法可诱导产生IL-10的调节性T细胞(Treg),这些细胞迁移到大脑与小胶质细胞接触,通过IL-10依赖机制减轻小胶质细胞的慢性炎症并调节其吞噬功能。阻断IL-10受体会消除aCD3 mAb的益处,而将IL-10产生型Treg细胞移植到TBI小鼠中可恢复这些效果,表明鼻内给药aCD3 mAb是治疗TBI的潜在新策略。该文章于2025年02月27日以《Nasal anti-CD3 monoclonal antibody ameliorates traumatic brain injury, enhances microglial phagocytosis and reduces neuroinflammation via IL-10-dependent crosstalk》为题发表于《Nature Neuroscience》(DOI:10.1038/s41593-025-01877-7)。
(1)经鼻 aCD3 mAb 改善 TBI 后的认知和运动结局
研究采用CCI模型评估鼻内给药抗CD3单克隆抗体(aCD3)对TBI的治疗效果。实验分为伤后4 - 6小时立即给药、伤后3天早期给药和伤后14天延迟给药,持续治疗1个月。结果显示,立即给药组在运动功能和协调性、空间记忆方面显著改善,焦虑行为减少;早期给药组运动功能和协调性、空间记忆改善,但焦虑行为未改善;延迟给药组未见改善。在更严重的TBI模型中,雄性、雌性小鼠aCD3治疗均改善运动功能和协调性,部分恢复空间记忆。雄性小鼠严重TBI后焦虑行为减少,而雌性小鼠无焦虑表型,无法评估aCD3对焦虑行为的益处。结果表明,鼻内给药aCD3可改善中度和重度TBI的行为学结果,且对雄性小鼠效果更显著。
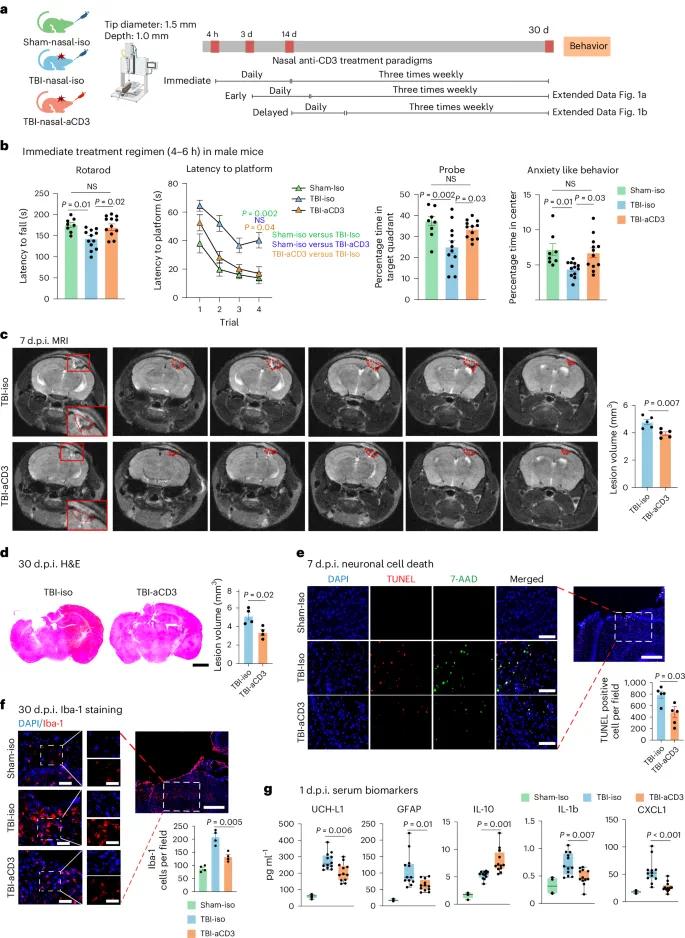
图1 鼻内给药aCD3治疗方案及行为学测试结果。(a)治疗方案示意图;(b)立即治疗组行为学测试结果(转棒实验、水迷宫实验、探试实验、旷场实验评估焦虑行为),采用两因素重复测量方差分析(MWM测试)和单因素方差分析(其他测试),数据以均值±标准误表示;(c)伤后7天MRI脑损伤体积测量,采用双侧非配对t检验分析,数据以均值±标准误表示,红色虚线指示损伤区域;(d)伤后30天H&E染色脑切片损伤体积测量,采用双侧非配对t检验分析,数据以均值±标准误表示,比例尺1000 µm;(e)伤后7天神经元死亡免疫荧光染色(DAPI蓝、TUNEL红、7-AAD绿),比例尺200 µm(放大图500 µm),TUNEL阳性细胞通过ImageJ定量,采用双侧非配对t检验分析,数据以均值±标准误表示;(f)伤后30天小胶质细胞Iba-1免疫荧光染色(DAPI蓝、Iba-1红),比例尺200 µm(放大图500 µm),Iba-1阳性细胞通过ImageJ定量,采用单因素方差分析分析,数据以均值±标准误表示;(g)伤后1天血清生物标志物检测,采用Quanterix SiMoA和V-Plex炎症因子检测,采用单因素方差分析分析,数据以箱线图(最小值、最大值、四分位距、中位数)表示。所有数据均为两个独立实验的生物学重复
(2)CD3单克隆抗体鼻内给药改善TBI神经病理过程
研究通过多种方法评估了鼻内给药aCD3对TBI引发的神经病理学结果的影响。伤后7天,3T MRI测量显示鼻内给药aCD3组脑实质损伤体积较TBI - iso对照组减少。伤后1个月,H&E染色测量的损伤体积也显示aCD3治疗组较TBI - iso对照组减少。鼻内给药aCD3在伤后3天改善了血脑屏障(BBB)完整性,降低了TBI - iso对照组同侧半球的脑水肿百分比。TUNEL染色检测到的细胞死亡在鼻内给药aCD3治疗后减少。伤后30天,CCI增加了小胶质细胞或巨噬细胞的激活(Iba - 1染色),而鼻内给药aCD3在雄鼠中减少了这种激活。与对照组相比,鼻内给药aCD3组的几种TBI血清生物标志物减少,而抗炎细胞因子IL - 10增加。这些结果表明,鼻内给药aCD3改善了TBI小鼠的行为学表现,与神经病理学和血清生物标志物所显示的增强的组织完整性相关。
(3)aCD3单克隆抗体鼻内给药增加TBI后Treg细胞数量,改变先天性和适应性免疫格局
研究通过流式细胞术分析发现,鼻内给药aCD3在伤后1天增加颈淋巴结(cLNs)中总CD4+ T细胞和CD4+FoxP3+调节性T细胞(Treg)的比例,伤后2天增加脑膜中这些细胞的总数。鼻内给药aCD3在伤后3天和7天增加大脑中CD4+ T细胞的总数,并在伤后30天内增加CD4+FoxP3+ Treg细胞。与TBI - iso组相比,未观察到表达潜伏相关肽(LAP)的CD4+ T细胞增加。结果表明,鼻内给药aCD3通过扩大Treg细胞来控制TBI后的神经炎症。
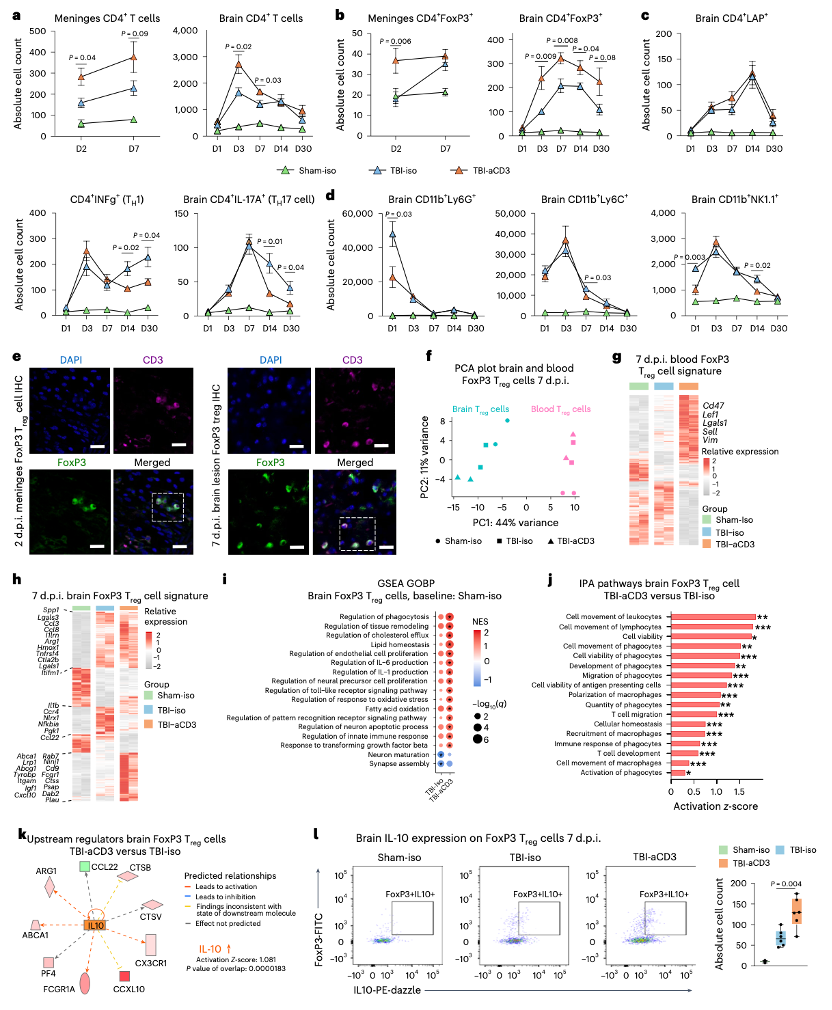
(4)aCD3单克隆抗体鼻内给药诱导的Treg细胞有独特的免疫调节特征
鼻内给药aCD3在伤后30天内增加了CD4+FoxP3+调节性T细胞(Treg)。对CCI后7天从假手术和受伤小鼠的脑周损伤组织和血液中分离的CD4+FoxP3(GFP)+ Treg细胞进行RNA测序分析。主成分分析(PCA)显示,TBI后脑内FoxP3 Treg细胞的转录组特征与血液中的显著不同。与假手术小鼠的血液Treg细胞相比,TBI小鼠脑内浸润的Treg细胞中多种免疫调节和营养因子基因表达增加。鼻内给药aCD3处理的小鼠血液中的FoxP3 Treg细胞具有独特的转录组特征,涉及Treg细胞增殖和稳态以及Treg细胞功能的基因上调。通路分析(IPA)显示,与TBI - iso FoxP3 Treg细胞相比,aCD3诱导的FoxP3 Treg细胞中IL - 10是最主要的上游激活调节因子。进一步分析发现,TBI和鼻内给药aCD3处理的小鼠脑内浸润的Treg细胞中,免疫调节相关基因表达上调。此外,aCD3诱导的Treg细胞中,免疫调节、吞噬调节、神经营养因子、脂质稳态以及其他Treg细胞免疫抑制功能所需基因的表达进一步增加。基因集富集分析(GSEA)和通路分析(IPA)显示,与假手术对照组和TBI - iso组相比,TBI - aCD3处理的小鼠脑内Treg细胞中涉及迁移、免疫反应调节、吞噬、神经发生、稳态和分泌功能的生物通路富集。通路分析(IPA)识别出IL - 10和Stat3是TBI小鼠脑内aCD3处理的Treg细胞中最主要的上游激活调节因子。流式细胞术分析显示,与TBI - iso对照组相比,aCD3处理的小鼠脑内Treg细胞中IL - 10表达上调。这些结果表明,外周和中枢Treg细胞具有独特的免疫调节特征,与鼻内给药aCD3治疗TBI后的改善相关。
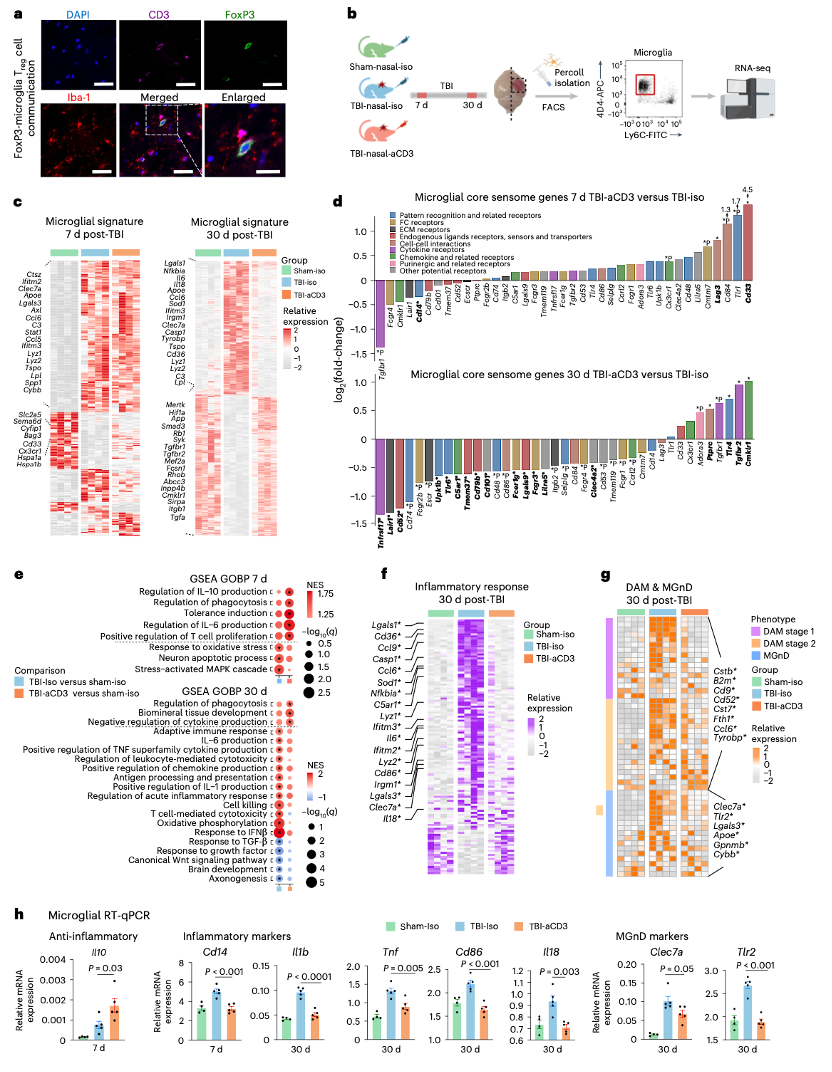
(5)aCD3单克隆抗体鼻内给药调节小胶质细胞炎症反应
鼻内给药aCD3增加了FoxP3+调节性T细胞(Treg)向脑膜和CCI损伤部位的迁移,这些细胞在损伤后与小胶质细胞树突密切接触。小胶质细胞单细胞悬浮液的RNA测序分析显示,在伤后7天,TBI - iso和TBI - aCD3组的小胶质细胞转录组特征相似,但到伤后30天,TBI - aCD3组的小胶质细胞转录组特征向假手术对照组表型转变,表现为下调促炎基因(如Il6、Il18)和上调稳态基因(如Tgfbr2、Mertk)。在伤后7天,鼻内给药aCD3处理的小胶质细胞中,稳态和感知相关基因(如Cd33、Lag3)表达增加,且下调促炎关键调节因子Cd14。伤后30天,aCD3处理增加了TGF - β信号通路基因表达(如Smad3、Tgfbr1),并下调了细胞因子受体和模式识别受体相关基因(如Tnfrsf17、Cd74)。基因集富集分析(GSEA)表明,在伤后7天,TBI - iso组上调氧化应激和神经元凋亡相关通路,而TBI - aCD3组在这些通路中的基因上调较少,且在抗炎IL - 10产生和吞噬相关通路中基因上调更多。伤后30天,TBI - iso组在促炎机制和细胞杀伤通路中基因表达富集,而TBI - aCD3组在这些通路中的基因上调较少,且在吞噬和细胞因子产生相关通路中基因上调更多。分析伤后30天的炎症反应基因和疾病相关小胶质细胞(DAMs)、神经退行性小胶质细胞(MGnDs)特征基因发现,TBI - iso小胶质细胞具有促炎反应和DAM或MGnD特征,而aCD3处理的小鼠中这些基因表达下调,接近假手术组水平。定量PCR(RT - qPCR)显示,鼻内给药aCD3在伤后7天增加小胶质细胞和脑组织中抗炎细胞因子Il10的表达,并在伤后30天减少促炎标志物表达,同时上调脑源性神经营养因子(Bdnf)。这些结果表明,鼻内给药aCD3使小胶质细胞从病理性的、疾病相关表型转变为有益的、稳态表型。
(6)鼻腔 aCD3 以 IL-10 依赖性方式增加小胶质细胞吞噬作用
TBI - aCD3处理的小鼠在伤后7天吞噬相关生物学通路显著上调,且在伤后30天多种关键小胶质细胞吞噬调节因子(Mertk、Sirpa和Tlr4)表达增加。实验在伤后6天和7天分别注射标记的凋亡神经元或PBS,并在注射后16小时和4小时检测,结果显示aCD3处理的小鼠在注射后4小时和16小时的吞噬能力均高于TBI - iso组。对伤后7天的吞噬性和非吞噬性小胶质细胞进行RNA测序分析,结果显示吞噬性TBI - aCD3小胶质细胞在注射后4小时表现出独特的转录组特征,涉及多种关键吞噬基因的上调。与非吞噬性TBI - iso小胶质细胞相比,吞噬性TBI - aCD3小胶质细胞在识别和吞噬凋亡细胞及碎片(Mertk、Mrc1、Abca1、Lrp1和Stab1)、消化降解吞噬物(Rab27a、Smcr8、Clec16a和Vps8)、脂质代谢(Apoc1、Olr1和Ldlr)、细胞骨架动态(Myo1e)和调节小胶质细胞吞噬(Tspo、Qk和Pik3cg)的基因表达增加。基因集富集分析(GSEA)显示,与非吞噬性TBI - iso小胶质细胞相比,吞噬性TBI - aCD3小胶质细胞在吞噬相关通路(包括内吞、模式识别和细胞迁移)中显著富集。此外,与吞噬性TBI - iso小胶质细胞相比,吞噬性TBI - aCD3小胶质细胞在抗原呈递和IL - 10通路的上调更为显著。通路分析(IPA)显示,IL - 10是aCD3处理的吞噬性小胶质细胞中最重要的调节因子和信号通路。在伤后16小时,也观察到类似的吞噬机制相关基因和通路的上调,且吞噬性TBI - aCD3小胶质细胞表现出更稳态、更少炎症(疾病相关)的特征。使用IL - 10基因敲除(KO)小鼠重复小胶质细胞吞噬实验,结果显示IL - 10 KO小鼠中TBI - aCD3小胶质细胞在注射后4小时的吞噬能力显著降低,且与野生型(WT)TBI - iso小胶质细胞相比,IL - 10 KO小鼠的TBI - iso小胶质细胞吞噬能力显著降低。这些结果表明,鼻内给药aCD3通过IL - 10依赖的方式增强了小胶质细胞的吞噬机制。
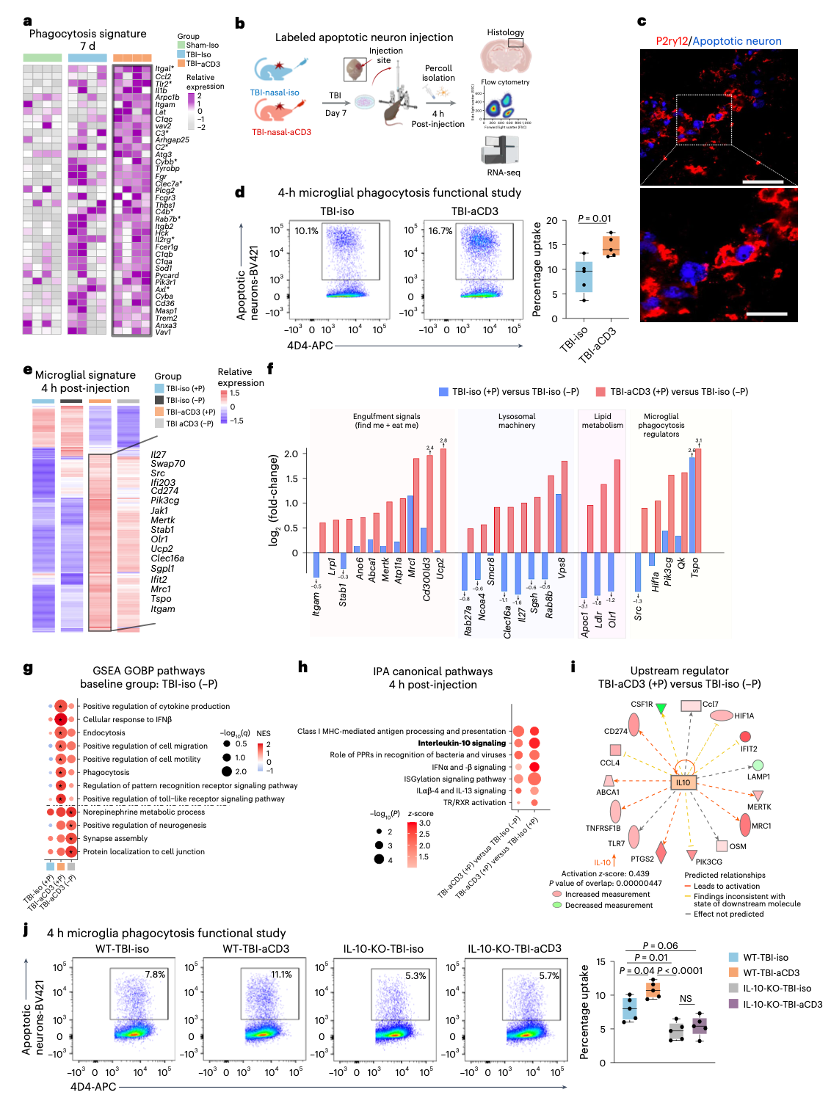
图4 小胶质细胞吞噬功能的表征及鼻内给药aCD3的影响。(a)伤后7天小胶质细胞吞噬相关基因的热图,基因通过DESeq2分析(双侧似然比检验,每组n = 4只小鼠)鉴定,FDR校正P < 0.05的基因用星号表示;(b)吞噬功能实验示意图;(c)伤后7天损伤部位的免疫荧光染色(凋亡神经元蓝、P2ry12红),显示P2ry12吞噬凋亡神经元,比例尺100 µm(放大图50 µm);(d)注射标记的凋亡神经元后4小时的小胶质细胞吞噬实验,数据以箱线图表示,每组n = 5只小鼠,采用双侧非配对t检验分析;(e)伤后7天及凋亡神经元注射后4小时,吞噬性(+P)和非吞噬性(-P)小胶质细胞的差异表达基因(DEGs)聚类热图(DESeq2分析,双侧似然比检验,每组n = 3 - 4只小鼠,FDR校正P < 0.05);(f)与小胶质细胞吞噬及相关功能相关的基因在TBI - iso(+P)与TBI - iso(-P)以及TBI - aCD3(+P)与TBI - iso(-P)比较中的log2(倍数变化)条形图;(g)基于上述比较的基因集富集分析(GSEA),q值 < 0.05的富集项用星号表示;(h)与吞噬性TBI - iso小胶质细胞相比,吞噬性TBI - aCD3小胶质细胞的DEGs的通路分析中选择的顶级典型通路;(i)TBI - aCD3(+P)与TBI - iso(-P)比较中预测的上游调节因子;(j)与(b)相似设计的吞噬实验,数据以箱线图表示,每组n = 5只小鼠,采用单因素方差分析分析。所有数据均为生物学重复,代表两个独立实验
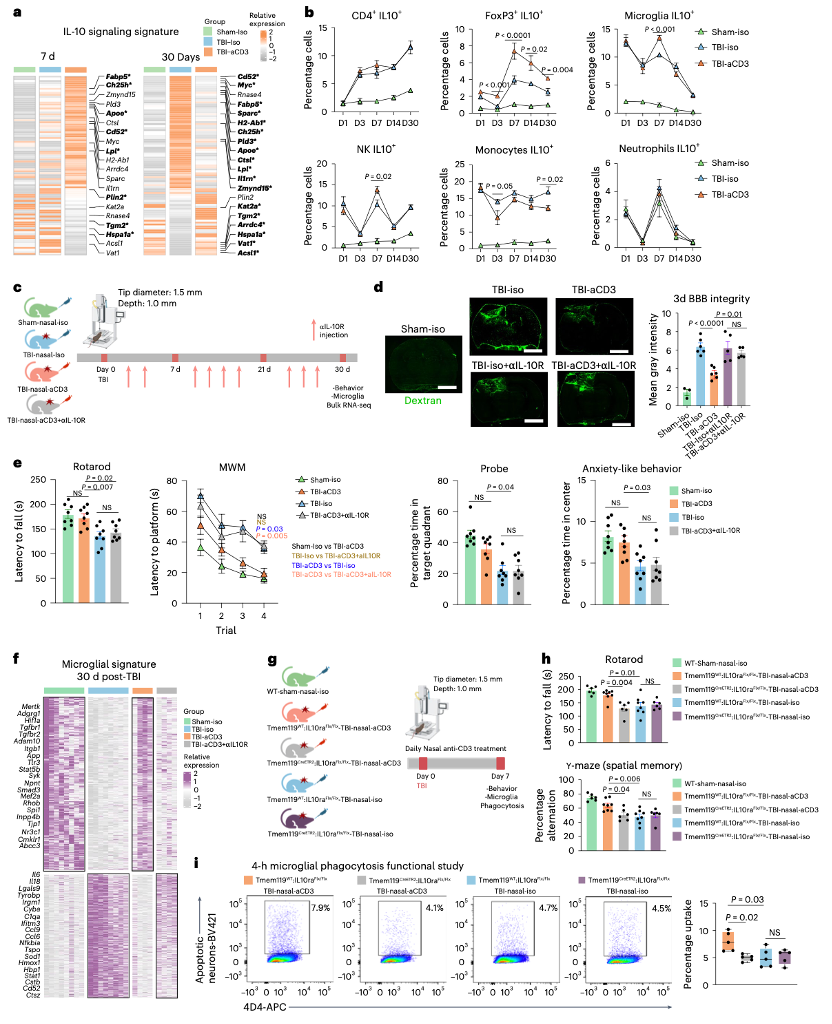
(7)鼻腔 aCD3 通过小胶质细胞中的 IL-10/IL-10R 信号转导改善 TBI 预后
在伤后7天,TBI - aCD3组小胶质细胞的IL - 10细胞因子基因表达显著上调。鼻内给药aCD3诱导分泌IL - 10的Treg细胞,并在损伤部位的小胶质细胞和脑组织中增加IL - 10表达。通过腹腔注射抗IL - 10R(aIL - 10R)阻断抗体,每3天一次,研究假手术 - iso、TBI - iso、TBI - aCD3和TBI - aCD3 + aIL - 10R组的行为学结果和血脑屏障(BBB)破坏情况。结果显示,TBI - aCD3组在BBB破坏以及运动协调功能、空间记忆和焦虑样行为方面的改善被IL - 10R阻断抵消。RNA测序分析发现,伤后1个月,鼻内给药aCD3对小胶质细胞的调节作用被IL - 10阻断,小胶质细胞热图显示TBI - aCD3 + aIL - 10R组表现出更促炎的转录组特征,且稳态标志物表达减少。使用IL - 10Rflox/floxTmem119CreETR2条件性敲除(KO)小鼠及其同窝对照小鼠,研究小胶质细胞IL - 10R敲除对行为学和小胶质细胞吞噬能力的影响,发现经他莫昔芬处理的TBI - aCD3 - IL - 10Rflox/floxTmem119CreETR2小鼠表现出更差的运动和认知结果以及降低的小胶质细胞吞噬能力。这些结果表明,IL - 10/IL - 10R信号在增强小胶质细胞吞噬能力和改善TBI疾病中起关键作用。
(8)鼻腔 aCD3 诱导的 CD4+FoxP3+Treg细胞改善神经炎症和 TBI 结果
鼻内给药aCD3在伤后3天至30天增加了损伤部位的FoxP3+ Treg细胞,并通过减少小胶质细胞炎症改善了TBI的行为学和神经病理学结果。过继转移实验中,接受aCD3处理小鼠的CD4+FoxP3+ Treg细胞的小鼠在伤后7天表现出改善的运动功能和协调性,并恢复了空间记忆。对TBI - aCD3 - FoxP3+、TBI - iso - FoxP3+和TBI - aCD3 - FoxP3− GFP组小鼠损伤侧半球的小胶质细胞进行RNA测序分析,发现TBI - aCD3 - FoxP3+小胶质细胞与其他组相比具有独特的转录组特征。基因集富集分析(GSEA)显示,与TBI - aCD3 - FoxP3−小胶质细胞相比,TBI - aCD3 - FoxP3+小胶质细胞下调了包括干扰素(IFN)γ和IFNα在内的多种促炎通路。通路分析(IPA)揭示IL - 10Ra是TBI - aCD3 - FoxP3+小胶质细胞中最重要的上游激活调节因子之一,而IL - 1b是最重要的上游抑制调节因子之一。与TBI - iso - FoxP3+小胶质细胞相比,TBI - aCD3 - FoxP3+小胶质细胞中IFNγ是最显著下调的调节因子之一。定量PCR(RT - qPCR)显示,与另外两组相比,TBI - aCD3 - FoxP3+小胶质细胞中促炎细胞因子减少,稳态和抗炎细胞因子表达增加。接受aCD3处理小鼠的CD4+FoxP3+ Treg细胞的小鼠在伤后7天增加了小胶质细胞的吞噬能力。这些结果表明,FoxP3+ Treg细胞在增强小胶质细胞吞噬能力和改善TBI疾病中起关键作用。
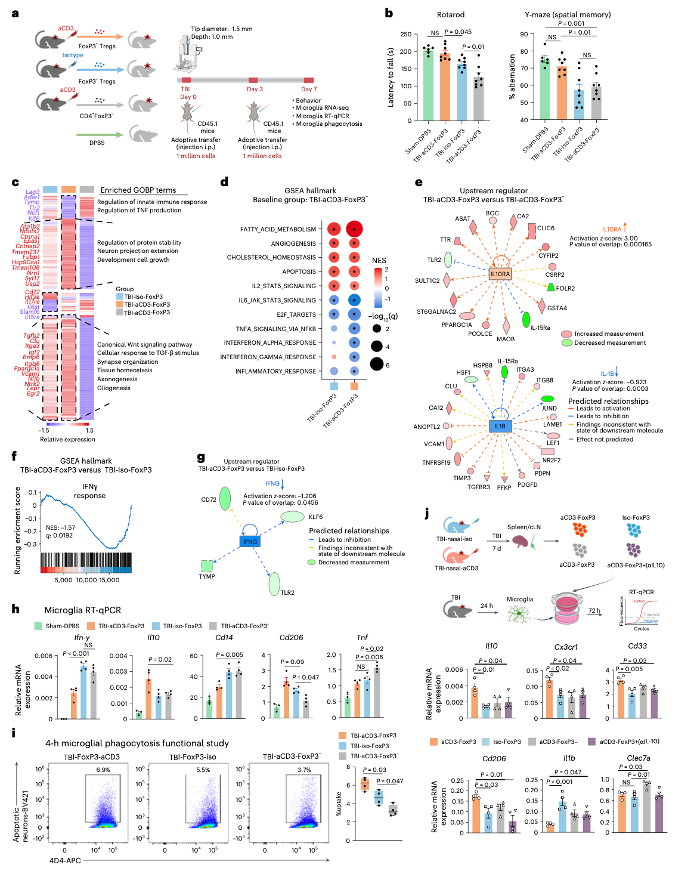
图6 Treg细胞对TBI后行为学和小胶质细胞炎症的影响。(a)过继转移实验时间线;(b)转棒实验和Y迷宫测试结果,数据以均值±标准误表示,采用单因素方差分析分析;(c)伤后7天小胶质细胞的差异表达基因(DEGs)聚类热图,基因通过DESeq2分析(双侧Wald检验,每组n = 3只小鼠,FDR校正P < 0.05)鉴定,聚类用基因本体生物学过程(GOBP)富集项(q值 < 0.05)注释;(d)基因集富集分析(GSEA)分析TBI - iso FoxP3与TBI - aCD3 - FoxP3−以及TBI - aCD3 - FoxP3与TBI - aCD3 - FoxP3−的比较,q值 < 0.05的富集项用星号表示;(e)TBI - aCD3 - FoxP3与TBI - aCD3 - FoxP3−比较的预测上游调节因子(通路分析);(f)TBI - aCD3 - FoxP3与TBI - iso FoxP3比较的基因集富集分析;(g)TBI - aCD3 - FoxP3与TBI - iso FoxP3比较的预测上游调节因子(通路分析);(h)伤后7天损伤侧半球小胶质细胞的定量PCR分析,以GAPDH为内参,数据以均值±标准误表示,采用单因素方差分析分析;(i)与图4b相似设计的小胶质细胞吞噬实验,数据以箱线图(最小值、最大值、四分位距、中位数)表示,采用单因素方差分析分析;(j)小胶质细胞和Treg细胞共培养示意图;(k)小胶质细胞的定量PCR分析,以GAPDH为内参,数据以均值±标准误表示,采用单因素方差分析分析。所有数据均为生物学重复,代表两个独立实验
(9)CD4+Foxp3+Treg细胞在体外抑制小胶质细胞炎症和稳态标志物
采用体外共培养系统,从小鼠CCI损伤后24小时的损伤侧半球分离小胶质细胞,并从接受CCI和鼻内给药aCD3或同型对照处理7天的小鼠脾脏中分离Treg细胞。共培养72小时后对小胶质细胞进行定量PCR分析,结果显示,与TBI - iso组相比,TBI - aCD3组小胶质细胞中抗炎和稳态标志物(Il10、Cx3cr1和Cd206)增加,促炎标志物Il1b减少,这与伤后7天的体内小胶质细胞转录组数据一致。此外,通过体外阻断IL - 10,这种效应消失,这也与体内IL - 10中和后的观察结果一致。
(10)产生IL-10的Treg细胞促进小胶质细胞吞噬、改善神经炎症及功能预后
鼻内给药aCD3处理小鼠的FoxP3 Treg细胞过继转移可改善TBI,且IL - 10在其中发挥重要作用。利用FoxP3 - DTR转基因小鼠耗竭FoxP3 Treg细胞,白喉毒素(DT)在CCI前3天注射,并每3天重复一次,直至CCI或假手术后7天。结果表明,FoxP3 Treg细胞的耗竭恶化了运动功能,加剧了小胶质细胞炎症,并增加了促炎小胶质细胞标志物(Il1b、Tnf、Il6和Il18)的表达。FoxP3 Treg细胞的耗竭降低了小胶质细胞吞噬死亡神经元的能力。使用10BiT.FoxP3GFP双重报告系统分离IL - 10+和IL - 10− Treg细胞,并将这些细胞过继转移至FoxP3耗竭小鼠中,观察到IL - 10+ Treg细胞与IL - 10− Treg细胞相比,改善了运动功能和空间记忆,降低了促炎标志物的表达,并且增强了小胶质细胞对死亡神经元的吞噬能力。因此,IL - 10在鼻内给药aCD3诱导的FoxP3 Treg细胞对TBI的有益效果中起关键作用。
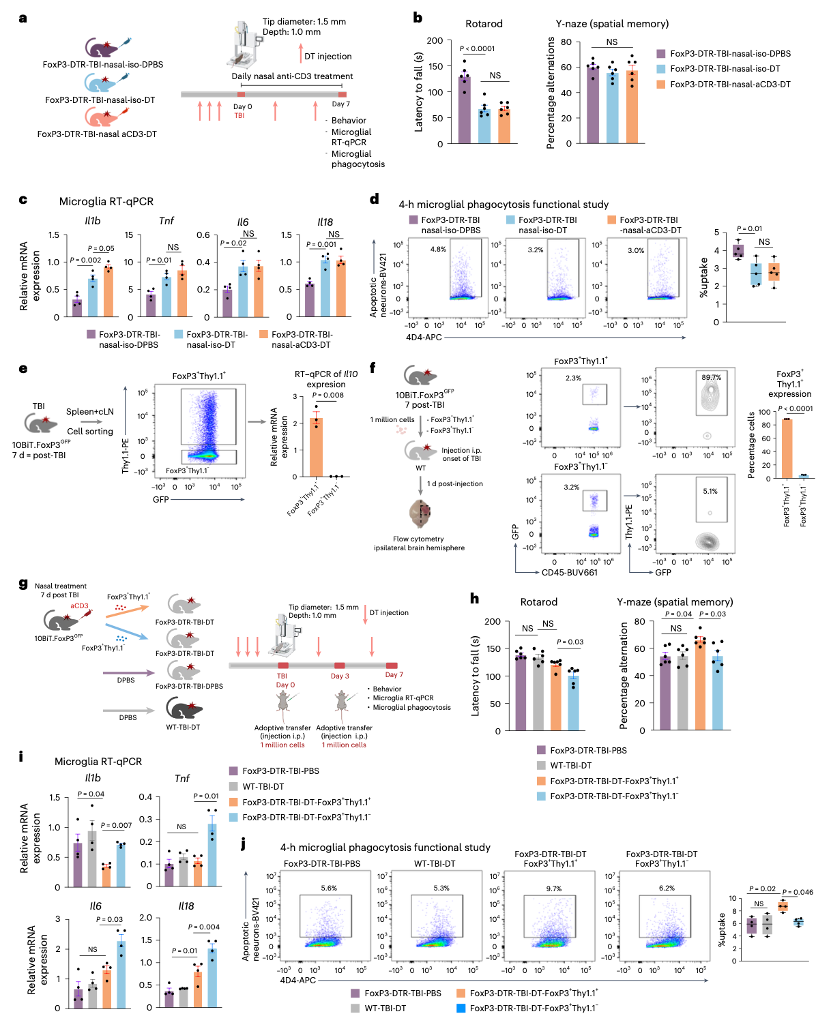
图7 FoxP3 - DTR Treg细胞耗竭及相关实验的表征。(a)FoxP3 - DTR Treg细胞耗竭的实验时间线;(b)行为测试中,旋转杆和Y迷宫评估各组差异,数据以均值±标准误表示,每组6只小鼠,采用单因素方差分析(ANOVA)结合Tukey多重比较检验分析;(c)TBI后7天同侧半球小胶质细胞的RT - qPCR分析,表达量以GAPDH为内参标准化,数据以均值±标准误表示,每组4只小鼠,采用单因素方差分析(ANOVA)结合Tukey多重比较检验分析;(d)与图4b相似设计的吞噬实验,数据以箱线图表示,每组5只小鼠,采用单因素方差分析(ANOVA)结合Tukey多重比较检验分析;(e)验证Il10表达的示意图,对FoxP3 + Thy1.1 + 和FoxP3 + Thy1.1−分选细胞进行Il10表达的RT - qPCR分析,表达量以GAPDH为内参标准化,数据以均值±标准误表示,每组3只小鼠,采用双侧非配对Student t检验分析;(f)过继转移实验示意图,分析两组间FoxP3上Thy1.1的表达差异,数据以均值±标准误表示,每组3个样本(每个样本为5个损伤半球的混合),采用双侧非配对Student t检验分析;(g)过继转移实验的实验时间线示意图;(h)行为测试中,旋转杆和Y迷宫评估各组差异,数据以均值±标准误表示,每组6只小鼠,采用单因素方差分析(ANOVA)结合Tukey多重比较检验分析;(i)TBI后7天同侧半球小胶质细胞的RT - qPCR分析,表达量以GAPDH为内参标准化,数据以均值±标准误表示,每组4只小鼠,采用单因素方差分析(ANOVA)结合Tukey多重比较检验分析;(j)与图4b相似设计的吞噬实验,数据以箱线图表示,每组4只小鼠,采用单因素方差分析(ANOVA)结合Tukey多重比较检验分析。所有数据均为生物学重复,代表两次独立实验的结果
本研究揭示了鼻内给予抗CD3单克隆抗体(aCD3 mAb)对创伤性脑损伤(TBI)的治疗潜力。研究发现,aCD3 mAb能够诱导产生IL - 10的调节性T细胞,这些细胞通过与小胶质细胞的相互作用,增强小胶质细胞的吞噬能力,调节中枢神经系统(CNS)的固有免疫和适应性免疫反应。这一机制有效改善了TBI后的功能恢复。因此,鼻内给药aCD3 mAb有望成为治疗TBI及其他急性脑损伤的新策略。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

