
糖尿病足溃疡(DFUs)是糖尿病的严重并发症,愈合困难,常导致截肢甚至死亡。现有治疗方法效果不佳且有副作用,急需更有效的疗法。糖尿病伤口愈合分为炎症、增殖和重塑三期。伤口发生后,微血管受损,氧气供应不足,活性氧(ROS)过度产生,形成不良微环境,阻碍伤口愈合。因此,开发能清除ROS并产生氧气的多功能干预系统对促进愈合至关重要。
水凝胶喷雾具有良好的生物相容性和对不规则伤口的贴合性,但现有产品未能同时解决ROS和缺氧问题。纳米酶具有类似酶的催化功能,可将过量的ROS转化为氧气。将纳米酶引入水凝胶喷雾,可有效清除ROS、增加氧气供应,改善伤口微环境,为糖尿病伤口愈合提供新策略。

受人类皮肤保湿和保护功能的启发,中山大学附属第一医院廖威明主任和华南理工大学张琨雨、边黎明教授团队开发了一种用于加速糖尿病足溃疡(DFU)愈合的活性氧驱动的供氧水凝胶喷雾(OxyGel)。该喷雾结合了模拟超氧化物歧化酶(SOD)/过氧化氢酶(CAT)功能的纳米酶和动态交联的超分子水凝胶。通过唑来膦酸辅助组装铈离子并用单宁酸修饰,制备了具有级联催化功能的纳米酶(TCZ)。接着利用透明质酸、去铁胺修饰的β-环糊精和叔丁基苯乙酸修饰的透明质酸,通过动态主客体相互作用和席夫碱键制备了可喷雾的OxyGel,并通过氢键锚定TCZ纳米酶。OxyGel能有效改善氧化和缺氧微环境,促进M1型巨噬细胞向M2型极化,并增强体外内皮细胞的存活、迁移和血管生成。在动物模型中,仅一次使用OxyGel喷雾即可显著加快两周内的伤口愈合。该文章于2025年6月10日以《Nanozyme-Reinforced Hydrogel Spray as a Reactive Oxygen Species-Driven Oxygenator to Accelerate Diabetic Wound Healing》为题发表于《Advanced Materials》(DOI:10.1002/adma.202504829)。

图1 纳米酶增强水凝胶喷雾作为活性氧驱动的氧合器(OxyGel喷雾)加速糖尿病足部溃疡伤口愈合的示意图。a)TCZ纳米酶的合成路线和级联催化功能示意图。b)OxyGel喷雾的制备工艺和交联机制示意图。c)OxyGel喷雾在糖尿病足部溃疡治疗中的作用机制
(1)TCZ 纳米酶和可喷涂 OxyGel 的表征
构建了一种纳米酶增强型水凝胶喷雾。利用唑来膦酸介导铈离子组装形成CZ纳米颗粒,再经单宁酸修饰得到抗氧化的TCZ纳米酶。透射电子显微镜(TEM)显示TCZ纳米酶为均匀球体,平均直径100 nm,动态光散射(DLS)测得其流体动力学尺寸约为150 nm(图2a、b)。TCZ纳米酶的催化活性源于Ce3+/Ce4+的氧化还原循环,具有SOD和CAT类活性。实验验证了TCZ纳米酶的酶模拟活性(图2c),其对超氧阴离子(•O2-)的清除能力呈剂量依赖性增加,电子顺磁共振(EPR)光谱进一步证实了其SOD模拟活性(图2d)。TCZ纳米酶催化H2O2分解产生氧气的能力随H2O2浓度增加而增强(图2e)。在溶血实验中,TCZ纳米酶在铈离子浓度高达500 µM时仍保持稳定的血液相容性(图2f)。扫描电子显微镜(SEM)显示OxyGel具有均匀、连通的多孔微观结构(图2h)。动态流变测试表明,OxyGel具有典型的水凝胶行为,储能模量(G’)高于损耗模量(G’’),且在75%应变下仍能保持完整并快速恢复(图2i、j、k)。OxyGel在12 h内达到膨胀平衡并保持稳定(图S10)。通过单喷头喷雾,OxyGel可形成均匀且覆盖面积大的完整薄膜(图2l、图S11、S12)。与传统预制水凝胶和注射水凝胶相比,OxyGel喷雾使用更方便,可为暴露在空气中的糖尿病伤口提供即时物理保护。OxyGel的pH响应性使其在酸性糖尿病伤口微环境中能够智能调节TCZ纳米酶的释放速率(图2m)。
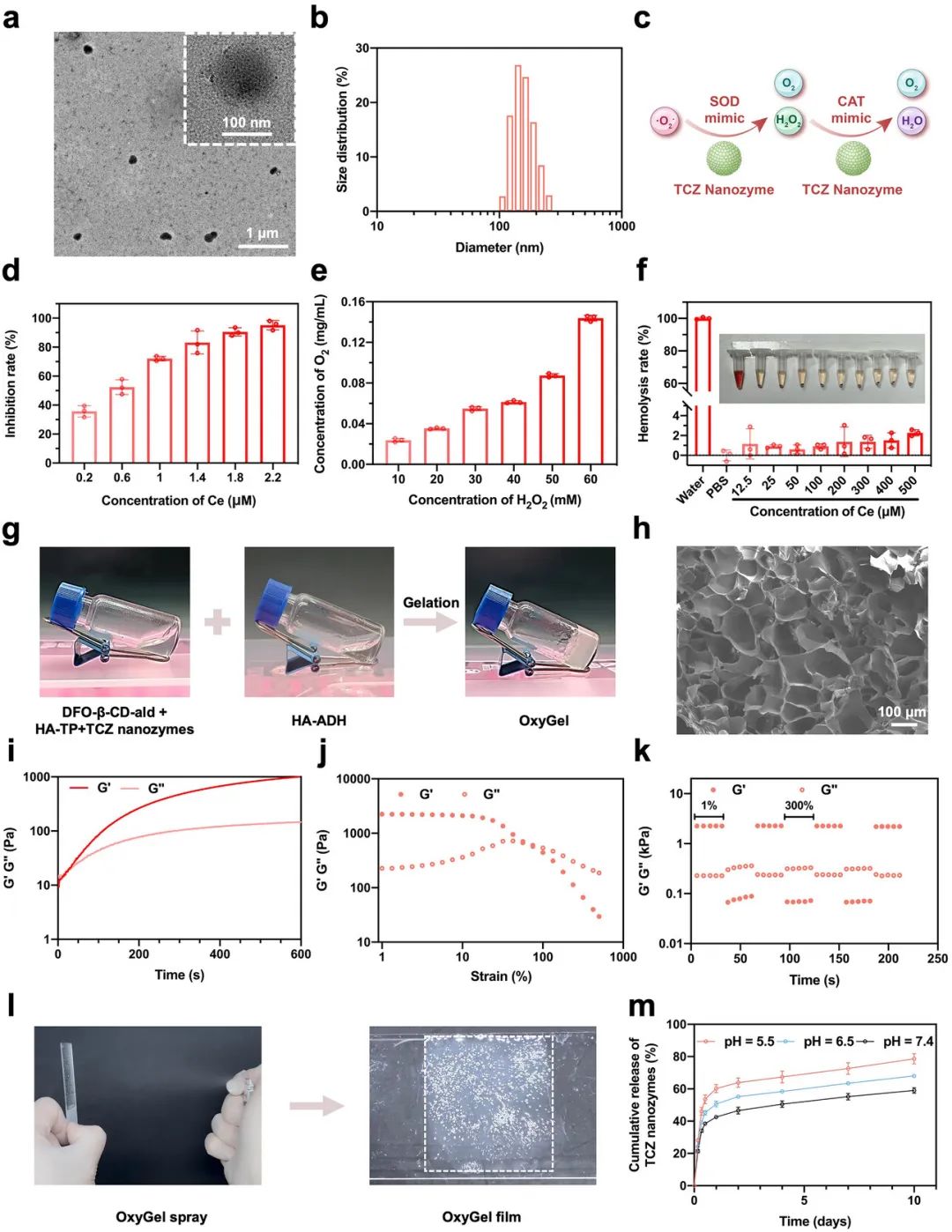
图2 TCZ 纳米酶和可喷涂 OxyGel 的表征。 a) TCZ 纳米酶的 TEM 图像。b) 通过 DLS 测量 TCZ 纳米酶的水化尺寸分布。c) TCZ 纳米酶的 SOD 和 CAT 模拟活性示意图。d) TCZ 纳米酶的 SOD 和 e) CAT 模拟活性测量(n = 3)。f) TCZ 纳米酶的血液相容性(n = 3)。插图:溶血测试的数码照片。g) OxyGel 的溶胶-凝胶转变。h) OxyGel 的 SEM 图像。i) OxyGel 的时间和 j) 应变扫描测试。k) OxyGel 的流变学阶跃应变振荡时间扫描测量。l) 喷涂 OxyGel 后形成的即时水凝胶膜的照片。 m) 不同条件下(pH 5.5、6.5 和 7.4)TCZ 纳米酶从 OxyGel 中释放的概况(n = 3)
(2)OxyGel水凝胶诱导抗炎M2巨噬细胞极化并捕获过量的ROS以促进氧合
在炎症阶段,通过脂多糖(LPS)刺激的巨噬细胞模型评估了OxyGel诱导M2型(抗炎)巨噬细胞极化的抗炎特性(图3a)。实验中还构建了不含TCZ纳米酶的空白水凝胶(Gel)作为对照。CCK-8实验结果表明,Gel和OxyGel对巨噬细胞和人脐静脉内皮细胞(HUVECs)均具有良好的生物相容性。经LPS刺激24小时后,与OxyGel共孵育的巨噬细胞中诱导型一氧化氮合酶(iNOS,M1标志物)荧光强度显著降低,而精氨酸酶-1(Arg-1,M2标志物)荧光强度增加,表明OxyGel可显著促进巨噬细胞从M1型向M2型转变(图3b-e)。实时定量聚合酶链反应(RT-qPCR)结果与免疫荧光染色结果高度一致(图3f-i,图S17、S18)。与LPS+PBS组相比,OxyGel组巨噬细胞中促炎介质(如CD86、白细胞介素-1β和肿瘤坏死因子-α)的mRNA表达水平降低,而抗炎介质(如CD206、白细胞介素-10和CD163)的基因表达水平升高,显示出OxyGel的显著抗炎功能。
此外,鉴于OxyGel具有清除活性氧(ROS)和产生氧气的双重功能,实验评估了其将LPS诱导的ROS转化为氧气的能力。通过将HUVECs与OxyGel共孵育,并使用经典的ROS探针2′7′-二氯二氢荧光素二乙酸酯(DCFH-DA)和氧气探针三(4,7-二苯基-1,10-菲咯啉)钌(II)二氯化物复合物[Ru(dpp)₃Cl₂]进行染色,观察到OxyGel显著降低了由LPS诱导的细胞内ROS积累,荧光强度降低了约一倍(图3j、k)。同时,由于细胞内氧气的生成,与OxyGel共培养的HUVECs中[Ru(dpp)₃]Cl₂的荧光信号显著猝灭(图3l、m)。这些结果证实了OxyGel能够同时实现高效的ROS清除和持续的氧气供应,突显了其在糖尿病伤口愈合中的治疗潜力。
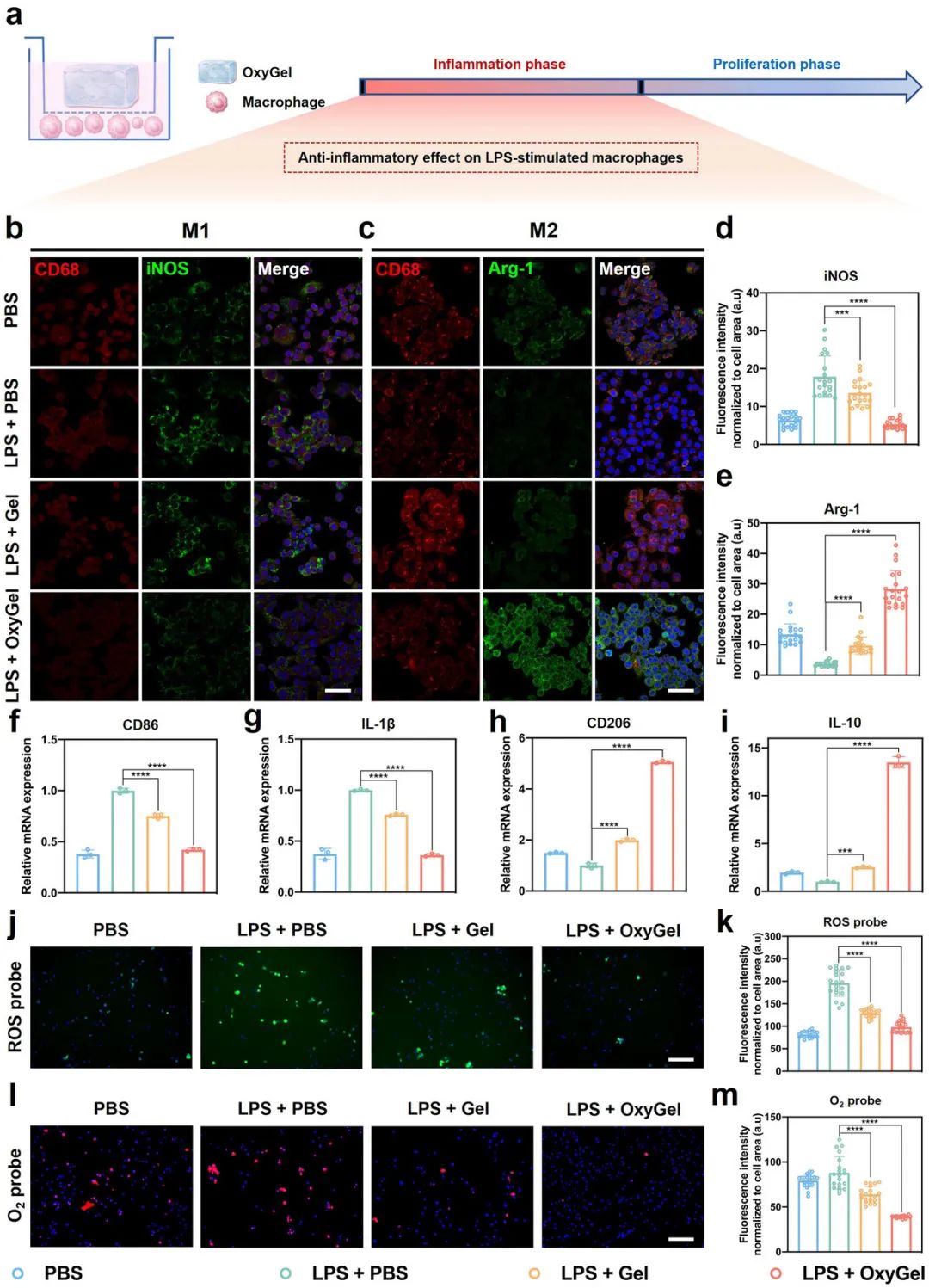
图3 具有ROS 清除和O2生成双重功能的 OxyGel 可诱导巨噬细胞从 M1 复极化为 M2。a) 示意图说明 OxyGel 对 LPS 刺激的巨噬细胞的抗炎作用。b) 和 c) 未经或经不同处理的巨噬细胞的免疫荧光染色。比例尺,50 µm。d) 巨噬细胞中的 iNOS 和 e) Arg-1 荧光强度(n = 20)。fi) 通过 RT-qPCR 分析评估的 M1 巨噬细胞标志物(CD86 和 IL-1β)和 M2 巨噬细胞标志物(CD206 和 IL-10)的 mRNA 水平(n = 3)。 jk) 使用 ROS 探针 (DCFH-DA) 测量 LPS 诱导的 ROS 清除功能。比例尺,200 µm。 lm)使用O2探针 [Ru(dpp)3Cl2 ]测量O2生成功能。红色 Ru(dpp)3Cl2荧光被 O2猝灭( n = 20)。比例尺,200 µm。数据以平均值±标准差 (SD) 表示;使用单因素方差分析 (ANOVA) 和 Tukey 事后检验评估统计学差异;***0.0001 < p < 0.001,和 **** p < 0.0001
(3)OxyGel水凝胶保护体外增殖、迁移和血管生成免受氧化损伤
在增殖阶段,研究了OxyGel对过氧化氢(H2O2)诱导的氧化应激下人脐静脉内皮细胞(HUVECs)的保护作用(图4a)。实验建立了H2O2诱导的氧化损伤模型,结果表明OxyGel能清除细胞内过量的ROS,使ROS水平恢复正常(图4b、c)。通过EdU掺入实验评估OxyGel在富含H2O2的微环境中对细胞增殖的保护作用H2O2+OxyGel组的EdU阳性细胞数量显著增加,表明DNA合成增多(图4d、e)。细胞增殖实验结果与EdU实验一致,H2O2+OxyGel组的细胞增殖率高于H2O2+PBS组,显示出OxyGel对H2O2诱导的氧化损伤具有缓解作用(图4f)。
通过划痕实验评估H2O2刺激下HUVECs的迁移能力(图4g、h)。结果显示,H2O2显著抑制了HUVECs的迁移,而OxyGel能逆转这一抑制作用。在管状结构形成实验中,H2O2+OxyGel组的HUVECs在共培养6小时后,分支数量和总分支长度均显著高于其他H2O2处理组,表明OxyGel具有促进血管生成的潜力。

图4 OxyGel 促进H2O2诱导的氧化应激下 HUVEC 的增殖、迁移和血管生成。a) 示意图说明 OxyGel 对受H2O2刺激的 HUVEC 的保护作用。b、c)通过 DCFH-DA 测量H2O2诱导的 OxyGel 的 ROS 清除能力 ( n =20)。比例尺,200 µm。de) HUVEC 中的免疫荧光图像和 EdU 染色的量化 ( n =5)。比例尺,200 µm。f) 接受不同处理的 HUVEC 的细胞增殖测定 ( n =3)。g) 对接受不同处理的 HUVEC 在 0、12 和 24 小时进行的划痕愈合试验 (n=3)。比例尺,200 µm。 h) 体外划痕实验测定的伤口愈合率(n =3)。i) 不同处理后HUVEC的成管能力。比例尺:100 µm。j、k) 分支数量和总分支长度的量化(n =3)
(4)OxyGel喷雾加速糖尿病全层背部皮肤伤口愈合
OxyGel具有良好的喷雾性、抗氧化能力、氧气释放和抗炎特性,有望用于糖尿病伤口愈合。实验建立了链脲佐菌素(STZ)诱导的糖尿病大鼠全层背皮肤缺损模型(直径10 mm),评估OxyGel喷雾的愈合加速性能(图5a)。对切口伤口分别进行一次Gel、OxyGel喷雾或商业水凝胶敷料(Hydrosorb)处理,未处理伤口作为对照。结果显示,经OxyGel喷雾处理的伤口在治疗14天后愈合率显著加快,接近100.00%,与其他组相比差异显著(图5b-e)。而Hydrosorb处理组在第14天的愈合率仅比对照组高约10.00%。
进一步对四组再生伤口组织样本进行组织学分析,包括苏木精-伊红(H&E)染色和马松染色(图5f-j),评估伤口愈合参数,如瘢痕指数、表皮厚度和胶原比例。OxyGel喷雾组的瘢痕指数最低,表明其具有无瘢痕愈合的潜力(图5g)。此外,该组伤口的表皮层最薄,有利于防止厚痂或瘢痕疙瘩形成(图5h)。与对照组和Hydrosorb组相比,OxyGel喷雾组的胶原纤维排列更密集且有序,表明胶原沉积增强。
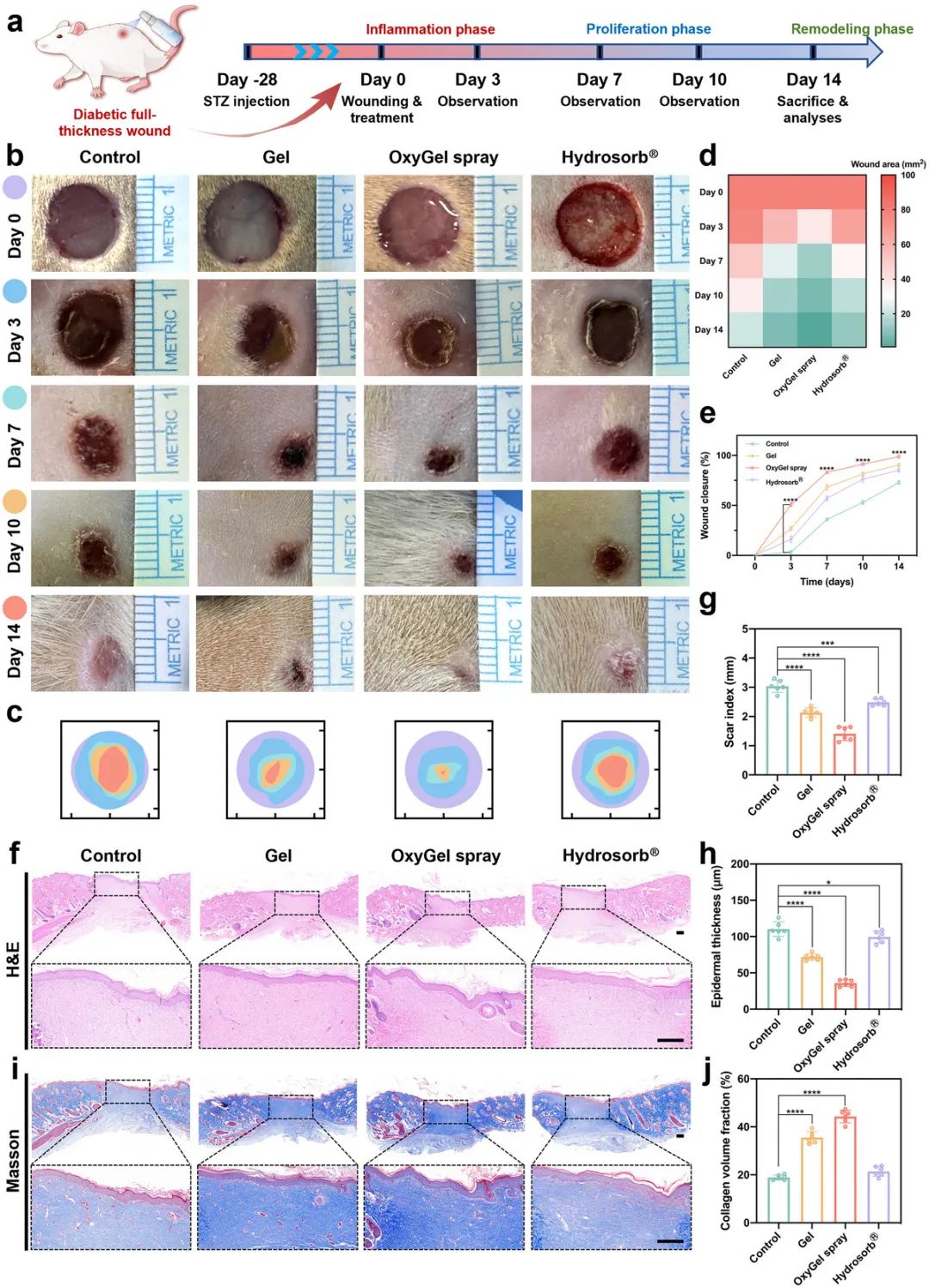
图5 OxyGel 喷雾可加速大鼠糖尿病全层背部皮肤伤口愈合。 a) 体内背部皮肤伤口(直径 10 毫米)愈合研究的实验时间表,单次给药和评估超过 14 天。b) 不同治疗方法后背部伤口愈合过程的代表性照片。c) 从第 0 天到第 14 天的伤口闭合痕迹。d、e) 伤口面积(mm 2)和伤口闭合率的定量分析(n =6)。f) H&E 染色,g) 疤痕指数,和 h) 第 14 天背部伤口组织的表皮厚度(n =6)。比例尺,300 µm。i) 第 14 天背部伤口组织的 Masson 染色和胶原体积分数(n =6)。比例尺,300 µm
(5)OxyGel喷雾调节伤口愈合过程的炎症、增殖和重塑阶段,加速难治性糖尿病足溃疡伤口愈合
在全层背皮肤伤口愈合取得良好效果的基础上,进一步评估了OxyGel喷雾对糖尿病大鼠难治性糖尿病足溃疡(DFUs)的治疗效果。与背皮肤伤口相比,DFUs的治疗要求更高,因为足部是人体负重的主要部位,长期承受机械压力、频繁活动且血供较差。通过在糖尿病大鼠足背打孔建立直径6 mm的圆形全层切口DFU模型(图6a)。在治疗期间,OxyGel喷雾处理组的伤口愈合速度最快,第14天时伤口面积仅为原始面积的3.33%,且外观接近正常皮肤组织,无肥厚性或瘢痕疙瘩形成(图6b-e)。相比之下,Hydrosorb和Gel组的伤口闭合不完全,愈合率不理想。组织病理学评估(H&E染色和马松染色)显示,OxyGel组的DFU伤口愈合明显,瘢痕指数显著降低,表皮层薄,胶原纤维形成增强,愈合效果良好(图6f-j)。此外,OxyGel处理组的皮肤组织修复良好,伤口表面连续且完整,新生血管、毛囊和腺体密度高,表明DFU伤口愈合过程稳健且平衡。
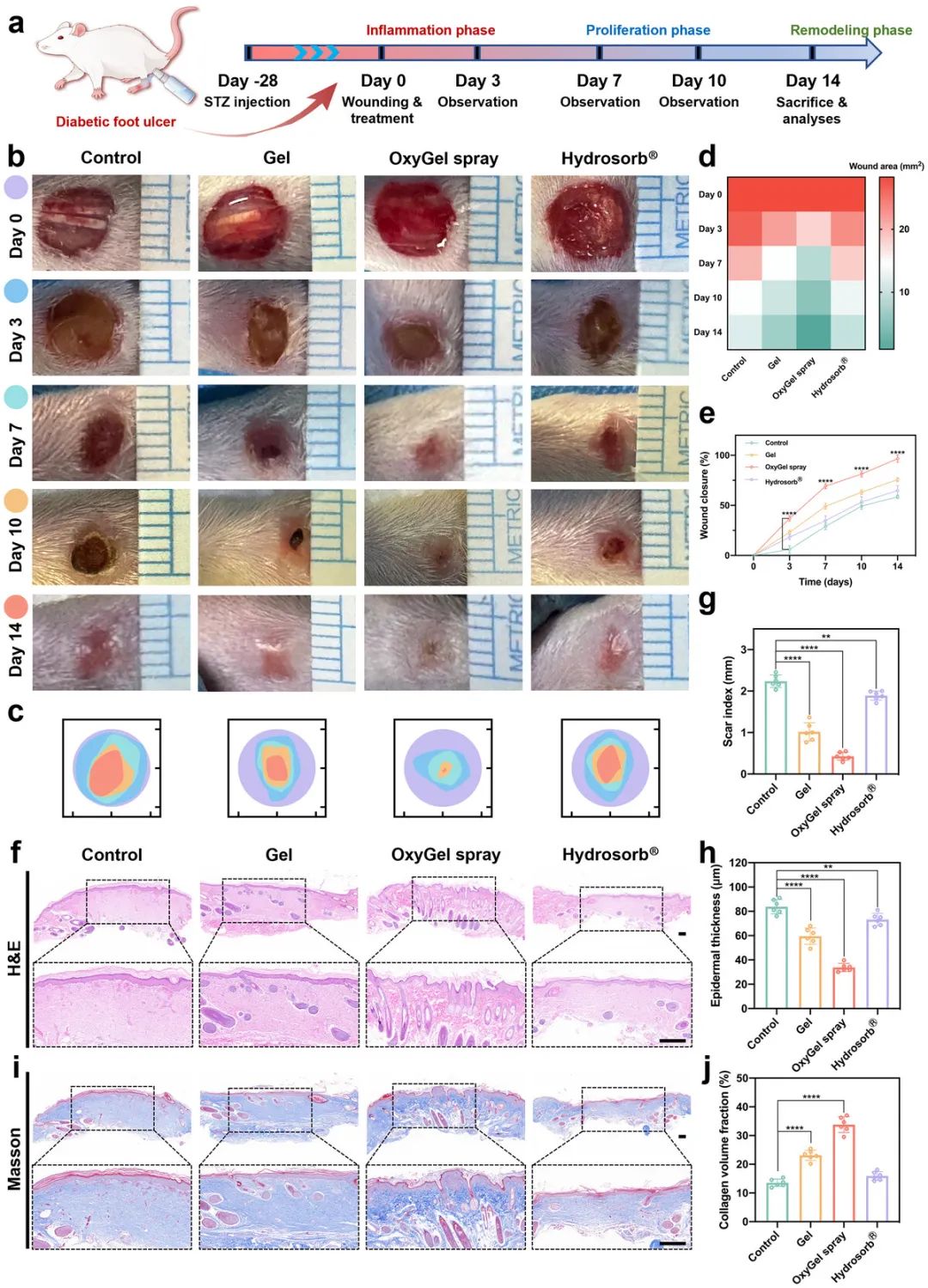
图6 OxyGel 喷雾可加速大鼠糖尿病足部溃疡伤口愈合。a) 体内足部溃疡伤口(直径 6 毫米)愈合研究的实验时间表,单次给药和评估超过 14 天。b) 不同治疗方法后足部溃疡伤口愈合过程的代表性照片。c) 从第 0 天到第 14 天的伤口闭合痕迹。de) 伤口面积(mm 2)和伤口闭合率的定量分析(n = 6)。f) H&E 染色,g) 疤痕指数,和 h) 第 14 天足部溃疡伤口组织的表皮厚度(n = 6)。比例尺,300 µm。i) 第 14 天足部溃疡伤口组织的 Masson 染色和胶原体积分数(n = 6)。比例尺,300 µm
OxyGel在DFU伤口愈合的三个阶段中表现出良好效果。在炎症阶段期间,第7天DCFH-DA染色显示OxyGel显著清除ROS(图7a、b);第14天iNOS/Arg-1染色表明OxyGel促进巨噬细胞从M1向M2极化(图7a、c、d)。在增殖阶段,第14天CD31和α-SMA共染色显示OxyGel促进新生血管形成(图7a、e);Western blot显示OxyGel上调HIF-1α和VEGF蛋白水平;Ki67染色显示OxyGel促进细胞增殖(图7a、f)。最后在重塑阶段,第14天胶原蛋白染色显示OxyGel促进胶原蛋白I沉积,减少胶原蛋白III(图7a、g、h)。该团队还进行了安全性评估,14天内血液分析和主要器官H&E染色未发现OxyGel引起系统毒性或炎症反应。
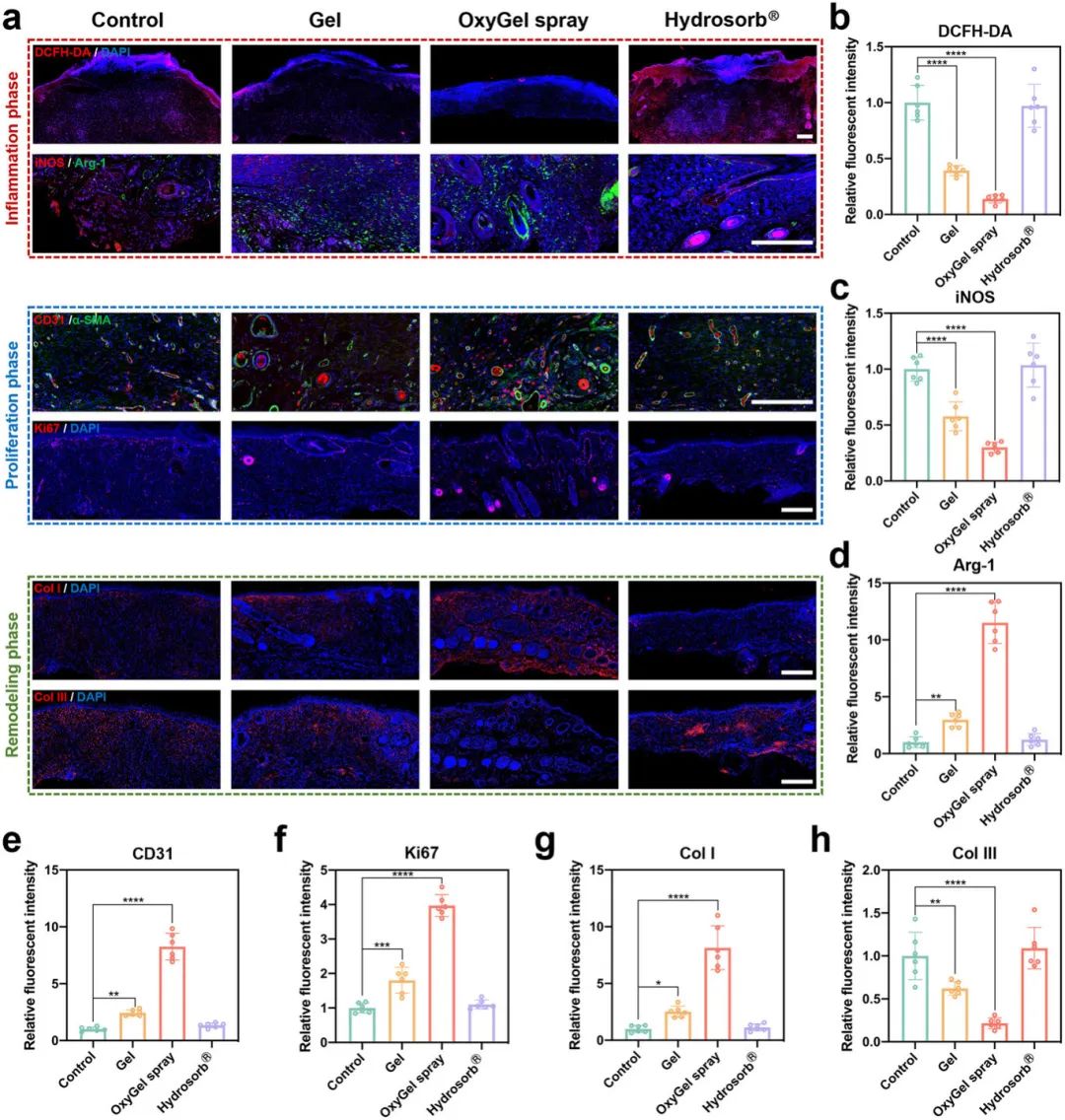
图7 用不同水凝胶治疗的糖尿病足溃疡伤口组织的免疫荧光染色。 a) 伤口组织 DCFH-DA、iNOS/Arg-1、CD31/α-SMA、Ki67、Col I 和 Col III 免疫荧光染色的代表性图像。比例尺,300 µm。b) DCFH-DA、c) iNOS、d)Arg-1、e) CD31、f) Ki67、g) Col I 和 h) Col III 免疫荧光染色的定量统计数据(n = 6)
(6)OxyGel喷雾促进与加速糖尿病足溃疡伤口愈合相关的信号通路的丰富
对OxyGel喷雾组和对照组大鼠伤口组织进行RNA测序。主成分分析(PCA)显示样本具有高重复性和相关性(图8a)。与对照组相比,OxyGel喷雾组有690个基因上调,521个基因下调,表明OxyGel通过清除过量ROS和持续供氧在调节DFU伤口修复中起重要作用(图8b-d)。基因本体(GO)分析显示,与免疫反应、细胞增殖、迁移、血管生成、细胞外基质(ECM)组织和胶原代谢过程相关的通路显著富集(图8e),表明OxyGel喷雾具有抗炎、促增殖和胶原重塑活性,支持其在DFU治疗中的潜力。此外,GO分析还显示细胞因子活性、表皮生长因子受体结合和胶原结合等分子功能,以及细胞外基质和黏着斑等细胞组分的富集(图8f、g)。京都基因与基因组百科全书(KEGG)分析揭示了11条与OxyGel喷雾促进伤口愈合相关的信号通路,包括TNF信号通路、PPAR信号通路等(图8h)。基因集富集分析(GSEA)显示,炎症反应和ROS代谢过程下调,而表皮细胞分化、表皮发育、角化和皮肤发育上调(图8i-n)。总体而言,OxyGel喷雾促进了与DFU伤口愈合相关的信号通路的富集。
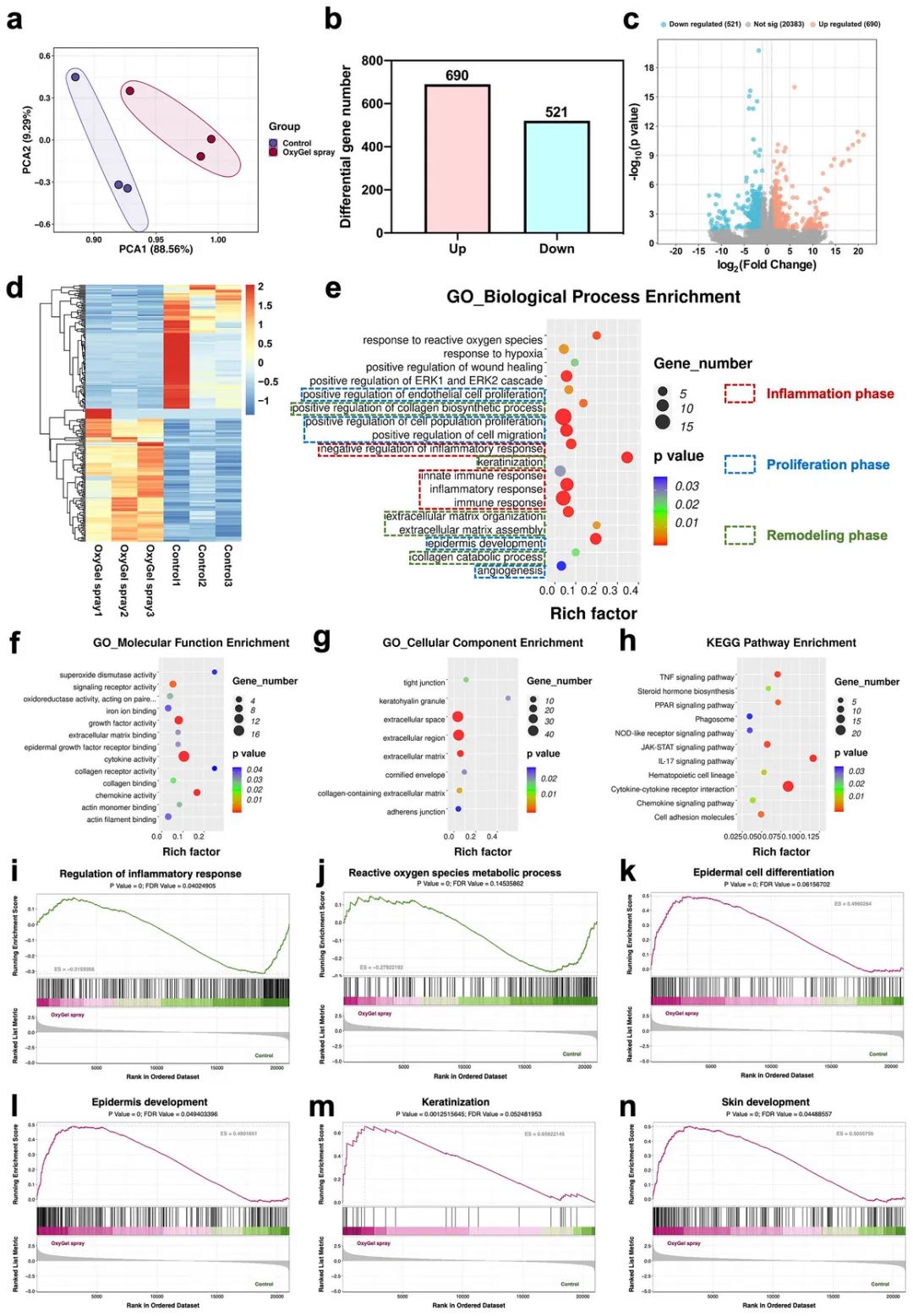
图8 糖尿病足溃疡伤口组织转录组分析。a)转录组数据的主成分分析(PCA)。b)显示上调(红色)和下调(蓝色)基因数量的直方图。c)差异表达基因的火山图。d)差异表达基因的热图。对OxyGel喷雾组差异表达基因的e)生物过程、f)分子功能和g)细胞成分进行基因本体论(GO)富集分析。h)OxyGel喷雾组差异表达基因的KEGG富集分析。对i)炎症反应的调节,j)活性氧代谢过程,k)表皮细胞分化,l)表皮发育,m)角化,和n)皮肤发育进行基因集富集分析(GSEA)
该研究开发了一种速效凝胶喷雾剂(OxyGel 喷雾剂),它整合了具有模拟 SOD/CAT 级联催化功能的纳米酶,以及一种动态交联超分子水凝胶喷雾剂,该喷雾剂具有优异的机械性能、自修复能力以及 pH 响应释放多功能纳米酶的能力,可用于糖尿病足溃疡 (DFU) 的靶向伤口治疗。 这种纳米酶增强的可喷涂水凝胶具有清除活性氧 (ROS) 和生成氧气 (O2 )的双重功能,不仅可以作为活性氧驱动的氧合器来重塑不利的炎症微环境,还可以保护细胞增殖、迁移和血管生成免受氧化损伤。值得注意的是,在 14 天的治疗期间,仅使用一次 OxyGel 喷雾剂即可显著加速糖尿病大鼠背部皮肤和 DFU 伤口的愈合,且无明显毒性。因此,这种创新且方便的水凝胶喷雾是治疗难治性糖尿病伤口以及与氧化应激和缺氧相关的其他疾病的一种有前途且安全的选择。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

