
光免疫疗法(Photoimmunotherapy)是一种新兴的癌症治疗手段,结合了特定免疫疗法与光动力疗法(PDT)或光热疗法(PTT)。其原理是利用光敏剂在肿瘤部位富集,经光照后产生活性氧(ROS)或热量,直接杀死癌细胞,同时释放肿瘤特异性抗原和细胞因子,触发抗肿瘤免疫反应,增强治疗效果。
该疗法在临床试验中展现出巨大潜力,具有选择性肿瘤靶向、微创性、复发风险低和副作用小等优点。然而,其临床应用面临以下挑战:(1)外部光源组织穿透能力有限,且可能对周围健康组织造成热损伤;(2)PDT/PTT触发的免疫反应较弱,因肿瘤微环境抑制免疫细胞浸润;(3)光敏剂大多疏水,难以有效传递和靶向肿瘤,且ROS寿命短、扩散范围有限,增加了光敏剂精确传递到肿瘤部位的难度。

针对上述问题,复旦大学仰大勇教授和天津大学姚池教授团队及合作者在DNA功能材料用于黑色素瘤光免疫治疗方面取得新进展,发展了能够在肿瘤部位特异性启动光动力单元以及核酸药物释放的智能DNA水凝胶,在无需激光照射条件下可实现肿瘤部位的按需光免疫治疗。研究人员设计了一种智能能量存储DNA水凝胶,通过滚环扩增(RCA)反应构建,整合了多种组件:PD-1抑制剂(PD-1 aptamer, Apt PD-1)、免疫佐剂(CpG ODN)、能量存储光动力模块(ES-PMSA)。该水凝胶能够响应多种肿瘤标志物,实现激光自由、按需激活的光免疫疗法,实现靶向药物释放,用于局部黑色素瘤的治疗。该文章于2025年6月4日以《Smart Energy-Storing DNA Hydrogel for On-Demand Laser-Free Photoimmunotherapy of Melanoma》为题发表于《Journal of the American Chemical Society》上(DOI:10.1021/jacs.5c06905)。
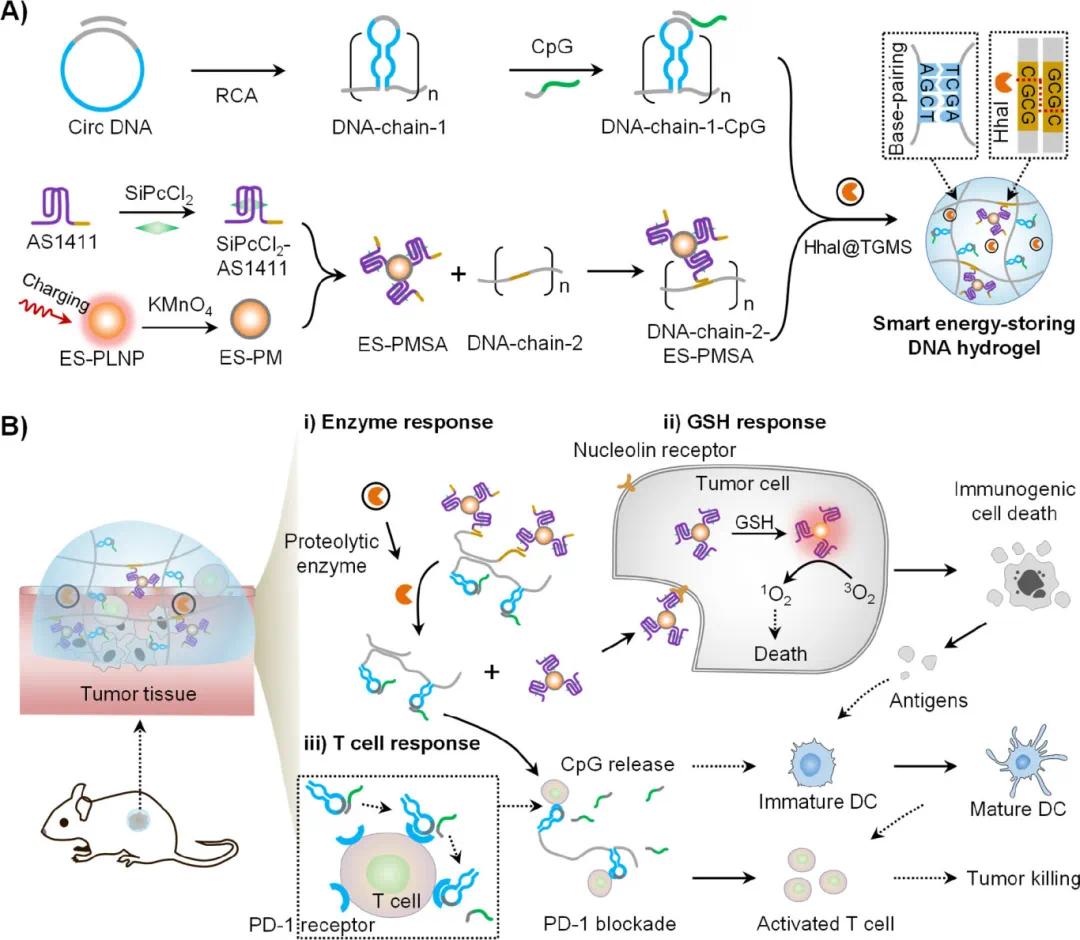
研究示意图
(1)智能能量储存DNA水凝胶的制备与表征
本研究通过滚环扩增(RCA)策略构建了两条部分互补的DNA链,形成智能储能DNA水凝胶网络。非变性PAGE证实线性模板成功环化为circDNA,DNA链1和链2因高分子量在PAGE中被阻滞,表明构建成功(图1A)。圆二色性(CD)光谱中276 nm处的重叠峰表明Apt PD-1成功引入CS-template-1(图1B)。在K⁺存在下,AS1411序列形成G四链体结构并与SiPcCl2组装成复合物,CD谱峰蓝移验证了该复合物的构建(图1C)。ES-PM纳米颗粒通过以下步骤合成:紫外线照射胺修饰的PLNPs生成储能PLNPs(ES-PLNPs),再用MnO2壳包封得到ES-PM纳米颗粒。ES-PM纳米颗粒与SiPcCl2-AS1411通过静电相互作用结合,形成ES-PMSA纳米复合物(图1D)。zeta电位测量显示ES-PMSA的zeta电压为-36.4 mV,表明其成功形成(图1E)。动态光散射测量显示ES-PMSA的流体动力学直径为92.5 nm(图1F)。扫描电子显微镜(SEM)显示水凝胶具有均匀多孔的网状结构,有利于药物装载(图1G)。流变学分析表明,储能模量(G')高于损耗模量(G''),水凝胶具有类固体性质和高度柔软性,赋予其良好的注射性和组织贴合能力(图1H)。X射线光电子能谱(XPS)证明水凝胶中成功嵌入了ES-PMSA和SiPcCl₂(图1I)。
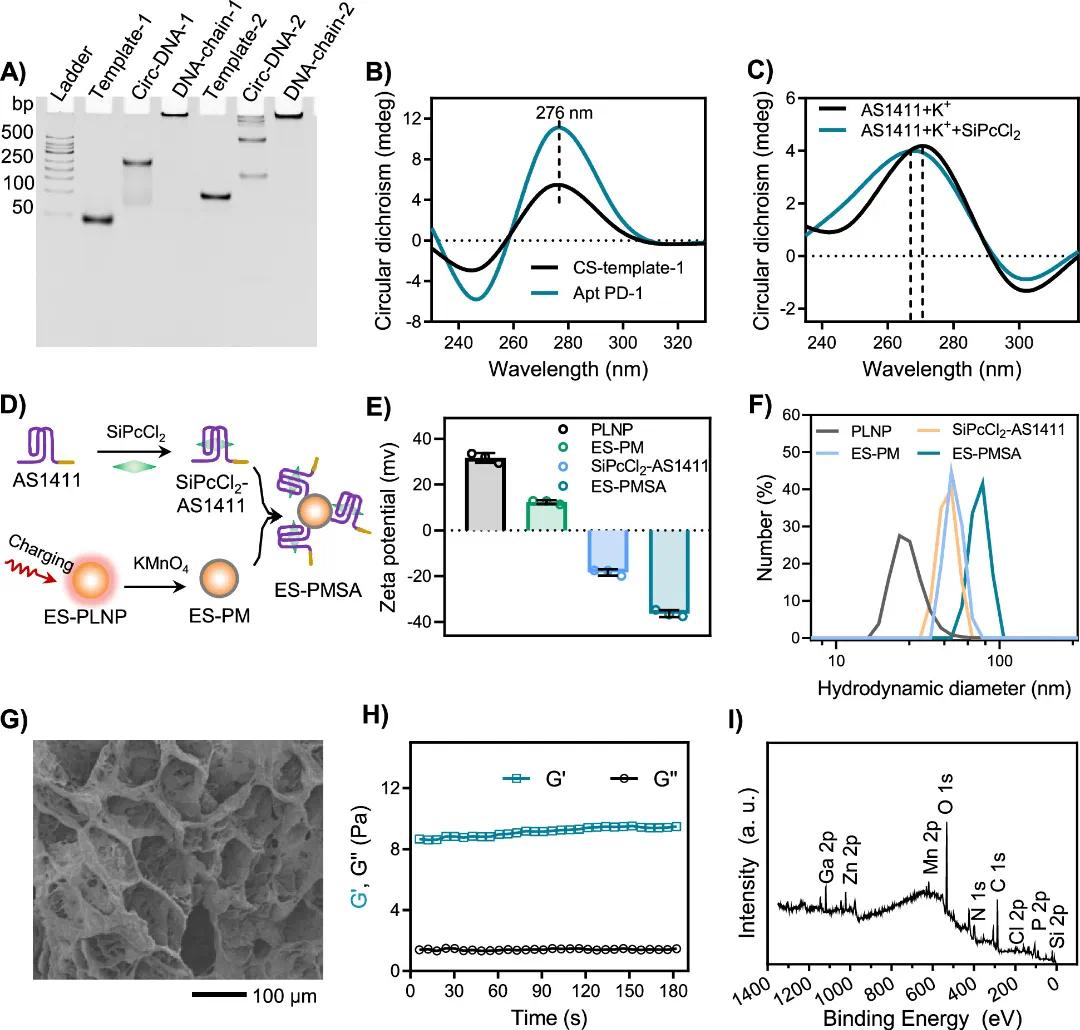
图1 智能储能DNA水凝胶的制备及表征。(A)不同的天然聚丙烯酰胺凝胶电泳(B)的圆二色性光谱。(C)AS1411+K+和AS1411+K++SiPcCl2的圆二色性光谱。(D) ES-PMSA分子结构示意图。(E)不同样品的Zeta电位。(F)不同样品的DLS。(G)水凝胶的SEM图像。(H)水凝胶流变测试。(I)X射线光电子能谱
(2)智能储能DNA水凝胶多重刺激响应的研究
为实现按需释放,水凝胶整合了多重肿瘤微环境响应模块。首先,通过含有Apt PD-1序列的CS-template-1与T细胞特异性识别,触发CpG ODN的释放,PAGE检测验证了T细胞介导的释放行为(图2A)。进一步地,引入携带HhaI限制性内切酶的TGMS纳米颗粒,通过蛋白酶触发HhaI释放,该酶可特异切割DNA链2中的回文序列(GCGC),实现ES-PMSA的精准释放。凝胶电泳显示在蛋白酶存在下出现裂解带,证实该酶响应机制有效(图2B)。采用1%的凝胶分离法,研究蛋白酶溶液中酶的时间依赖性断裂。蛋白酶组中出现了裂解带,而没有蛋白酶组的孔中保留带,这表明肿瘤部位的酶能够触发HhaI释放(图2C)。通过释放的Mn2+有效地催化过氧化氢(H2O2)转化为氧气(O2),为PDC提供了增强的O2供应。ES-PMA(不含SiPcCl2)溶液在日光和紫外光下表现出深棕色分散体。在GH存在的情况下,在紫外线照射下观察到深棕色溶液变成白色和红色荧光,表明持续发光的GH响应性恢复(图2D、E)。此外,ES-PMSA具GSH响应性。在还原性条件下(模拟肿瘤内GSH浓度),ES-PMA溶液发生光学性质变化,发光恢复随GSH浓度升高而增强,表现出良好的GSH响应特性。(图2F)。荧光谱显示ES-PLNP的发射峰与SiPcCl2的吸收峰高度重叠,有利于能量转移和ROS生成。使用SOSG探针检测发现,ES-PMSA可在无外源光照下激活产生1O2,明显优于无储能模块对照组,表明其具自发激活光动力功能。
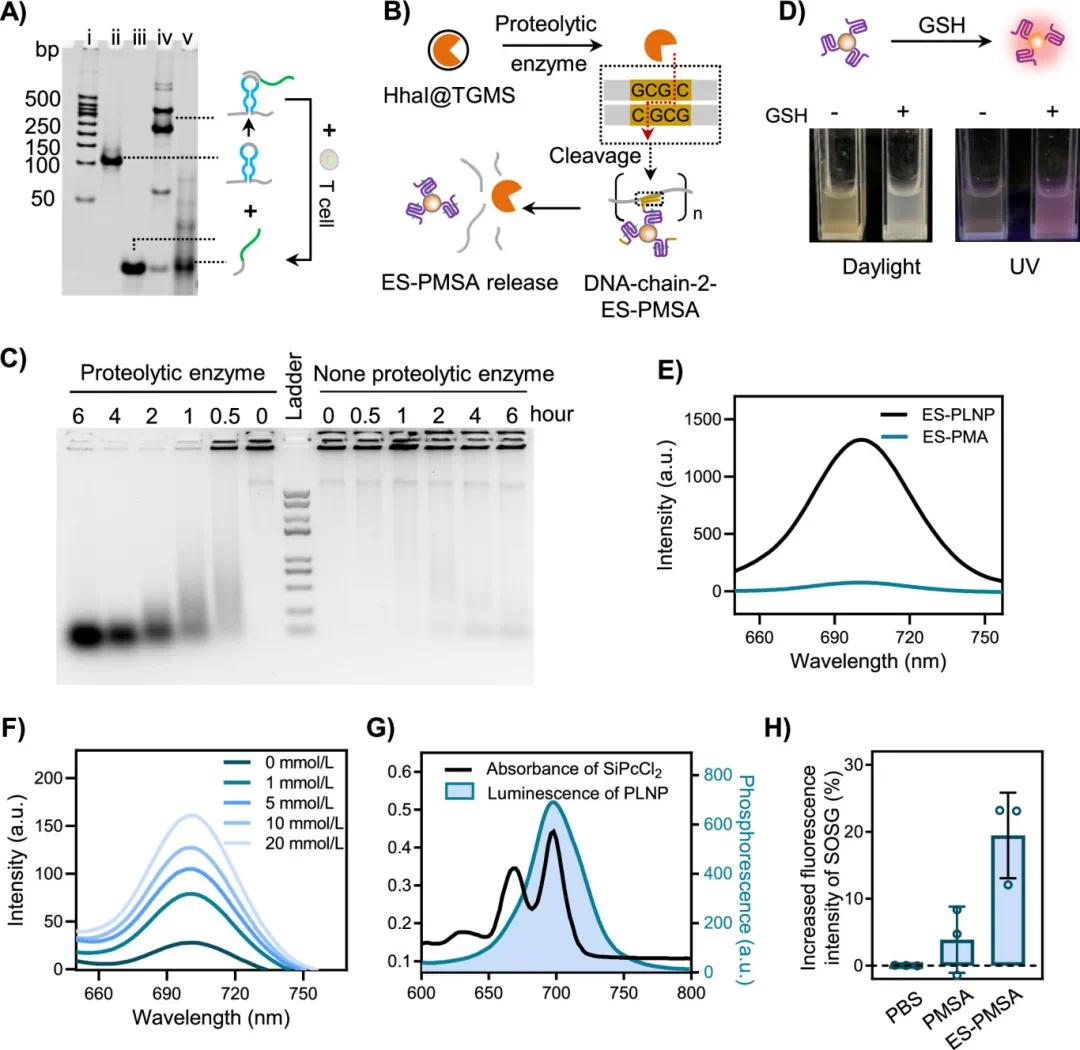
图2 智能储能DNA水凝胶的多重刺激响应性。(A)PAGE验证CpG加载及T细胞诱导释放。(B) HhaI @ TGMS纳米颗粒响应释放ES-PMSA的示意图。(C)PAGE验证蛋白酶介导DNA链切割以释放光动力模块。(D) GSH响应下5G溶液在日光和UV照射下的照片。(E) ES-PMA和ES-PLNP的荧光光谱。(F)不同GSH浓度恢复ES-PMA的荧光光谱。(G) PLNP溶液和SiPcCl2吸收光谱。(H) SOSG检测ES-PMSA的ROS生成
(3)对B16癌细胞无激光光动力疗法性能研究
光动力模块(ES-PMSA)通过核苷介导的细胞吸收被B16细胞内化,肿瘤内GSH触发活性氧(ROS)产生,促进无激光光动力疗法(PDT)效果(图3A)。流式细胞术分析显示,B16细胞与Cy5标记的ES-PMSA孵育4小时后荧光强度显著增加,而Smooth细胞(ASMC)、DC和T细胞荧光变化较小,表明ES-PMSA通过受体介导的内吞作用被B16细胞吸收(图3B)。荧光强度分析表明,ES-PMSA和ES-PMSA-G+H组显著增加绿色荧光,而PMA、ES-PMA或PMSA组未观察到显著荧光,说明ES-PMSA有效诱导B16细胞中ROS产生(图3C)。CCK-8试验结果显示,ES-PMSA和ES-PMSA-G-H组细胞存活率显著降低,表明无激光PDT取得良好治疗效果(图3D)。通过ATP检测试剂盒检测B16细胞ATP分泌水平,ES-PMSA和ES-PMSA-G-H组ATP分泌显著高于其他组(图3E)。免疫荧光染色显示,ES-PMSA和ES-PMSA-G-H组细胞表面CRT暴露显著增加(图3F、G),而HMGB1绿色荧光显著减少,表明无激光PDT有效促进HMGB1释放(图3H、I)。这些结果表明,无激光PDT可诱导强烈的免疫原性细胞死亡(ICD)反应,促进后续免疫细胞激活。
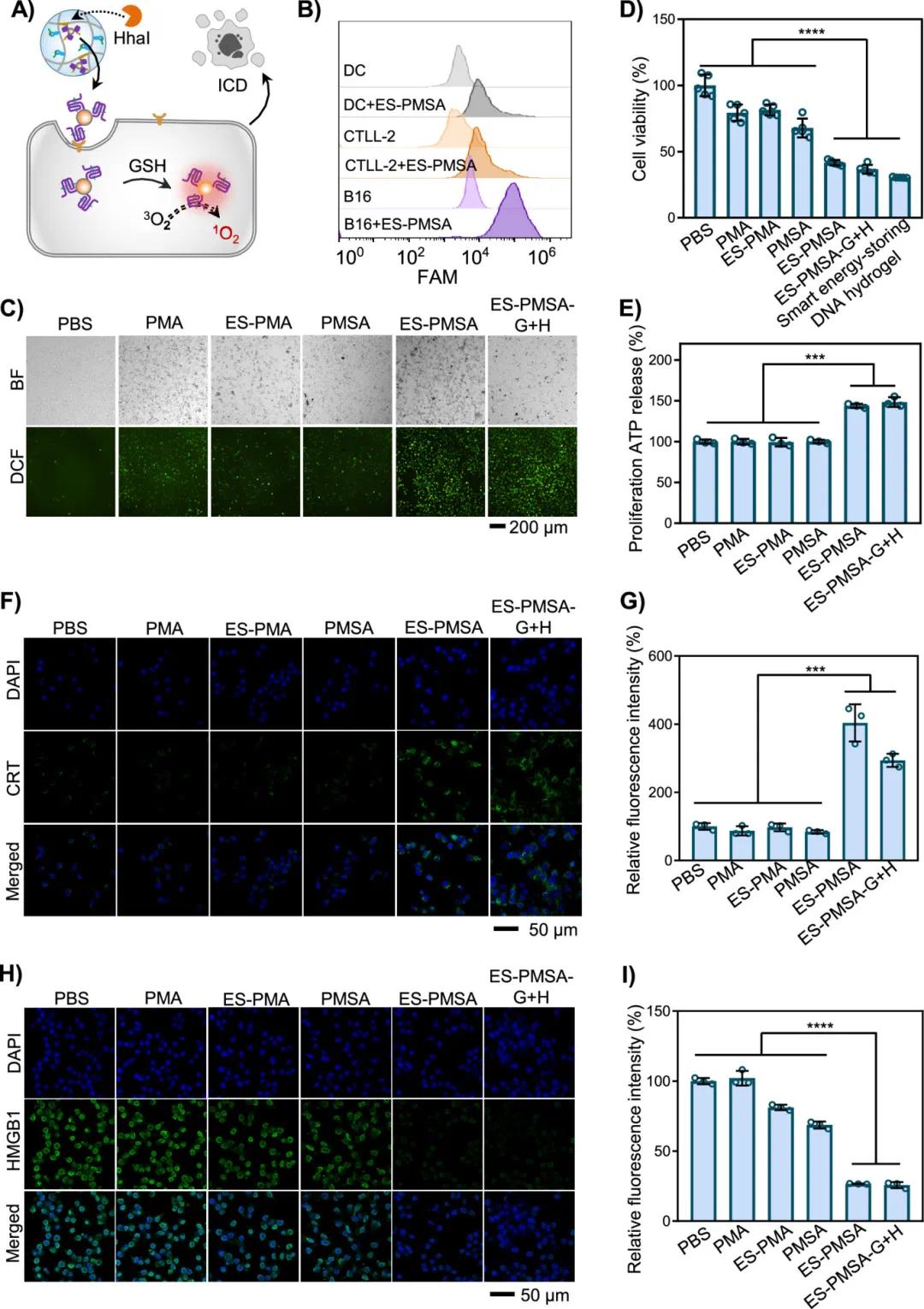
图3 无激光光动力治疗(PDT)诱导B16癌细胞免疫原性细胞死亡。(A) GSH刺激下无激光ROS生成用于肿瘤杀伤的示意图。(B)流式细胞术分析ES-PMSA内化到B16细胞,DC和CTLL-2作为对照。(C)不同组分在8小时对B16细胞中的ROS生成的荧光显微镜和ES-PMSA-G图像。(D)CCK-8测定不同组分对B16细胞存活率。(E)不同处理后细胞外 ATP的定量。(F)不同组分处理后,与钙网蛋白 (CRT) 荧光探针 (绿色) 和DAPI (蓝色) 孵育的B16细胞的CLSM图像。(G)CRT的相应相对荧光强度。(H)不同组分处理后,B16细胞与HMGB1蛋白荧光探针 (HMGB1,绿色) 和DAPI (蓝色) 孵育的CLSM图像。(I)HMGB1的相对荧光强度
(4)CpG释放对T细胞应答及树突状细胞(DC)成熟的影响研究
CpG ODN是含有未甲基化CpG基序的短DNA序列,可激活DC增强抗肿瘤免疫反应。智能储能DNA水凝胶与T细胞孵育时,通过Apt PD-1与T细胞的特异性识别结合释放CBP,进而刺激DC成熟(图4A)。荧光实验显示,红色荧光标记的Apt PD-1与绿色荧光标记的T细胞共定位,产生强烈黄色荧光信号,而阴性对照组(NC)重叠极小,Apt PD-1组Pearson系数显著高于NC组,表明Apt PD-1特异性识别T细胞并成功释放PGP ODN(图4B)。绿色荧光染色的DNA水凝胶与红色荧光标记的T细胞孵育结果显示,含有Apt PD-1序列的水凝胶荧光强度显著高于不含Apt PD-1的NC组,验证了DNA水凝胶与T细胞的特异性识别(图4C)。酶联免疫吸附试验(ISA)检测发现,Gel-ATG +T组上清中免疫细胞因子浓度最高,肿瘤坏死因子-α为2000.7 μg/mL,IL-6为2450.2 μg /mL,而缺乏CBP释放的组细胞因子水平显著降低(图4D、E),表明T细胞可触发DNA水凝胶释放ATG ODN,刺激BMDCs分泌免疫细胞因子。流式细胞术检测BPDC表面CD80和CD86蛋白表达水平,Gel-ATG +T组CD80蛋白表达量从15.2%增加到53.6%,CD86蛋白表达量从14.9%增加到55.8%,而未释放ATG的组变化不足20.0%(图4F、G),表明释放的ATG ODN激活了DC。总体而言,T细胞触发释放的CBP ODN可促进不成熟DC成熟,激活T细胞以清除肿瘤细胞。
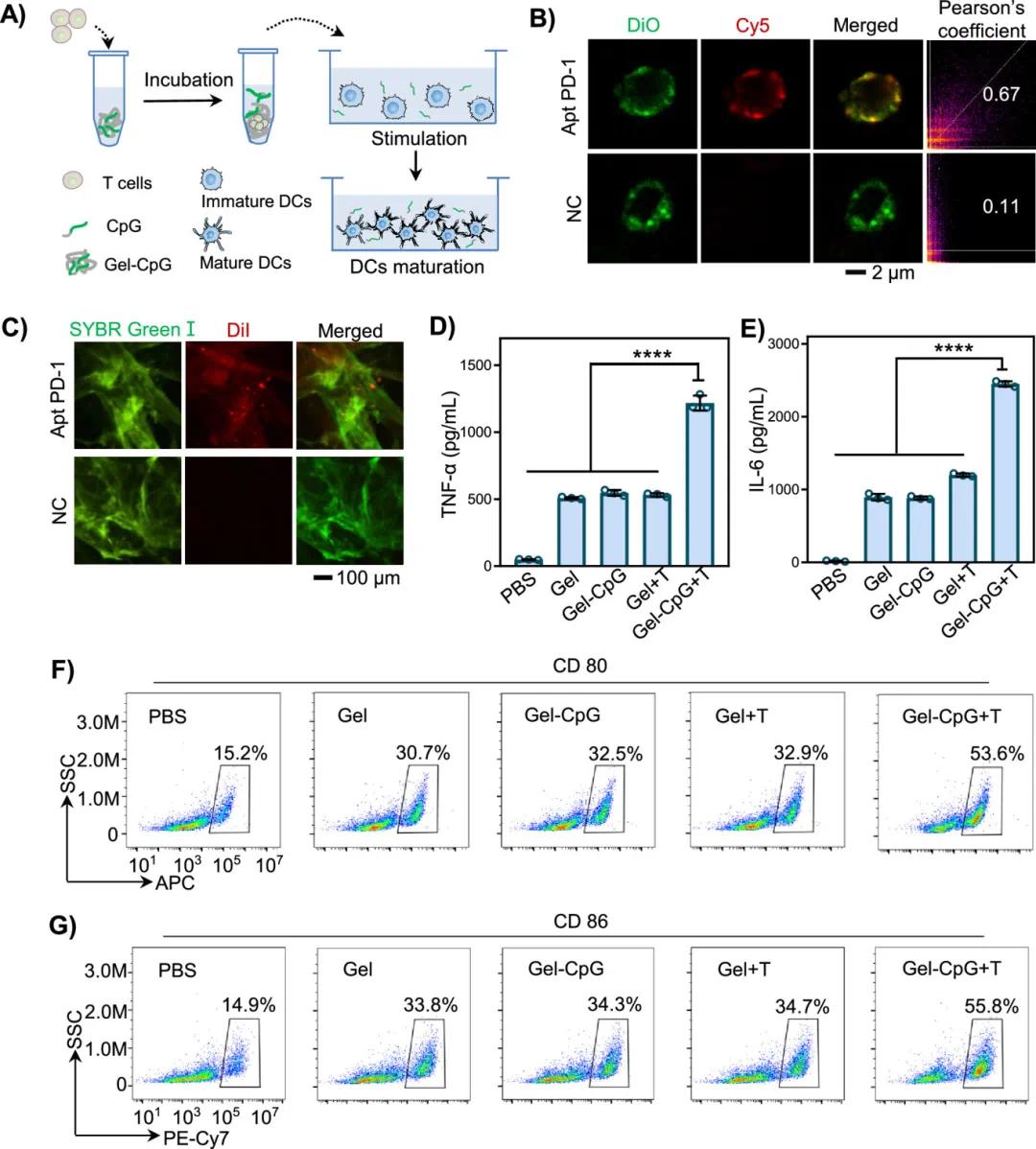
图4 T细胞反应性释放CpG促进DC体外成熟。(A)T细胞触发的CpG释放以促进用于T细胞活化的DC成熟的示意图。(B)用Cy5-labeled Apt PD-1and Cy5-labeled NC孵育的DiO染色的T细胞的代表性荧光显微镜图像 (非相关序列)。(C)具有和不具有Apt PD-1的DNA网络捕获的T细胞的代表性荧光显微镜图像。(D,E)测试不同材料BMDC细胞上清液TNF-α和 IL-6的分泌水平。(F,G)流式细胞术测定DC (BMDCs) 上CD80和CD86表达水平及评估DC成熟度
(5)TAA和ATG对B16细胞的免疫治疗性能
智能储能DNA水凝胶通过诱导PDC效应释放TAA,并编码Apt PD-1富集肿瘤部位的T细胞,同时充当免疫检查点阻滞剂。T细胞从Apt PD-1中取代ATG ODN并释放CBP ODN以促进DC成熟,增强T细胞抗肿瘤能力(图5A)。实验中,将TAA组(B16细胞来源的TAA)和CPD T组(T细胞触发释放的CPD ODN)与BMDCs共孵育,检测BMDCs表面CD80和CD86表达以及上清中肿瘤坏死因子-α和IL-6浓度。流式细胞仪检测结果显示,TAA+CPGT组(同时添加TAA和CPD ODN)的CD80和CD86表达率最高,分别为48.0%和46.9%,其他组依次为PBS组、TAA组、CPGT组(图5B、C)。TAA+CPGT组的肿瘤坏死因子-α和IL-6水平显著高于其他组(图5D、E),表明TAA和ATG ODN可协同促进DC成熟。通过DDD-8试验检测成熟BMDCs激活T细胞的能力,TAA+CPGT组的T细胞存活率最高,为462.9%,显著高于单一抗原组(图5F),说明TAA与ATG ODN联合可有效调节免疫微环境。此外,通过混合细胞实验(DC、T细胞和B16细胞)评估智能储能DNA水凝胶的协同抗肿瘤效果。实验中,不同组的DNA凝胶与细胞共孵育后,荧光显微镜记录红色荧光B16细胞(图5G)。结果显示,含有Apt PD-1、ATG和ES-PMSA的DNA凝胶(第VII组)对B16细胞的杀伤效果最强,红色荧光强度最弱,表明无激光光动力疗法(ES-PMSA)、免疫佐剂(ATG)和免疫检查点抑制剂(Apt PD-1)的联合治疗具有显著的协同抗肿瘤作用。
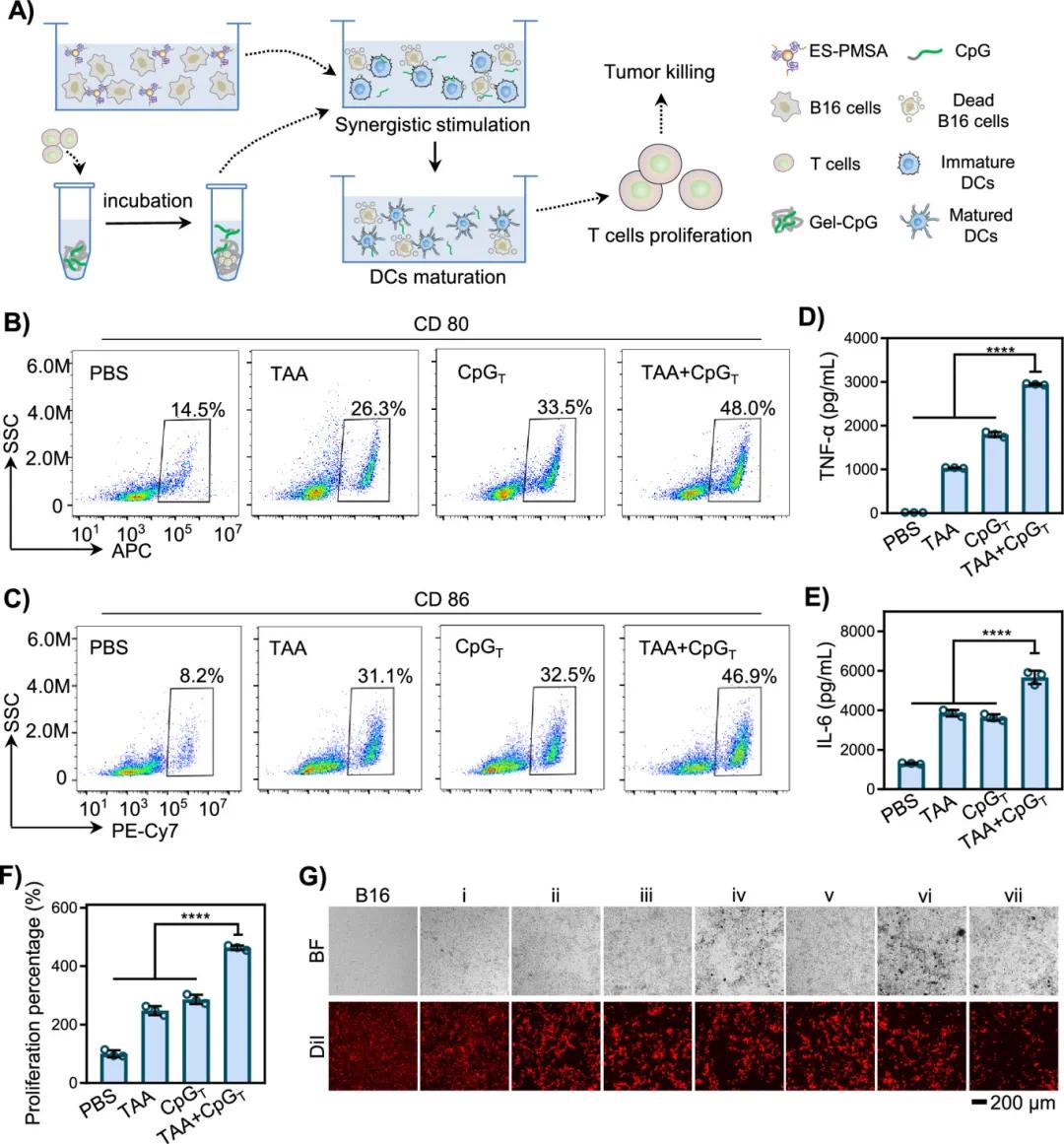
图5 TAAs和CpG对B16细胞的免疫治疗性能。(A) TAAs和CpG协同免疫治疗示意图。(B,C)流式细胞术分析BMDCs上CD80和CD86的表达。(D,E) ELISA测定不同处理的BMDCs培养上清中TNF-α和IL-6的浓度。(F) CCK-8法评估BMDCs分泌因子处理的T细胞增殖率。(G)共培养T细胞和DCs与B16细胞的荧光显微镜图像
(6)智能储能DNA水凝胶在体内治疗的评价
建立了原位黑色素瘤小鼠模型,以研究智能储能DNA水凝胶的体内治疗性能。35只荷B16肿瘤小鼠随机分为7组,每3天通过瘤内注射不同组分的药物(图6A)。结果显示,v-VII组肿瘤生长呈减速趋势,优于iii和iv组的单药治疗(图6B)。随后提取肿瘤并拍照称重,肿瘤照片显示智能储能DNA水凝胶对肿瘤生长有显著抑制作用(图6C)。肿瘤重量分析表明,组ii、iii、iv、v、vi和VII的肿瘤抑制率分别为4.0%、18.3%、33.6%、49.4%、53.8%和73.3%(图6D)。与对照组(i)相比,含有Apt PD-1、ATG和ES-PMSA的DNA凝胶(VII组)显示出最强的肿瘤抑制效果。含有ES-PMSA的DNA凝胶(iv组)也表现出肿瘤抑制作用,证明ES-PMSA从DNA水凝胶中释放并实现了无激光光动力疗法。与iv组相比,含有Apt PD-1、ATG和ES-PMSA的DNA凝胶(vi组)进一步减少了肿瘤,表明释放的ATG ODN、TAA和Apt PD-1可有效增强免疫治疗。
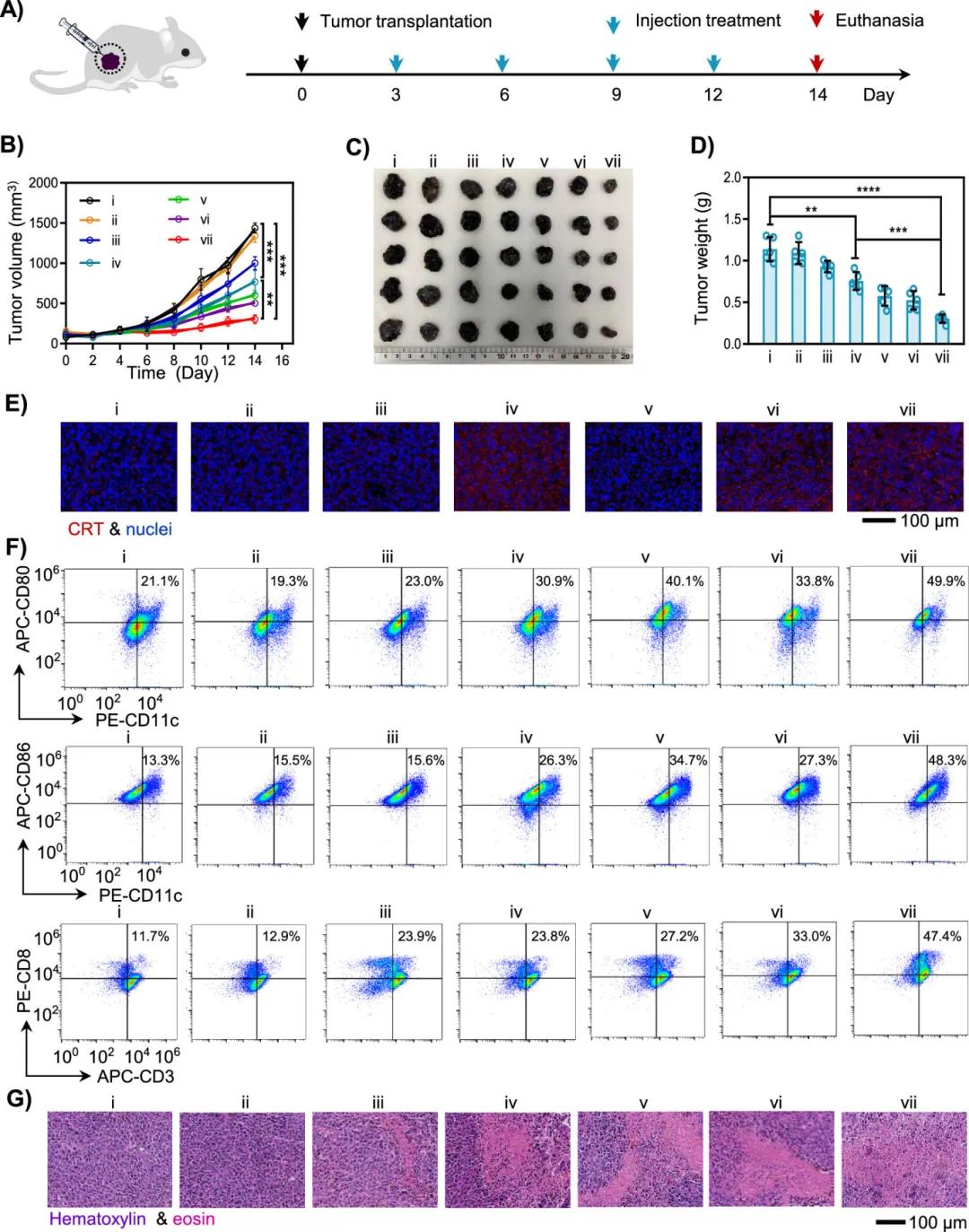
图6 智能储能DNA水凝胶在原位黑色素瘤小鼠模型中的抗肿瘤性能。(A)建立和治疗B16黑色素瘤小鼠模型的示意图。(B)不同组中的平均肿瘤生长概况。(C)切除肿瘤的图像。(D)不同组中平均肿瘤重量的统计。(E) 用Cy5和DAPI分别染色的肿瘤切片的CRT (红色) 和细胞核 (蓝色) 的免疫荧光图像。(F)流式细胞术测定提取的肿瘤组织中CD80、CD86和CD8的分泌水平。 (G)不同组的H & E染色的肿瘤
该研究开发了一种智能储能DNA水凝胶通过响应多种肿瘤标志物,显著提升了黑色素瘤光免疫治疗的精准性。该水凝胶整合了CpG ODN、Apt PD-1以及由持久发光纳米颗粒、AS1411核酸适配体和光敏剂组成的光动力模块。在肿瘤部位,水凝胶响应蛋白酶裂解并释放光动力模块,随后在GSH作用下激活PDT,生成ROS促进肿瘤抗原释放。PolyApt PD-1阻断PD-1通路并释放CpG ODN激活免疫细胞,增强T细胞介导的肿瘤清除。在原位黑色素瘤小鼠模型中,该策略实现73.3%的肿瘤抑制率,优于单独PDT(49.4%)。 与传统光免疫疗法不同,该系统利用储能型纳米颗粒实现无激光、按需激活,精准治疗并减少非靶向损伤。此外,该系统可选择性靶向肿瘤细胞,释放免疫治疗剂,引发强烈免疫反应,并通过核酸适配体和内切酶响应元件实现时空精准控制。该平台还可与T细胞接合剂或细胞因子疗法联合,增强抗肿瘤效果,并通过序贯释放不同免疫激动剂适应肿瘤进展阶段,成为下一代光免疫治疗的多功能平台。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

