
机械力(Mechanical force)持续作用于人体,无论是外部施加还是内部产生的力,均能触发无菌性炎症(sterile inflammation),参与多种生理和病理过程,如骨折、关节损伤、多器官纤维化、呼吸机相关性肺损伤(VILI)、椎间盘退变以及正畸牙齿移动(OTM)。无菌性炎症的及时消退对于防止不必要的组织损伤和促进炎症后组织完整性恢复至关重要。这一过程涉及一系列协调事件,其中,巨噬细胞通过胞葬作用(efferocytosis)及时清除凋亡细胞,对炎症的消退和组织稳态的维持尤为关键。尽管已有证据表明,在机械力作用的微环境中存在显著的细胞凋亡,但机械力对巨噬细胞胞葬作用的影响尚未明确,其调控机制仍有待深入探索。
本研究结合生物信息学和代谢组学分析,揭示了机械力在巨噬细胞中引发的代谢级联反应,即精氨酸代谢紊乱、TCA循环受限和线粒体功能障碍,这些变化进一步导致胞葬作用受损和炎症加剧。同时,研究人员发现提高巨噬细胞内L-精氨酸水平可缓解这一危机,这提示开发靶向递送L-精氨酸的药物系统可能通过恢复能量代谢来改善机械微环境中的胞葬作用。

针对上述问题,重庆医科大学口腔医学院宋锦璘、胡赟团队开发一种基于微针(microneedles, MNs)的药物递送平台(MSN-LA@MNs),搭载一氧化氮(NO)驱动的纳米马达,用于L-精氨酸的精准靶向递送。该系统巧妙地利用了机械力作用下的巨噬细胞和组织中iNOS表达上调这一天然优势,通过 iNOS 催化L-精氨酸生成 NO,为纳米颗粒提供自主推进力。此外,微针的透皮给药技术还具有操作简便、无痛、微创等优势。在力诱导的大鼠OTM模型中,证实MSN-LA@MNs能增强巨噬细胞胞葬作用,并在iNOS的引导下动态调节无菌性炎症水平,从而促进OTM进程,为调控OTM等力学生物学过程提供了纳米马达介导的代谢靶向策略。该文章于2025年3月3日以《Microneedles Loaded with Nitric-Oxide Driven Nanomotors Improve Force-Induced Efferocytosis Impairment and Sterile Inflammation by Revitalizing Macrophage Energy Metabolism》为题发表于《ACS NANO》(DOI:10.1021/acsnano.5c01877。
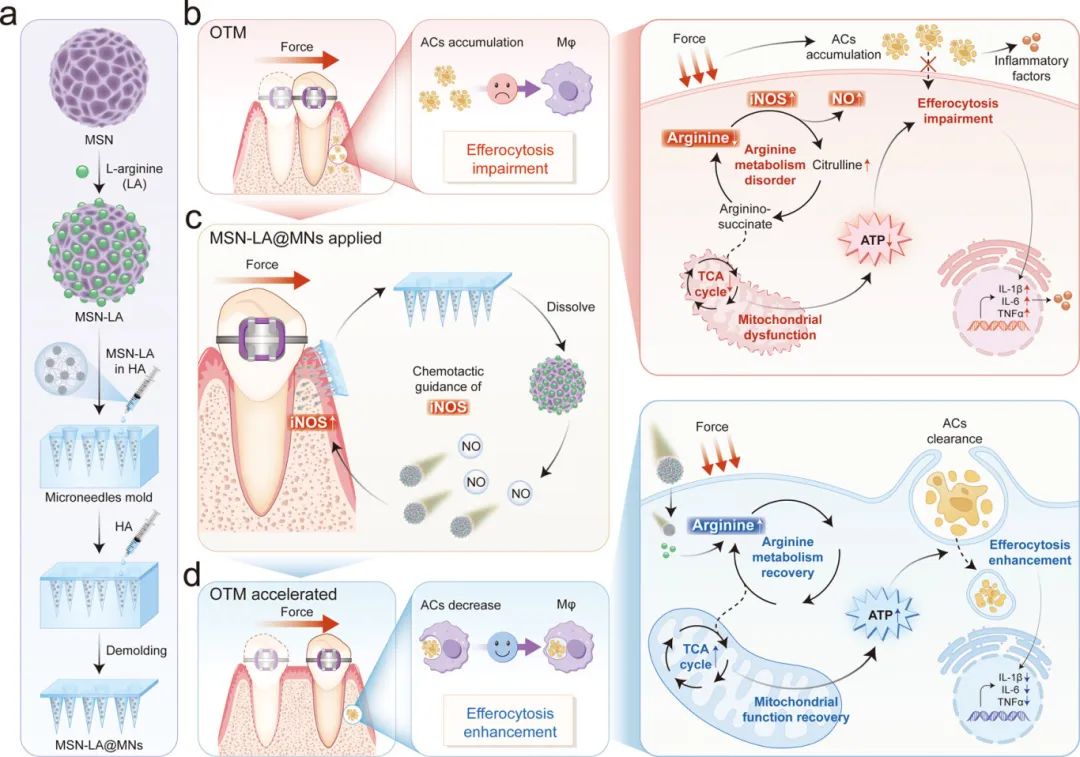
研究示意图.(a)加载有一氧化氮驱动的纳米马达的微针的基本设计的示意图。(b)机械力通过精氨酸代谢、TCA循环和线粒体功能的代谢级联损伤破坏巨噬细胞胞吐作用并引发无菌炎症的机制。(c)MSN-LA@ MN在OTM中的应用和药物递送机制。(d)MSN-LA@MNs如何通过恢复巨噬细胞能量代谢从而促进OTM来改善力诱导的胞吐功能受损和无菌性炎症
(1)机械力损害巨噬细胞胞葬作用并激活无菌性炎症
研究人员对RNA-seq数据集GSE210827进行分析,发现加载组有265个基因下调、374个上调(图1b),且凋亡和炎症免疫通路显著激活(图1c)。大鼠OTM模型中,机械力加载的牙周组织TUNEL阳性细胞增多,与CD68阳性细胞共定位减少(图1e),且IL-1β阳性表达升高(图1f)。体外细胞压缩力加载模型显示,机械力抑制巨噬细胞胞葬作用(图1h,i),且促炎细胞因子显著上调,胞葬作用增强剂可逆转这一现象(图1j,k)。这些结果表明,机械力可能通过破坏巨噬细胞胞葬作用增强炎症反应。
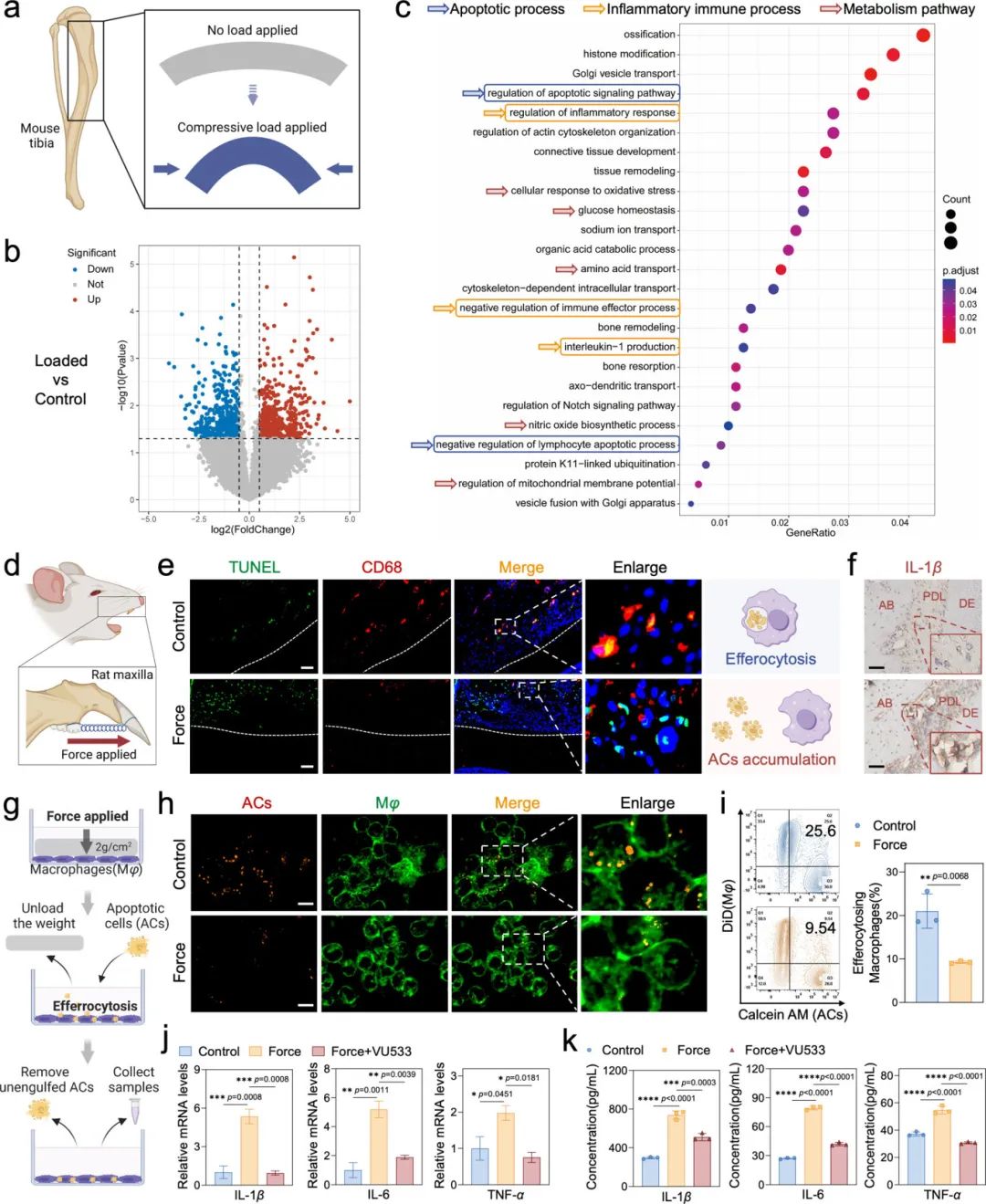
图1 机械力损伤巨噬细胞胞葬作用并激活无菌性炎症。(a)小鼠胫骨施加压缩力的示意图;(b)火山图展示GSE210827数据集中的基因表达谱;(c)前25条基因本体(GO)富集分析通路;(d)大鼠正畸牙齿移动(OTM)模型构建示意图;(e)大鼠牙周组织的TUNEL和CD68双重荧光染色(比例尺=50μm);(f)大鼠牙周组织中IL-1β的免疫组化染色(DE:牙本质,PDL:牙周韧带,AB:牙槽骨,比例尺=50μm);(g)力学模型和胞葬作用模型示意图;(h)荧光图像显示巨噬细胞胞葬作用(橙色荧光表示用DAPI标记的凋亡细胞,绿色荧光表示用CellMask标记的巨噬细胞膜,比例尺=10μm);(i)流式细胞术分析和定量描述巨噬细胞胞葬作用(n=3,凋亡细胞用Calcein AM标记,巨噬细胞用DiD标记);(j)qPCR分析炎症因子IL-1β、IL-6、TNF-α(n=3,VU533是一种特异性胞葬作用增强剂);(k)ELISA分析炎症因子IL-1β、IL-6、TNF-α(n=3)
(2)机械力扰乱巨噬细胞精氨酸代谢并引发限制TCA循环的级联反应
生物信息学分析发现,加载肢体骨样本中葡萄糖、氨基酸和细胞呼吸等代谢通路显著富集(图1c),且与凋亡和炎症免疫通路密切相关,其中一氧化氮生物合成过程关联最为显著,由精氨酸代谢调控(图2a)。Q300代谢组学分析显示,机械力诱导巨噬细胞中88种代谢物显著变化,精氨酸和脯氨酸代谢以及TCA循环通路显著富集(图2b)。差异代谢物热图分析支持这一发现(图2c,d),精氨酸代谢通路中精氨酸和天冬氨酸减少,瓜氨酸上调,鸟氨酸和脯氨酸变化不明显(图2e),TCA循环相关代谢物表达受抑制(图2f)。机械力下调Arg1、上调iNOS,增加NO释放,同时下调ASS1和ASL(图2g-i),导致精氨酸耗竭(图2j)。图2k总结发现,精氨酸代谢与TCA循环存在交叉点,机械力抑制精氨酸生物合成导致富马酸减少,引发限制TCA循环的级联反应,最终导致巨噬细胞能量代谢异常。
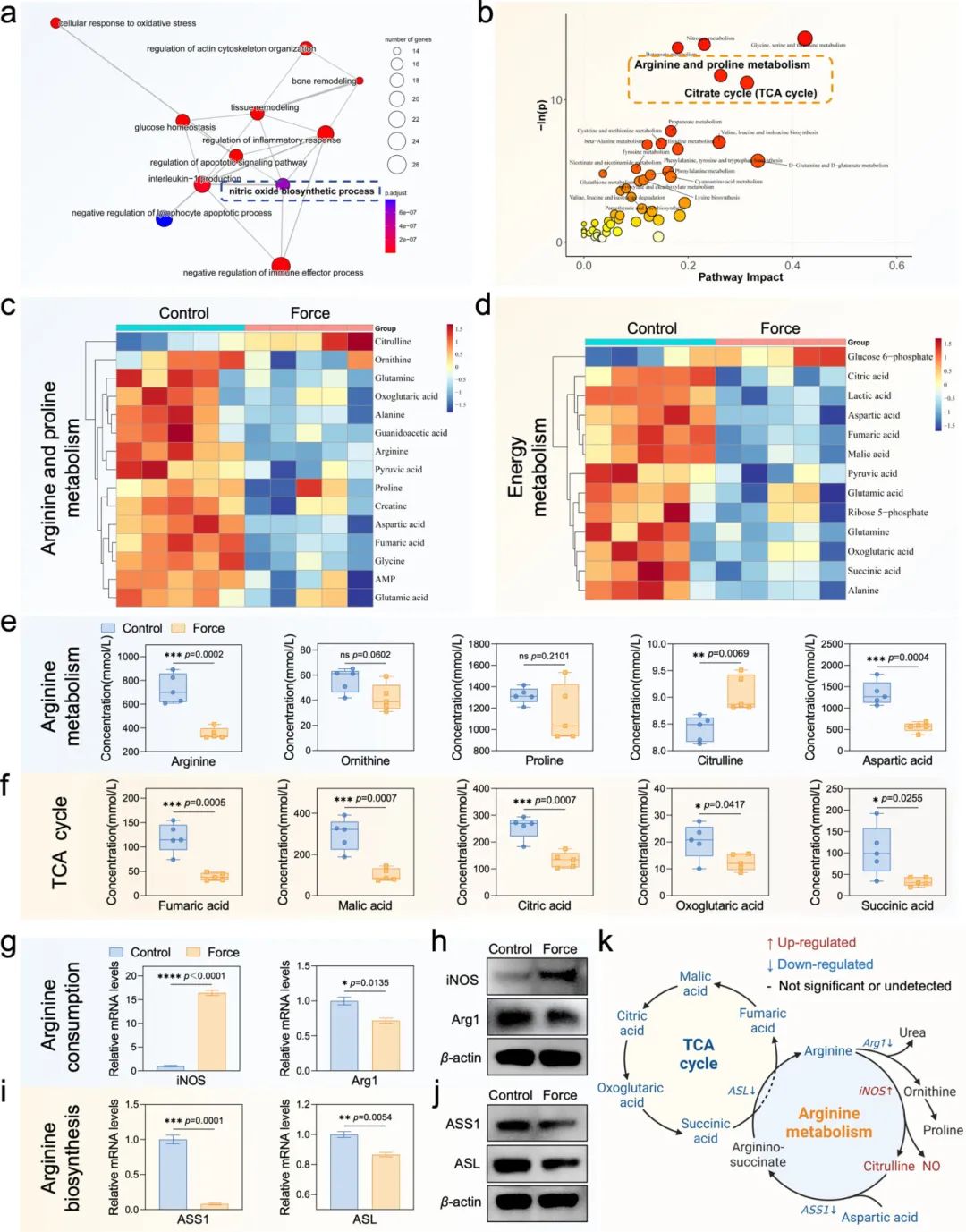
图2 机械力扰乱巨噬细胞中的精氨酸代谢并限制三羧酸循环(TCA循环)。(a)基于GSE210827数据集的富集通路相互作用网络分析;(b)基于代谢组学测试的hsa数据库的通路分析气泡图;(c,d)与精氨酸和脯氨酸代谢以及能量代谢相关的差异代谢物的热图;(e,f)精氨酸代谢和TCA循环相关代谢物的绝对定量分析(n=5);(g-j)qPCR和Western blot分析关键酶iNOS和Arg1(介导精氨酸消耗)、ASS1和ASL(介导精氨酸合成);(k)机械力诱导精氨酸代谢紊乱并限制TCA循环的机制示意图
(3)L-精氨酸通过恢复巨噬细胞能量代谢改善机械力诱导的胞葬功能障碍和无菌性炎症
研究人员通过补充L-精氨酸来恢复机械力作用下巨噬细胞的精氨酸储备(图3a)。透射电镜观察显示,机械力使巨噬细胞线粒体萎缩变形,而L-精氨酸可部分恢复其形态(图3b)。机械力作用下,巨噬细胞内总ROS和线粒体ROS水平显著增加,线粒体膜电位去极化,而L-精氨酸可部分缓解这些现象(图3c-e)。机械力作用下巨噬细胞ATP水平降低,NAD+/NADH表达下调,氧含量降低,而L-精氨酸可逆转这些缺陷(图3f-h)。共聚焦荧光显微镜和流式细胞术分析显示,L-精氨酸可减轻机械力对胞葬作用的负面影响(图3i,j),且显著改善炎症因子的释放水平(图3k)。这些结果表明,恢复巨噬细胞内精氨酸代谢平衡可缓解机械力引发的能量危机,促进无菌性炎症消退。
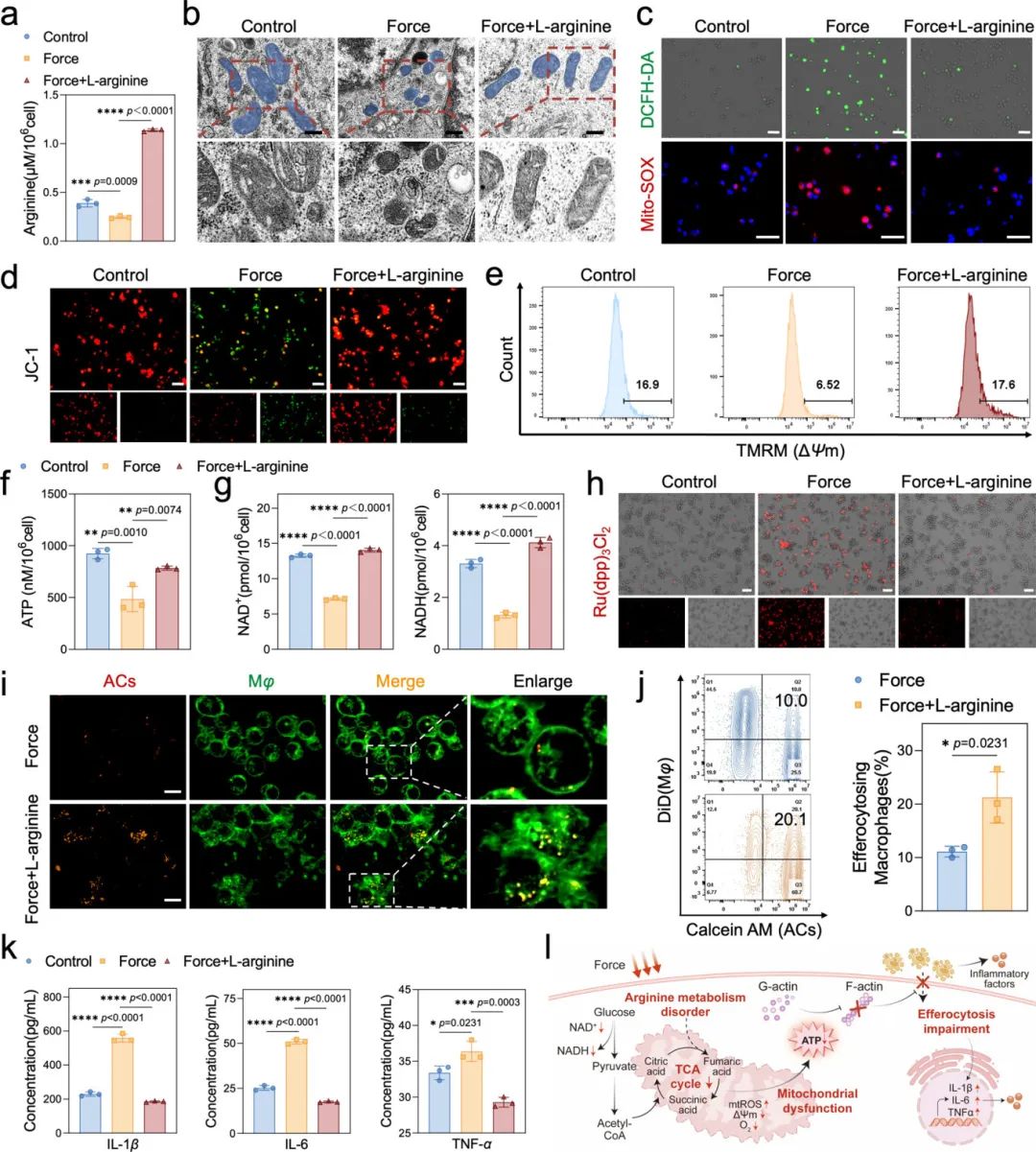
图3 L-精氨酸通过恢复巨噬细胞能量代谢改善机械力诱导的胞葬作用障碍和无菌性炎症。(a)控制组、力组和力+L-精氨酸组巨噬细胞中精氨酸水平的分析;(b)透射电子显微镜图像显示巨噬细胞线粒体的形态(比例尺=400 nm);(c)巨噬细胞中活性氧(ROS)水平的分析(DCFH-DA的绿色荧光强度代表细胞内总ROS水平,Mito-SOX的红色荧光强度代表线粒体ROS水平,比例尺=40μm);(d,e)线粒体膜电位的分析(JC-1染色的红绿荧光强度比和TMRM阳性细胞比例反映线粒体膜电位的高低,比例尺=40μm);(f)巨噬细胞内ATP水平的分析;(g)巨噬细胞内NAD⁺和NADH水平的分析;(h)巨噬细胞内氧含量的分析(Ru(dpp)₃Cl₂的红色荧光越强,氧水平越低,比例尺=80μm);(i,j)荧光图像和流式细胞术分析描述巨噬细胞胞葬作用(比例尺=10μm);(k)ELISA分析在凋亡细胞积累环境中炎症因子IL-1β、IL-6、TNF-α的水平;(l)机械力通过破坏巨噬细胞能量代谢损伤胞葬作用并激活炎症的机制示意图
(4)MSN-LA@HA微针的合成与表征
研究人员开发了一种结合药物释放纳米颗粒和可溶性微针优势的局部给药系统,用于机械力条件下L-精氨酸的高效局部递送。他们合成了由介孔二氧化硅纳米颗粒(MSN)和L-精氨酸组成的MSN-LA纳米系统(图4a),并通过高分辨透射电镜图像(图4b)、能谱(EDS)分析(图4b)、尺寸和Zeta电位测量(图4c)、BJH法(图4d)和FTIR结果(图4e)证实了L-精氨酸的成功封装。此外,研究人员制备了负载MSN-LA的HA微针(MSN-LA@HA MNs)(图4f),并通过扫描电镜和EDS mapping(图4h)验证了MSN-LA的成功整合。CCK-8实验和活-死细胞染色显示该微针无显著细胞毒性(图4i),压缩测试表明其具有优异的机械强度(图4j),且L-精氨酸的释放动力学显示其在前12小时内快速释放约70%的药物,剩余药物随时间逐渐释放(图4k)。
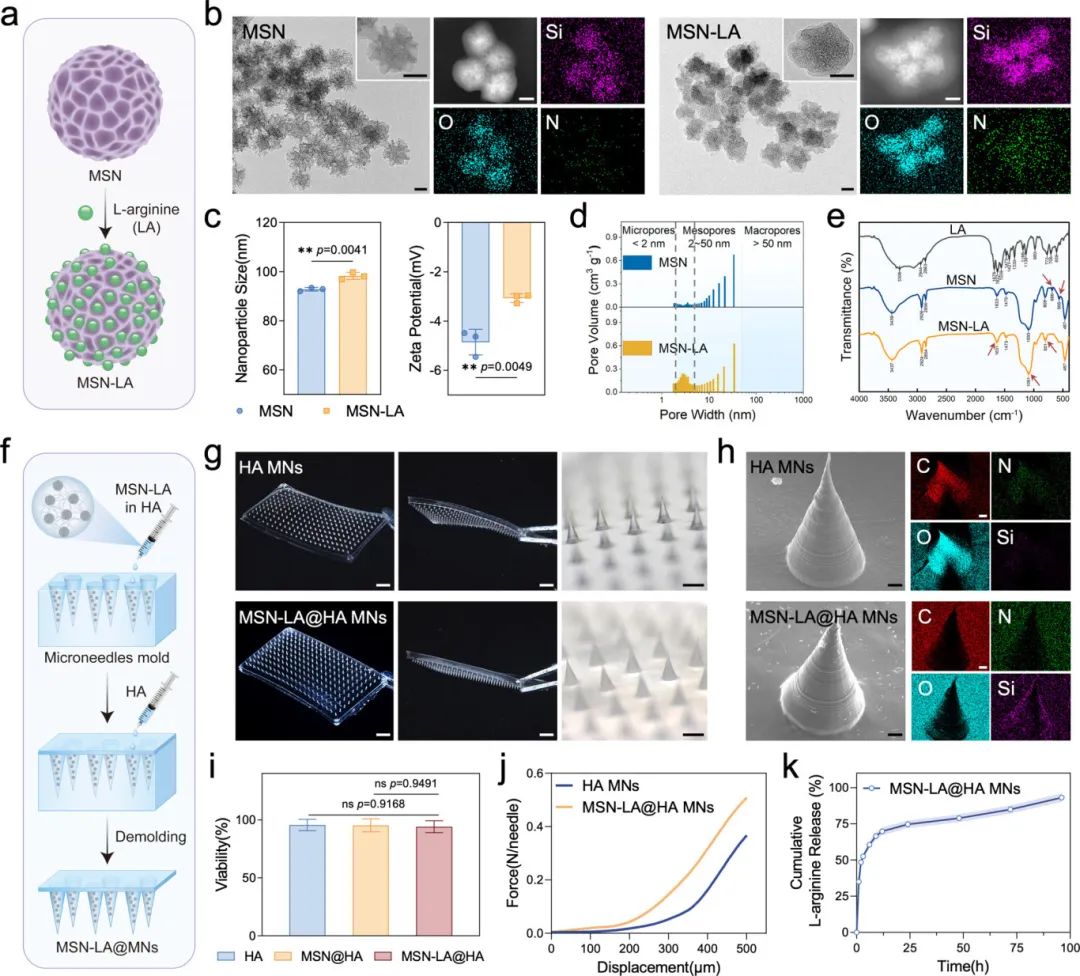
图4 MSN-LA@HA MNs的合成与表征。(a)MSN-LA合成示意图;(b)MSN和MSN-LA的透射电子显微镜图像和能量色散光谱(EDS)元素分析;(c)MSN和MSN-LA的粒径和zeta电位分析;(d)MSN和MSN-LA的孔径分析;(e)LA、MSN和MSN-LA的傅里叶变换红外光谱(FTIR)分析;(f)MSN-LA@MNs制备过程示意图;(g)HA MNs和MSN-LA@HA MNs的立体显微镜图像;(h)HA MNs和MSN-LA@HA MNs的扫描电子显微镜图像和EDS元素分析;(i)巨噬细胞与HA、MSN@HA和MSN-LA@HA共培养的CCK-8活性分析;(j)HA MNs和MSN-LA@HA MNs的机械强度分析;(k)MSN-LA@HA MNs的体外释放动力学
(5)MSN-LA纳米马达的运动能力和趋化特性评估
研究人员通过定量分析发现,在机械力作用巨噬细胞环境中,MSN-LA表现出显著增强扩散特征,其MSD曲线呈抛物线形,运动速度显著高于MSN(图5b-e),表明其作为纳米马达的自主运动能力。Y型通道实验显示,MSN-LA纳米马达在机械力作用巨噬细胞环境中逐渐累积(图5f-h)。Transwell实验进一步证实了MSN-LA对iNOS的趋化响应,且iNOS抑制剂预处理可降低其趋化能力(图5i-j)。共聚焦显微镜观察发现,MSN-LA比MSN具有更强的巨噬细胞内化能力(图5k)、溶酶体逃逸能力(图5l)和线粒体共定位程度(图5m),这有利于其在细胞内发挥代谢调控功能。
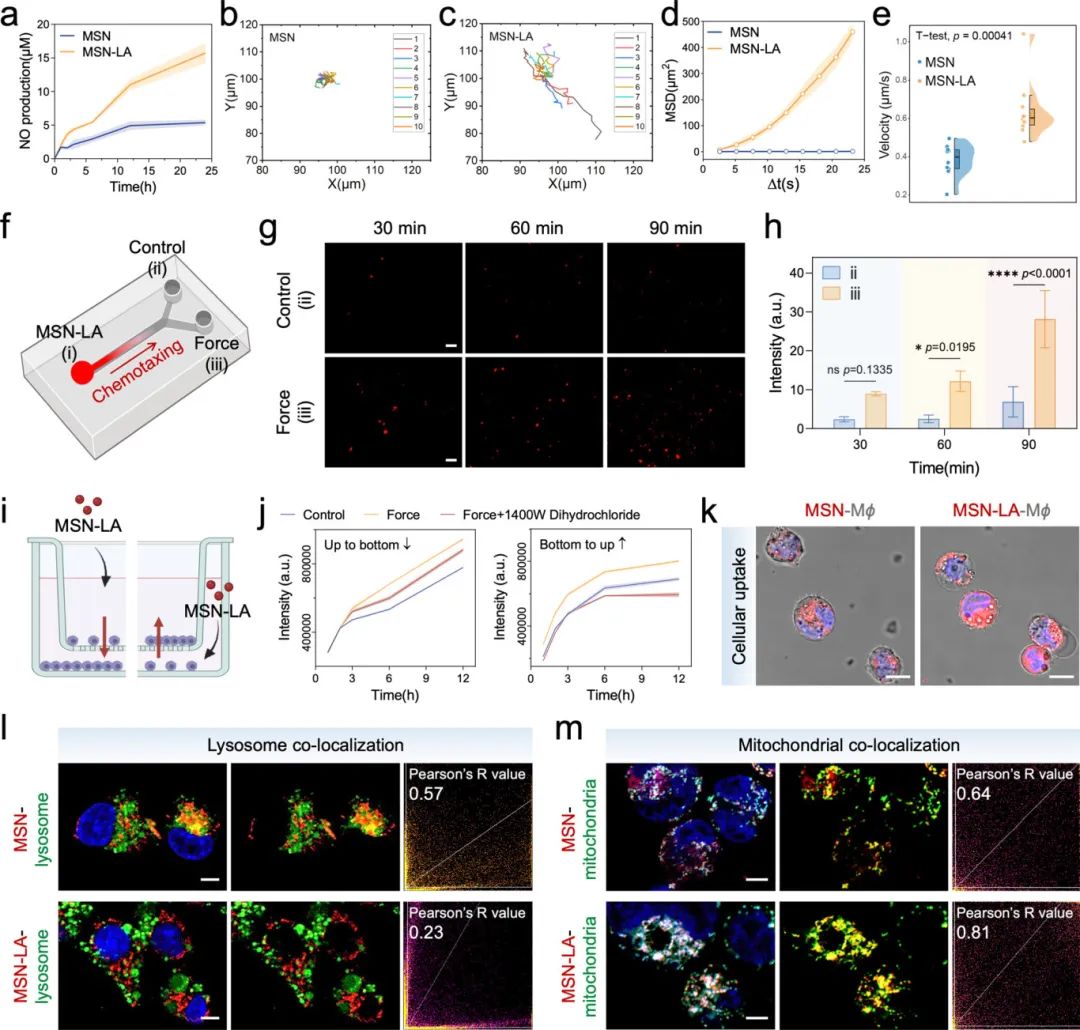
图5 MSN-LA纳米马达的运动性和趋化特性评估。(a)不同样品与力载巨噬细胞共孵育时的NO产生;(b,c)MSN(b)和MSN-LA(c)在力载巨噬细胞环境中的归一化运动轨迹;(d)基于运动轨迹的均方位移(MSD)拟合分析;(e)MSN和MSN-LA在力载巨噬细胞环境中的速度;(f)Y形通道示意图,其中(i)为含有罗丹明B标记的MSN-LA的储液池,(ii)为含有巨噬细胞裂解液的琼脂糖凝胶储液池,(iii)为含有力载巨噬细胞裂解液的琼脂糖凝胶储液池;(g,h)Y形通道中MSN-LA的荧光图像(g)和相应的荧光定量结果(h);(i)Transwell模型用于垂直趋化实验的示意图;(j)高细胞密度腔室的荧光强度曲线;(k)细胞摄取纳米颗粒的共聚焦激光扫描显微镜图像(红色:纳米颗粒);(l)纳米颗粒与溶酶体共定位的共聚焦激光扫描显微镜图像及Pearson相关系数分析(红色:纳米颗粒,绿色:溶酶体);(m)纳米颗粒与线粒体共定位的共聚焦激光扫描显微镜图像及Pearson相关系数分析(红色:纳米颗粒,绿色:线粒体)
(6)MSN-LA@MNs增强OTM中的巨噬细胞胞葬作用并促进牙齿移动
研究人员在大鼠OTM过程中分别给予MSN-LA@MNs和MSN@MNs(图6a,b)。Micro-CT成像和分析显示,MSN-LA@MNs显著增加了OTM距离,而MSN@MNs无此效果(图6c-d)。H&E染色显示两组均未出现牙根吸收,压力侧可见骨吸收陷窝(图6e)。TUNEL和CD68双荧光染色结果显示,机械力作用下TUNEL+凋亡细胞从第1天到第7天逐渐增加,而MSN-LA@MNs显著降低了第3天和第7天的凋亡细胞数量(图6f-g)。此外,MSN-LA@MNs在第3天和第7天显著提高了Mφ-associated ACs与total ACs的比值(图6h),表明巨噬细胞胞葬作用增强。
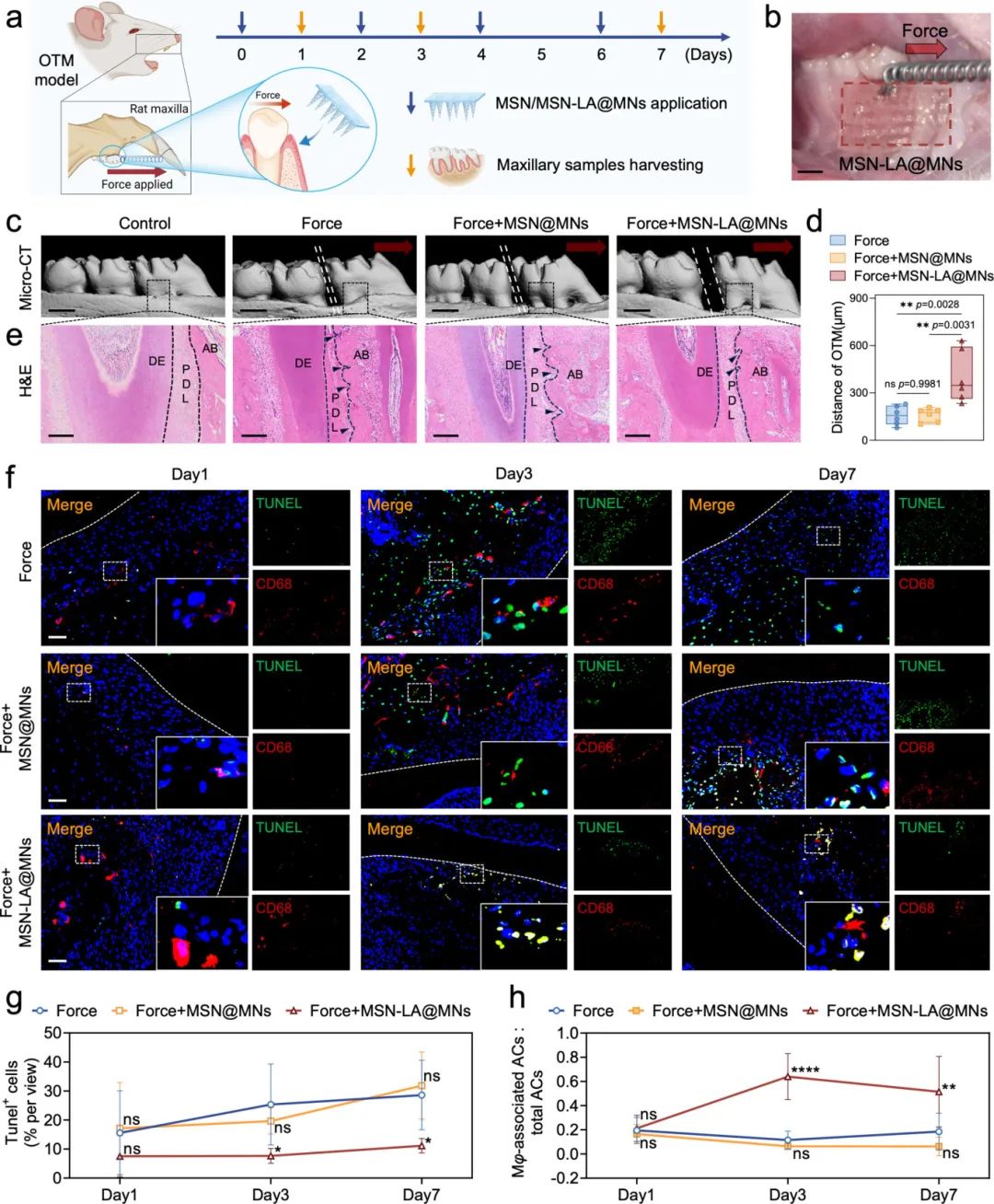
图6 MSN-LA@MNs增强正畸牙齿移动中的巨噬细胞胞葬作用并促进牙齿移动。(a,b)在大鼠正畸牙齿移动模型中应用微针的示意图(a)和实际应用(b,比例尺=2000μm);(c)第7天大鼠上颌骨的重建微CT图像(比例尺=1000μm);(d)第7天牙齿移动距离的分析(n=6);(e)第一磨牙压力侧组织的苏木精-伊红(H&E)染色图像(黑色箭头:骨吸收陷窝,DE:牙本质,PDL:牙周韧带,AB:牙槽骨,比例尺=200μm);(f)第1、3和7天大鼠第一磨牙压力侧的TUNEL和CD68双重荧光染色(比例尺=50μm);(g)TUNEL阳性凋亡细胞的半定量荧光分析(n=5);(h)TUNEL和CD68双阳性细胞的分析,表征巨噬细胞胞葬作用(n=5)
(7)MSN-LA@MNs在iNOS趋化引导下时序调节OTM中的无菌性炎症
研究人员分析了MSN-LA@MNs对大鼠OTM模型中无菌性炎症的调控作用。免疫组化染色和半定量分析显示,MSN-LA@MNs组在OTM初期(第1天)显著升高IL-1β水平,第3天维持较高表达,而在第7天较机械力组明显降低(图7a,c)。CD68和iNOS双荧光染色及半定量分析显示,CD68和iNOS双阳性表达趋势与IL-1β相似(图7b,d)。这些结果表明,MSN-LA@MNs在OTM初期短暂升高炎症水平,随后在线性期更彻底地消退炎症,促进组织修复。图7e展示了MSN-LA@MNs对OTM无菌性炎症的时序调控作用。
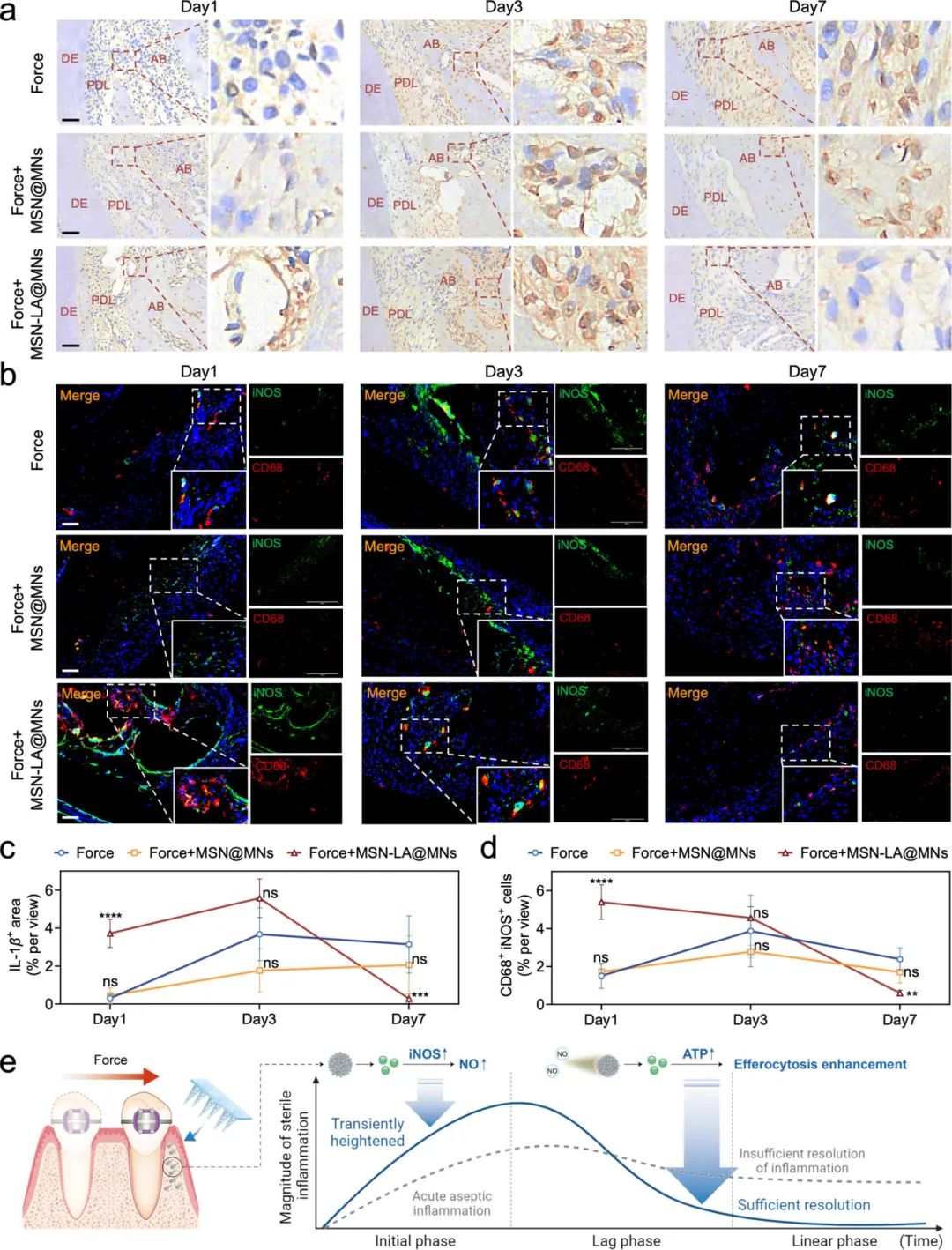
图7 MSN-LA@MNs在iNOS的趋化引导下以时间顺序调节正畸牙齿移动中的无菌性炎症。(a)大鼠牙周组织中IL-1β的免疫组化染色(DE:牙本质,PDL:牙周韧带,AB:牙槽骨,比例尺=50μm);(b)第1、3和7天大鼠第一磨牙压力侧的iNOS和CD68双重荧光染色(比例尺=50μm);(c)IL-1β阳性区域百分比的半定量分析(n=6);(d)iNOS和CD68双阳性细胞的荧光半定量分析(n=5,与力组作为对照进行统计比较);(e)MSN-LA@MNs在iNOS的趋化引导下以时间顺序调节正畸牙齿移动中无菌性炎症的示意图
本研究揭示了机械力(如正畸牙齿移动,OTM)通过破坏巨噬细胞"精氨酸代谢-TCA循环-线粒体功能"的代谢级联,导致胞葬作用(efferocytosis)受损和无菌性炎症加剧的分子机制,并创新性地开发了一种基于NO驱动纳米马达的L-精氨酸靶向递送系统(MSN-LA@MNs)以逆转这一过程。阐明了机械力通过代谢干预免疫功能的机制,为力学生物学提供新视角,同时为代谢靶向药物设计提供了"化学趋化+能量恢复"的新范式。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

