
胶质母细胞瘤(GBM)是最常见且致命的恶性脑肿瘤之一,主要依靠临床手术进行治疗。然而,由于 GBM 的侵袭性以及大脑复杂的精细结构,广泛切除肿瘤往往难以实现,残留的肿瘤细胞最终会导致肿瘤复发。此外,GBM 位于大脑深处,血脑屏障(BBB)的存在使得药物难以高效渗透,为了达到有效的治疗浓度,通常需要给予高剂量药物,这不可避免地会引发全身毒性。因此,局部药物递送已成为 GBM 术后治疗的一种潜在策略。为了从根本上解决 GBM 术后治疗的难题,开发具有机械匹配特性的脑植入物显得尤为重要。

针对上述问题,四川大学张仕勇团队开发了一种可注射的硫辛酸铁(LA-Fe)水凝胶(LFH),能够通过配位 Fe³⁺适应不同脑组织(包括人脑组织)的机械强度,转化为 LA 及其钠盐(LANa)的杂化水凝胶。当将与小鼠脑组织机械性能相匹配的 LFH(337 ± 8.06 Pa)注入脑切除腔时,脑组织含水量维持在正常水平(77%),且不会诱导星形胶质细胞的活化或增生,有效预防脑水肿和瘢痕增生。此外,LFH 在间质液中自发降解,释放 LA 和 Fe³⁺进入肿瘤细胞。其中,氧化还原偶联的 LA/DHLA(细胞中 LA 的还原形式)和 Fe³⁺/Fe²⁺可相互再生,持续提供 ROS 以诱导铁死亡并激活免疫原性细胞死亡。进一步加载抗 PDL1 后,抗 PDL1@LFH 显著增强了肿瘤免疫治疗效果并促进了肿瘤铁死亡。这种适应组织机械强度的可注射水凝胶为肿瘤术后治疗带来了新的希望。该文章于2024年9月以《An injectable biomimetic hydrogel adapting brain tissue mechanical strength for postoperative treatment of glioblastoma without anti-tumor drugs participation》为题发表于《Journal of Controlled Release》(DOI: 10.1016/j.jconrel.2024.07.068)。
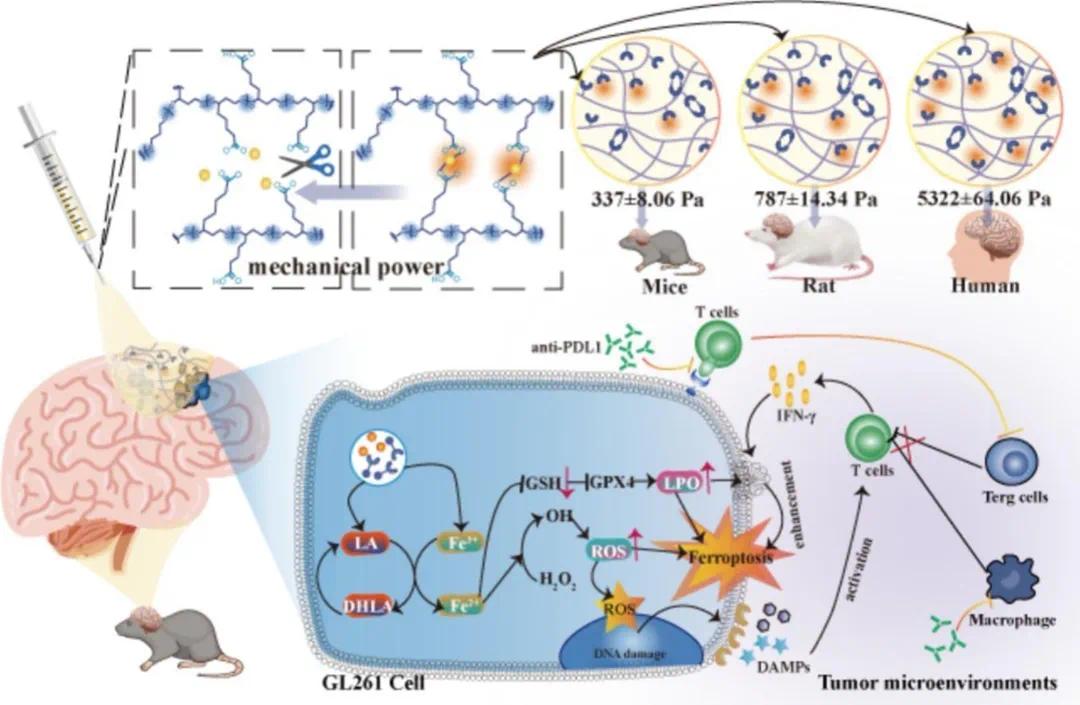
图1 通过配位 Fe 开发了第一个可以适应包括人脑在内的不同脑组织的机械强度的可注射水凝胶
(1)LHF 的合成和表征
将 LA/LANa 水分散液加热至 90℃保持 15 min 后加入 FeCl₃,合成 LFH(图 1a)。SEM 表征显示 LFH 具有典型的凝胶互穿多孔结构(图 1b)。通过显色反应证实了水凝胶中 Fe³⁺的配位。宏观实验表明 LFH 可通过 25G 注射器注射并形成连续字母(图 1c)。流变恢复试验显示,在高剪切应力下,LFH 的 G'(储能模量)与 G''(损耗模量)交点为 476,且随着振幅应变增加,G'显著降低并低于 G'',表明 LFH 从凝胶转变为溶胶,具有可注射性(图 1d)。循环测试(n=3)观察到 LFH 具有剪切变稀和立即恢复行为,进一步证明其稳定注射性(图 1e)。此外,LFH 在施加外部机械力后仍可重塑并形成完整模具形状,表现出良好的自修复特性(图 1f)。LFH 的可注射性和自修复性源于其羧基(COO⁻)与 Fe³⁺形成的可逆金属配位相互作用,外力作用下该配位消散使 LFH 可注射,外力消除后配位重新生成赋予其自修复性。通过紫外-可见光吸收和 ICP-AES 检测 LFH 萃取液,评估其降解和释放行为。如图 1g 所示,LFH 降解缓慢,24 天后仍有 28% 的残留。在 24 天内,LA/LANa 和 Fe³⁺的释放率分别为 89.23%±4.37% 和 75.23%±10.41%(图 1h)。
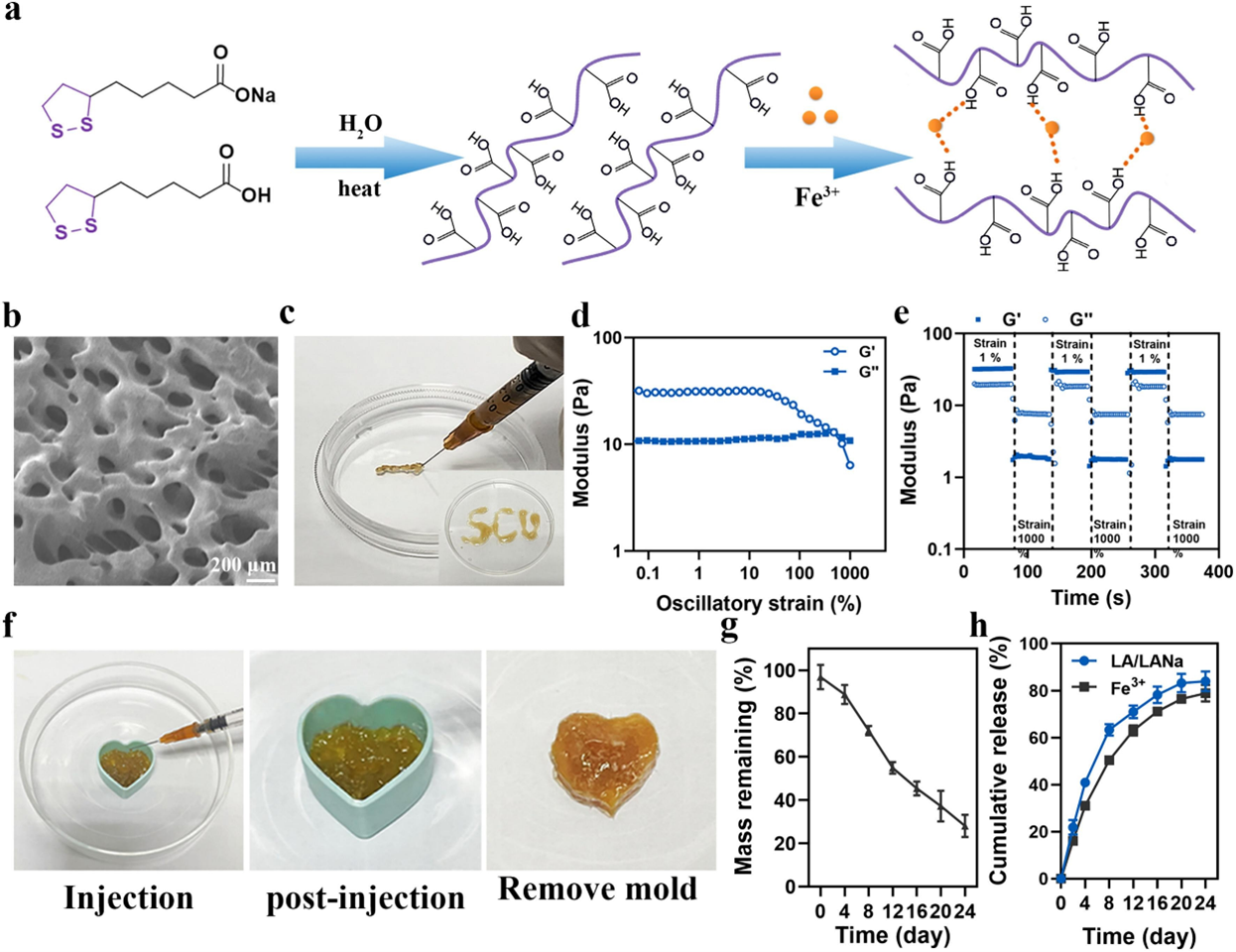
图2 LFH的合成与表征。(a)LFH合成示意图;(b)LFH的扫描电子显微镜(SEM)图像;(c)LFH的宏观注射性;(d)LFH的动态应变扫描(以1 Hz的频率评估测量结果);(e)LFH的循环扫描(LFH在1 Hz下以1%的峰值应变振荡加载3分钟,然后以1000%的峰值应变在1 Hz下振荡3分钟);(f)LFH的自愈特性;(g)LFH的体外降解;(h)LA/LANa和Fe³⁺从LFH中的体外释放
(2)LFH的机械强度和异物反应(FBR)评估
硫辛酸具有独特的热开环聚合特性,可自交联并暴露出多个羧基。这些羧基不仅能与 Fe³⁺动态螯合赋予水凝胶可注射性,还能通过调节 Fe³⁺螯合量控制水凝胶的机械强度。当 LA/LANa 混合物以 1:3 的比例与 1% 或 1.5% Fe³⁺混合时,可获得与小鼠和大鼠脑组织弹性模量相近的 LFHs(图 2a、b)。而将 1:3.5 的 LA/LANa 混合物与 2% Fe³⁺混合时,可制备出与人脑组织弹性模量相似的 LFH(图 2c)。
为探究脑植入物与脑组织的匹配性对 FBR 的影响,将不同弹性模量的 LFH 植入小鼠脑腔,检测脑水肿和瘢痕增生程度,评估脑内 LFH 的 FBR。实验中,以弹性模量为 337 ± 8.06 Pa 的 LFH2 为实验组,以超软(14 ± 0.41 Pa)和超硬(5322 ± 64.06 Pa)的 LFH1 和 LFH3 为对照组。植入时,LFH2 能完美贴合术后腔,而 LFH1 和 LFH3 分别出现溢流腔和未填充腔(图 2d)。植入 7 天和 24 天后,LFH2 组脑组织未见明显损伤,成功与脑组织整合(图 2d,视频 2),而 LFH1 和 LFH3 组小鼠脑组织均出现明显发红和出血(图 2d)。
脑水肿通过湿/干组织重量测量评估(图 2e)。结果显示,LFH2 组小鼠大脑含水量低至 77%,与健康小鼠相当,表明 LFH2 植入未引发脑水肿(图 2f)。而 LFH1 和 LFH3 植入后,小鼠脑组织含水量分别显著增加至 80% 和 82%(图 2f)。
免疫荧光染色显示,植入后 7 天和 24 天,LFH2 组脑组织中未见明显绿色(GFAP)或红色(Iba-1)荧光(图 2g),表明星形胶质细胞和小胶质细胞未被激活。而 LFH1 和 LFH3 组中则有强烈荧光,说明其植入导致星形胶质细胞和小胶质细胞激活(图 2g)。免疫组化染色进一步证实 LFH1 和 LFH3 组瘢痕增生。植入 7 天后,LFH1 和 LFH3 组活性星形胶质细胞密度显著增加并聚集在水凝胶周围,LFH3 周围梗死组织甚至转化为中央瘢痕腔(图 2h)。植入 24 天后,LFH1 和 LFH3 组小鼠脑组织形成厚度 >100 μm 的明显瘢痕组织(图 2h,i)。相比之下,LFH2 组植入后周围无明显活化星形胶质细胞增殖和聚集,疤痕厚度远小于 LFH1 组和 LFH3 组(图 2h,i)。这些数据证实了植入材料与脑组织机械强度匹配的重要性,匹配度越高,FBR 发生率越低。
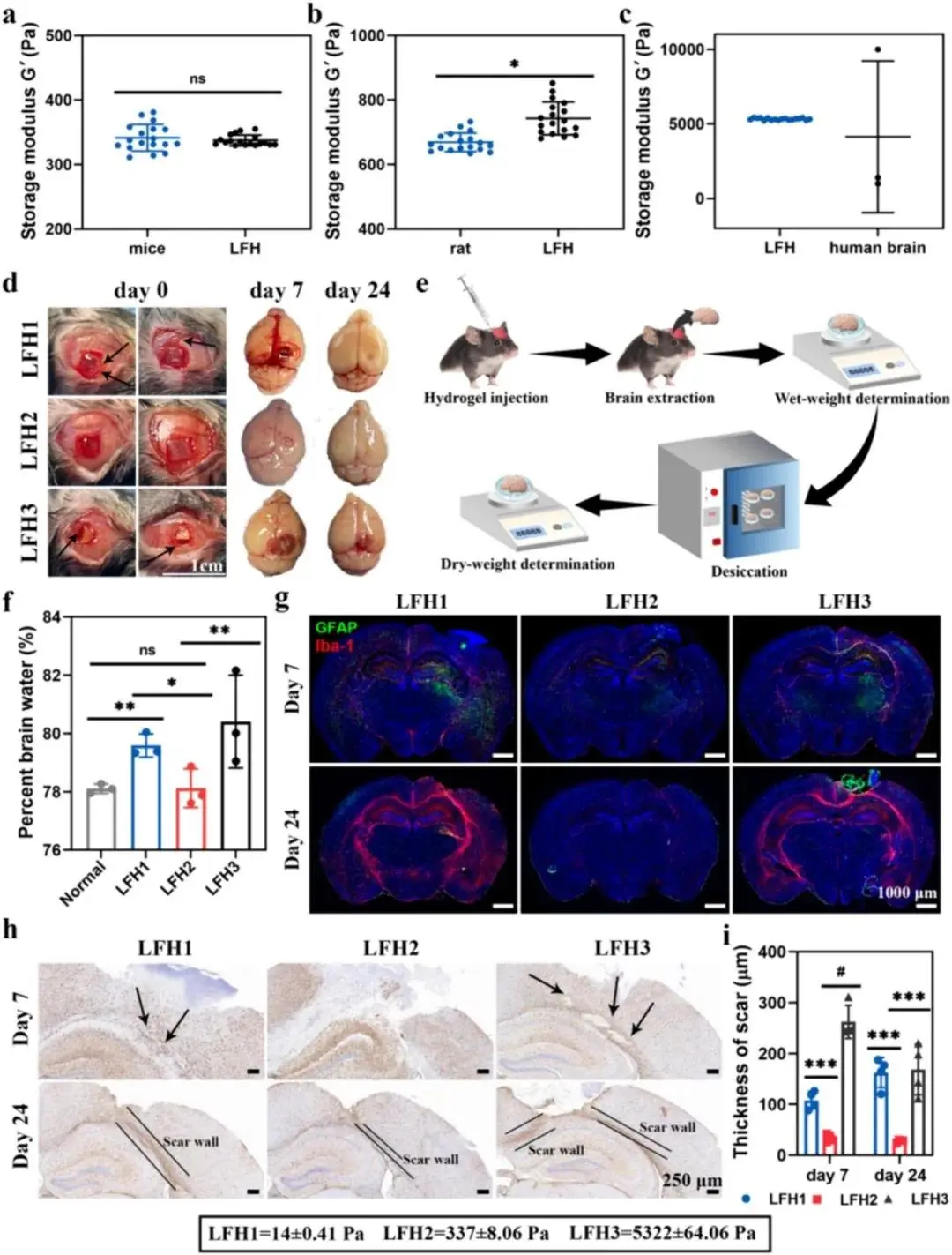
图3 LFH的FBR评估。(a)LFH(1% Fe³⁺)和小鼠脑组织;(b)LFH(1.5% Fe³⁺)和大鼠脑组织;(c)LFH(2% Fe³⁺)和文献报道的人类脑组织;(d)在LFHs植入后第7天和第24天,在小鼠脑组织和解剖的脑组织中植入不同的LFHs;(e)用于脑水肿测量的湿/干法示意图;(f)不同组脑水含量百分比的比较(正常:健康且未经治疗的小鼠脑组织);(g)LFH(包括LFH1、LFH2和LFH3)植入后7天和24天小鼠脑切片的免疫荧光染色(GFAP,一种星形胶质细胞活化标志物,绿色荧光;Iba-1,一种小胶质细胞标志物,红色荧光);(h)LFH1、LFH2和LFH3植入7天和24天后脑组织切片的免疫组织化学染色(箭头指活化的星形胶质细胞积聚和形成梗死腔的地方,水平线表示疤痕的宽度);(i)植入的LFH周围神经胶质瘢痕的厚度
(3)LFH的抗肿瘤活性和ICD诱导能力
为评估 LFH 的治疗效果,将小鼠胶质瘤细胞(GL261 细胞)分别与 Fe³⁺、LA/LANa 或 LFH 接触,通过体外钙黄绿素-AM(CAM)/碘丙酯荧光(PI)染色检测细胞活力。MTT 实验显示,单独使用 Fe³⁺或 LA/LANa 对细胞毒性较弱,而 LFH 处理后 GL261 细胞存活率仅为 12%(图 3a)。CAM/PI 染色结果与 MTT 一致,LFH 组红色荧光显著增加,表明 LFH 对 GL261 细胞具有显著的抗肿瘤作用(图 3b)。
为探究 LFH 的抗肿瘤机制,发现 LFH 释放 LA 和 Fe³⁺进入肿瘤细胞后,一方面可在 DHLA 和 Fe³⁺作用下还原为 Fe²⁺,触发 Fenton 反应诱导铁死亡。通过不同细胞死亡抑制剂处理 LFH 处理后的 GL261 细胞,发现铁死亡抑制剂(去铁胺、维生素 E 和铁司他汀-1)显著提高细胞活力,而坏死抑制剂、自噬抑制剂和凋亡抑制剂效果不明显(图 3c),证实铁死亡是 LFH 处理 GL261 细胞的主要死亡方式。进一步检测谷胱甘肽(GSH)、谷胱甘肽过氧化物酶 4(GPX4)和脂质过氧化物(MDA)水平,发现 LFH 降低 GSH 表达、抑制 GPX4 活性并增加 MDA 水平,这些变化可被铁死亡抑制剂逆转(图 3d)。
另一方面,LFH 中的 LA/DHLA 和 Fe³⁺/Fe²⁺氧化还原对可扩增癌细胞中的氧化应激。通过 DCFH-DA 探针检测细胞内 ROS 水平,LFH 处理的 GL261 细胞 ROS 水平显著高于 Fe³⁺和 LA/LANa 组,达到 1587%,是 Fe³⁺组的 2.8 倍和 LA/LANa 组的 2 倍(图 3e、f),证实 LFH 能显著增强细胞内氧化应激。
此外,LFH 还能诱导免疫原性细胞死亡(ICD)。检测 ICD 标志物(CRT、HMGB1 和 ATP)发现,LFH 处理的肿瘤细胞 ATP 分泌量是对照组的 25 倍(图 3g),HMGB1 完全迁移出细胞核(图 3h),且 CLSM 图像显示 CRT 在细胞膜上显著暴露(图 3i)。这些结果表明 LFH 具有诱导 ICD 的能力。
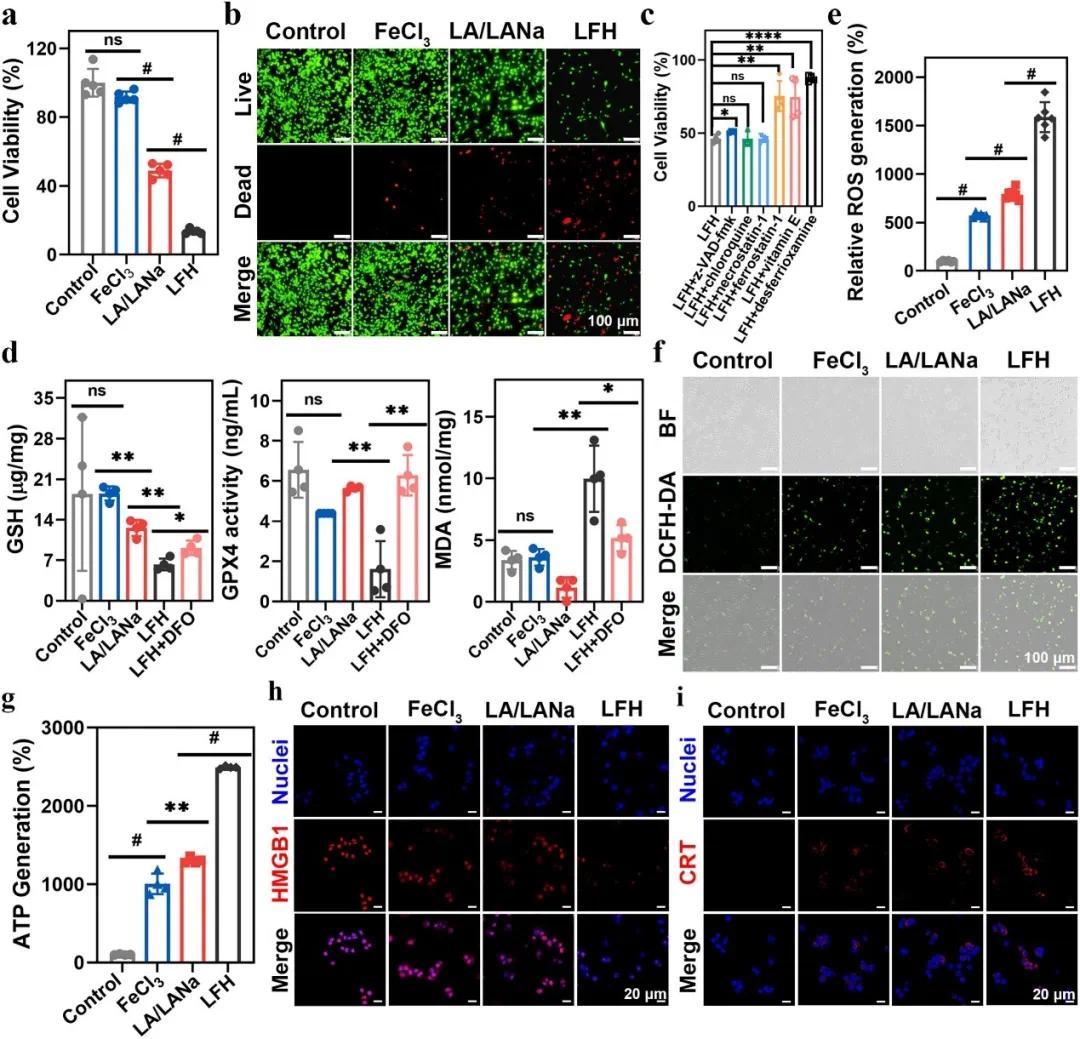
图4 LFH的抗肿瘤活性和机制。(a)GL261细胞与LFH共孵育0、6、12、18、24、36和48小时后的细胞活力;(b)GL261细胞与FeCl₃、LA/LANa和LFH共孵育12小时后活/死细胞的荧光图像(CAM,绿色;PI,红色);(c)GL261细胞与LFH和不同抑制剂共孵育后的细胞活力测定;(d)GL261细胞与FeCl₃、LA/LANa、LFH和LFH+DFO共孵育6小时后铁死亡相关标志物(GSH、GPX4和脂质过氧化物)的检测;(e,f)GL261细胞与FeCl₃、LA/LANa和LFH共孵育3、6小时后,用DCFH-DA染色的相对ROS生成(e)和荧光图像(f);(g)GL261细胞与FeCl₃共孵育后的ATP分泌;(h)共聚焦激光扫描显微镜(CLSM)图像显示GL261细胞与FeCl₃共孵育后的HMGB1释放;(i)CLSM图像显示GL261细胞与FeCl₃共孵育后CRT的表面易位
(4)LFH的体内抗癌评价
免疫激活可清除肿瘤并增强铁死亡,LA/DHLA 和 Fe³⁺/Fe²⁺可再生并提供 ROS 诱导铁死亡和免疫原性细胞死亡。PDL1 在 GBM 微环境中高表达导致免疫抑制,因此构建了 aPDL1@LFH 以增强 T 细胞活性和肿瘤铁死亡,缓解免疫抑制并提升治疗效果。在 C57BL/6 小鼠右脑建立原位 GBM 不完全切除模型(图 4a),术后小鼠分为 LFH 和 aPDL1@LFH 组处理,未治疗组为对照。治疗 24 天,生物发光成像显示各组小鼠大脑荧光信号术后显著减弱,表明模型成功建立(图 4b)。随着处理时间延长,LFH 和 aPDL1@LFH 组荧光强度显著低于对照组,24 天后分别为对照组的 7.5% 和 0.012%(图 4c)。LFH 组和 aPDL1@LFH 组小鼠存活率更高,中位生存时间分别为 27 天和 38 天(图 4d)。治疗后,H&E 染色和 TUNEL 测定显示 LFH 和 aPDL1@LFH 组肿瘤体积显著小于对照组,且显著诱导肿瘤细胞凋亡和坏死(图 4e、f)。
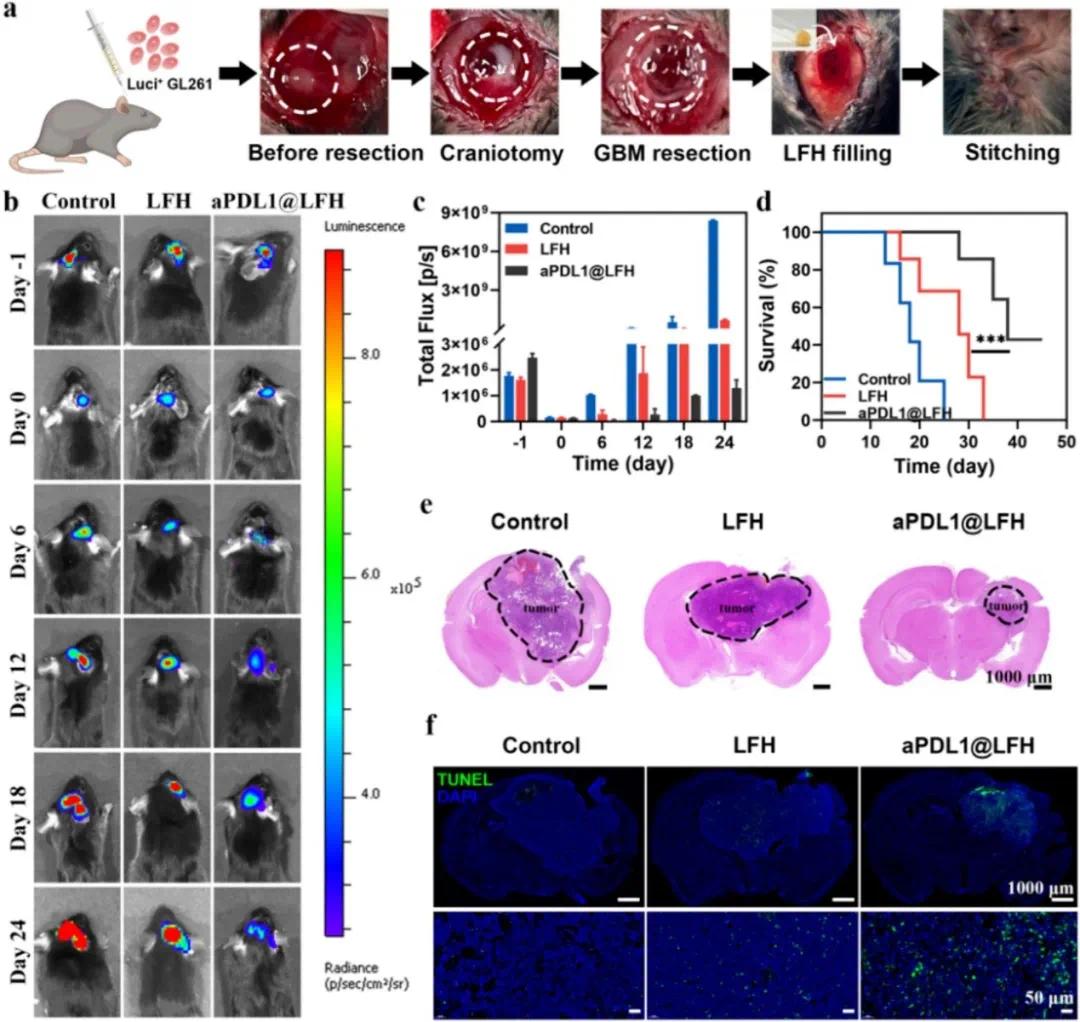
图5 LFH的体内抗肿瘤效率。(a)实验设计示意图,显示接种后第12天携带Luci⁺GL261的小鼠进行肿瘤切除和LFH腔内植入;(b,c)体内生物发光图像(b)和量化信号强度(c);(d)不同治疗的胶质母细胞瘤(GBM)切除模型小鼠的生存分析;(e)治疗24天后不同组小鼠脑部的苏木精-伊红(H&E)切片(复发性肿瘤以虚线框表示);(f)各组的TUNEL染色(DAPI,蓝色;TUNEL,绿色)
治疗 24 天后,收集各组脑组织,流式细胞术评估脑 DC 细胞成熟、T 细胞活化和 Treg 细胞表达(图 5a)。LFH 和 aPDL1@LFH 组活动 DC 频率显著高于对照组,分别为对照组的 1.47 倍和 2.85 倍,且 aPDL1@LFH 组高于 LFH 组(图 5b、c)。LFH 处理后,CD4⁺ T 细胞和 CD8⁺ T 细胞数量分别增加 3.45 倍和 3.53 倍(图 5d-g),而 aPDL1@LFH 组 CD4⁺ T 细胞和 CD8⁺ T 细胞数量分别是对照组的 5.01 倍和 5.57 倍(图 5d-g)。aPDL1@LFH 组 CD3⁺CD4⁺Foxp3⁺ Treg 细胞数量显著减少至 7.73±0.45%(图 5h,i)。ELISA 检测显示,LFH 和 aPDL1@LFH 组小鼠血清中 IL-2 和 TNF-α 水平显著高于对照组(图 5j、k)。
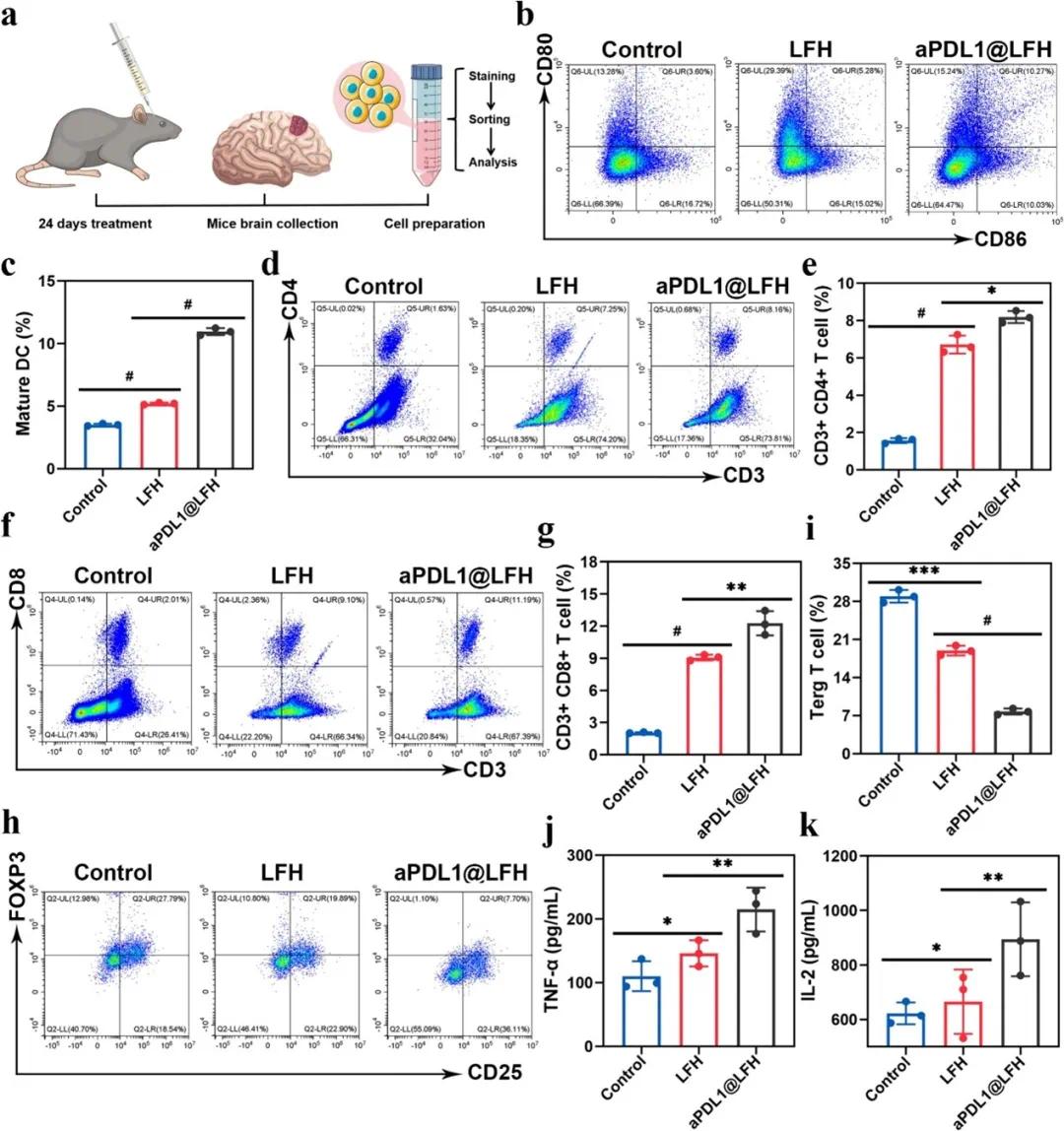
图6 LFH的体内免疫反应。(a)显示肿瘤提取过程和流式细胞术分析的示意图;(b,c)流式细胞术分析(b)和每种制剂中脑组织中树突状细胞(DC)的成熟速率(c);(d)在手术切除和给药后24天从携带胶质母细胞瘤(GBM)的小鼠中收获并通过流式细胞术分析不同制剂的CD3⁺CD4⁺ T细胞;(e)CD3⁺CD4⁺ T细胞的定量分析;(f)治疗24天后携带GBM的小鼠大脑的CD3⁺CD8⁺细胞毒性T细胞的流式细胞术分析;(g)CD3⁺CD8⁺细胞毒性T细胞的定量分析;(h,i)根据流式细胞术(h)和定量分析(i)每组脑组织中CD3⁺CD4⁺Foxp3⁺调节性T细胞(Tregs)的种群;(j,k)LFH和aPDL1@LFH处理后肿瘤坏死因子(TNF-α,j)和白细胞介素-2(IL-2,k)的表达
aPDL1 负载提高了 LFH 对 GBM 的治疗效果,其协同作用源于解除免疫抑制和增强肿瘤细胞铁死亡。体外实验中,LFH 联合 IFN-γ 处理使 GL261 细胞存活率显著降低,比 LFH 组低 2/3(图 6a),且荧光显微镜下红色荧光最强(图 6b)。LFH + IFN-γ 组 GSH 和 GPX4 表达水平显著降低,分别为 LFH 组的 48% 和 49%,细胞内脂质过氧化增强至 LFH 组的 1.4 倍(图 6c),细胞内 ROS 水平高于 LFH 组(图 6d、e)。体内实验中,免疫荧光染色显示 aPDL1@LFH 处理后小鼠脑部 PD-L1 表达显著降低,包括胶质母细胞瘤细胞和巨噬细胞(图 6h)。aPDL1@LFH 处理后,小鼠脑组织中 IFN-γ 含量最高(图 6h),显著下调 SLC3A2、SLC7A11、GSH 和 Cys 表达,分别为 LFH 组的 47% 和 70%(图 6j、k),且 GPX4 表达降低,脂质过氧化增加(图 6l,m)。这些结果表明,aPDL1 负载增强了 LFH 的免疫激活和铁死亡诱导能力。
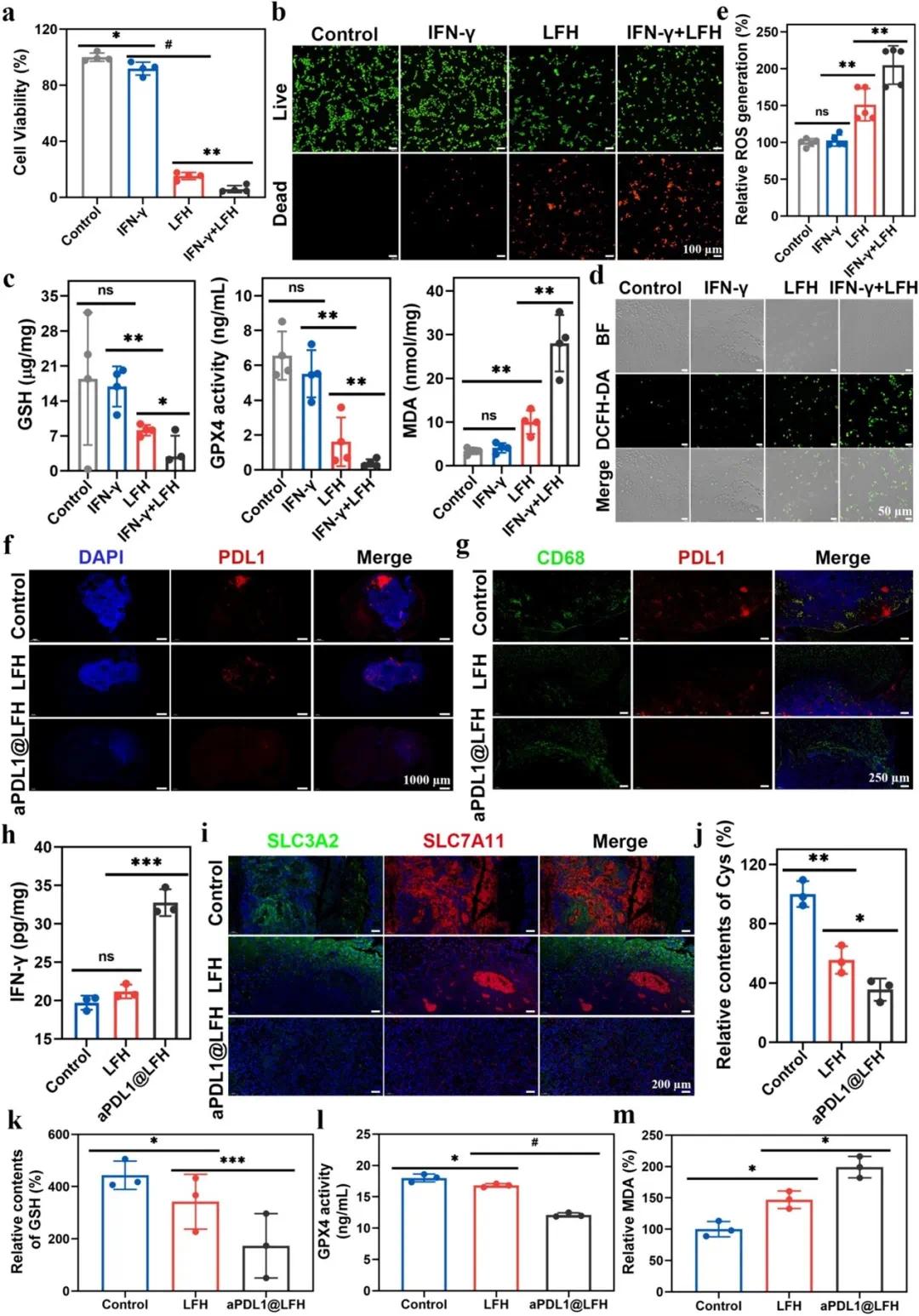
图7 aPDL1@LFH增强的体外和体内抗肿瘤作用机制。(a)GL261细胞与IFN-γ、LFH和LFH+IFN-γ共孵育48小时后的细胞活力;(b)GL261细胞与IFN-γ、LFH和LFH+IFN-γ共孵育12小时后活/死细胞的荧光图像;(c)GL261细胞与IFN-γ、LFH和LFH+IFN-γ共孵育6小时后铁死亡相关标志物GSH、GPX4和脂质过氧化物的检测;(d,e)GL261细胞与IFN-γ、LFH和LFH+IFN-γ共孵育6小时后,用DCFH-DA染色的荧光图像(d)及相应的荧光强度(e);(f)LFH和aPDL1@LFH植入24天后小鼠脑切片中PDL1的免疫荧光染色;(g)LFH和aPDL1@LFH植入24天后小鼠脑切片中CD68和PDL1的免疫荧光双染色;(h)LFH和aPDL1@LFH处理后小鼠大脑中IFN-γ的表达;(i)LFH和aPDL1@LFH植入24天后小鼠脑切片中SLC3A2和SLC7A11的免疫荧光双染色;(j-m)处理后各组铁死亡相关标志物Cys(j)、GSH(k)、GPX4(l)和MDA(m)的表达
(5)LFH的生物相容性
LFH 在体外和体内的生物安全性良好。体外实验中,BV2 细胞与 LFH 共孵育 72 小时后,细胞活力仍超过 90%(图 7a)。体内实验中,苏木精-伊红染色显示 LFH 植入 24 天后小鼠脑组织中无大量炎症细胞积累,炎症反应低(图 7b)。血液学分析显示,LFH 和 aPDL1@LFH 治疗后小鼠血清中的 AST、ALT、ALP、CREA 和 BUN 水平与健康小鼠相当,表明水凝胶植入对肝脏和肾脏无显著损害(图 7c)。
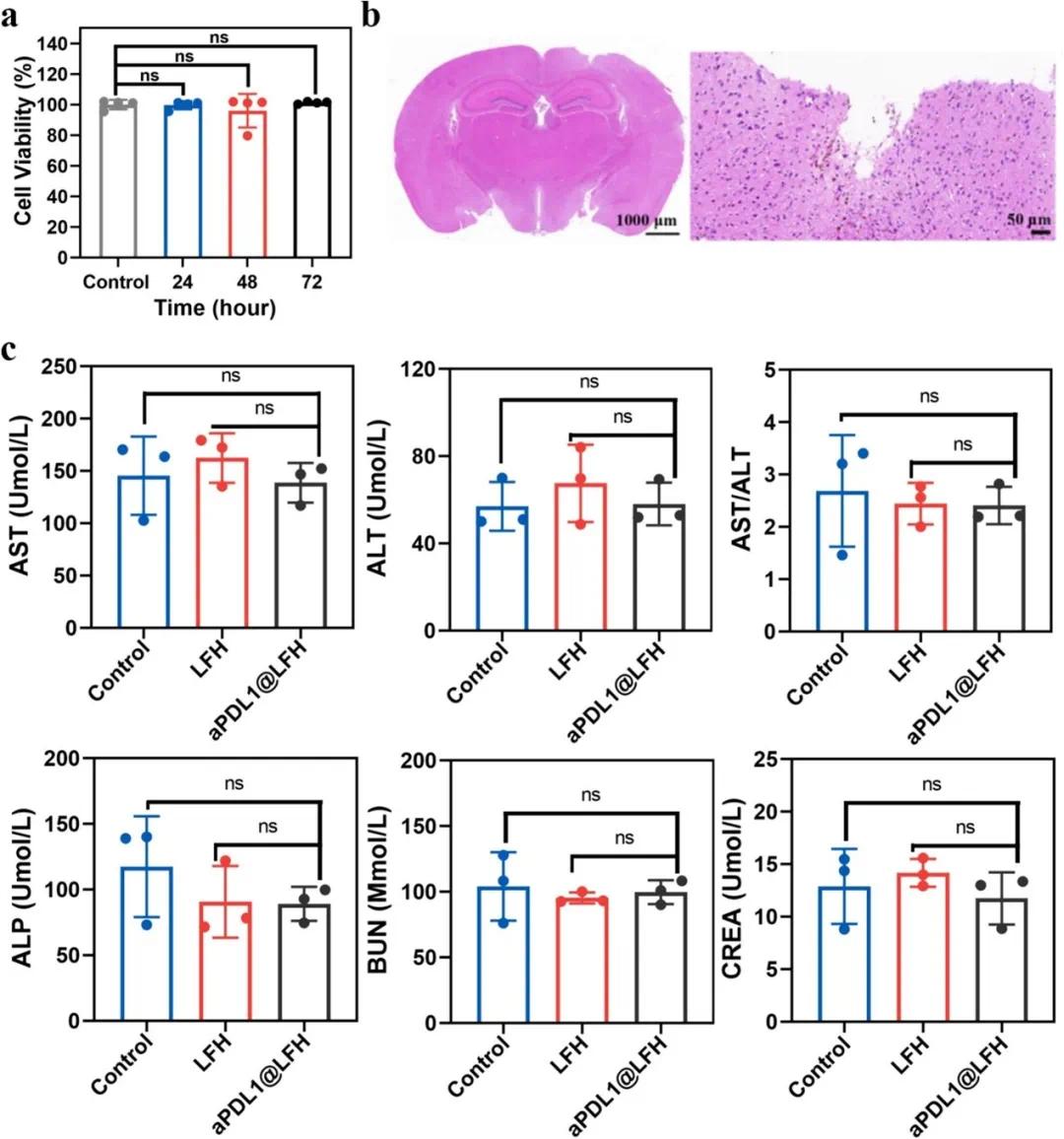
图8 LFH和aPDL1@LFH的体内生物安全性。(a)BV2细胞与LFH共孵育不同时间后的细胞活力;(b)苏木精和伊红(H&E)染色,以评估植入后24天LFH周围组织的炎症反应;(c)LFH和aPDL1@LFH治疗小鼠的血液生化分析(健康小鼠作为对照)
本研究开发了一种可注射水凝胶 LFH,适应不同脑组织机械强度,用于 GBM 术后治疗,无需抗肿瘤药物。通过调节 Fe³⁺配位键数量和 -COOH,可轻松获得适应不同脑组织的 LFH。术后将 LFH(337 ± 8.06 Pa)注入小鼠脑腔,可维持脑组织正常含水量,抑制瘢痕增生,避免 FBR。 在原位 GBM 术后模型中,LFH 使肿瘤细胞 ROS 含量增加 125%,脂质过氧化物 MDA 含量增加 10 倍,触发铁死亡并激活 ICD,使小鼠中位生存期延长 50%。加载 aPDL1 后,aPDL1@LFH 进一步缓解免疫抑制、增强铁死亡,将小鼠术后中位生存时间提高90%。生物安全性研究显示,LFH 无脑部炎症和肝肾毒性,无全身毒性。这种适应脑组织机械强度的可注射 LFH 为 GBM 术后治疗提供了新机会,具有临床应用潜力。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

