
造血干细胞(HSCs)作为成熟血系的祖细胞,具有自我更新和分化为所有血细胞类型的能力,但在化疗、辐射、感染和衰老等应激条件下,其功能会受到显著影响。应激诱导的HSCs损伤主要源于线粒体代谢紊乱、DNA损伤以及细胞周期延长,导致活性氧(ROS)的持续产生和积累,最终引发HSCs衰竭和造血功能丧失。
尽管调节代谢或改变HSCs微环境可以改善其在应激条件下的功能,但目前的治疗策略仍存在局限性。研究表明,N-乙酰半胱氨酸(NAC)等抗氧化剂能够降低HSCs中的ROS含量,改善造血功能,但其需要持续给药以维持效果。因此,开发更有效的酶抗氧化剂以改善HSCs移植后或癌症治疗后的造血再生具有重要意义。

针对上述问题,浙江大学钱鹏旭教授旨在探讨 FMT 对急性髓系白血病(AML)细胞和造血干细胞的不同作用,以及 FMT 是否能缓解应激的造血干细胞,促进造血再生。在应激条件下,如体外培养、化疗、放疗和感染,HSCs会积极分裂以维持血液细胞的生成。这一过程会产生活性氧(ROS),导致HSCs耗竭和造血功能衰竭。铁氧血红素(FMT;Feraheme),一种经美国食品药品监督管理局批准的纳米药物,是一种强大的ROS清除剂,能够缓解应激下HSCs中的ROS,促进其损伤后的再生。机制上,FMT的过氧化氢酶样活性降低了细胞内过氧化氢水平,减少了H2O2引起的细胞毒性。此外,FMT在预处理过的白血病小鼠中维持了移植HSCs的长期再生能力,并显示出在体内有效消除白血病的同时保留HSCs的潜力。该文章于2025年4月23日以《Ferumoxytol promotes haematopoietic stem cell post-injury regeneration as a reactive oxygen species scavenger》为题发表于《nature nanotechnology》(DOI:: 10.1038/s41565-025-01907-2)。
(1)FMT减少ROS诱导的HSC细胞毒性
研究发现,FMT对血液系统中正常干细胞和恶性细胞具有不同的生物学效应。FMT降低了小鼠长期造血干细胞(LT-HSC;CD150+CD48−LSK)中的ROS水平,但显著增加了MLL-AF9(MA9)驱动的AML细胞中的ROS水平(图1a,b)。在小鼠造血干/祖细胞系32D和AML细胞系C1498中也观察到类似结果(图1a,b)。FMT诱导AML细胞凋亡,同时保留HSC,并降低造血祖细胞中的ROS水平(图1c)。FMT对AML细胞增加的氧化应激和细胞毒性,除酸性环境下其过氧化物酶样活性产生的毒性外,还归因于溶酶体中纳米颗粒(NP)降解后产生的游离铁离子。FMT在酸性条件(pH=4.6,如溶酶体中)下持续降解并释放铁离子,而在中性溶液(pH=7.4,如细胞质中)中保持稳定。亚铁离子和三价铁离子均对骨髓(BM)原代细胞具有毒性,LT-HSC中细胞内ROS水平增加,但FMT的涂层材料聚葡萄糖山梨醇羧甲基醚(PSC)不降低ROS水平,提示FMT在正常HSC中可能保持完整颗粒形式,很少降解。相比之下,FMT促进MA9细胞中细胞内ROS产生的能力与铁离子相当,表明其在白血病细胞中可能经历更多细胞降解以产生铁。
在HSC和AML细胞中,FMT的细胞内分布存在差异。少数内化的FMT与LT-HSC和32D中的溶酶体共定位,而大多数内化的FMT与MLL-AF9和C1498中的溶酶体共定位(图1d),这一结果通过三维成像(图1e,f)和透射电子显微镜(TEM)得到证实。FMT属于超顺磁性纳米颗粒,其降解过程可通过磁性监测。FMT在C1498中比32D更多地内化,且AML细胞中过量的铁在FMT处理24h后位于细胞质中,48h后位于溶酶体中(图1g)。磁性测量发现,尽管32D中内化的铁较少,但其磁性铁质量显著高于C1498,且48h时增加的磁性铁来自细胞质(图1h),与成像观察一致,即FMT以纳米颗粒形式进入细胞质(图1d,f)。此外,AML细胞表现出更多的溶酶体荧光信号(图1i)和计数,这可能是由于转录因子EB(TFEB,溶酶体生物发生的主要调节物)的mRNA水平和核蛋白水平在AML细胞中比HSC高得多(图2k,l)。这些结果表明,FMT在HSC细胞质中显示出更多共定位,导致ROS诱导的细胞毒性降低(图1k)。
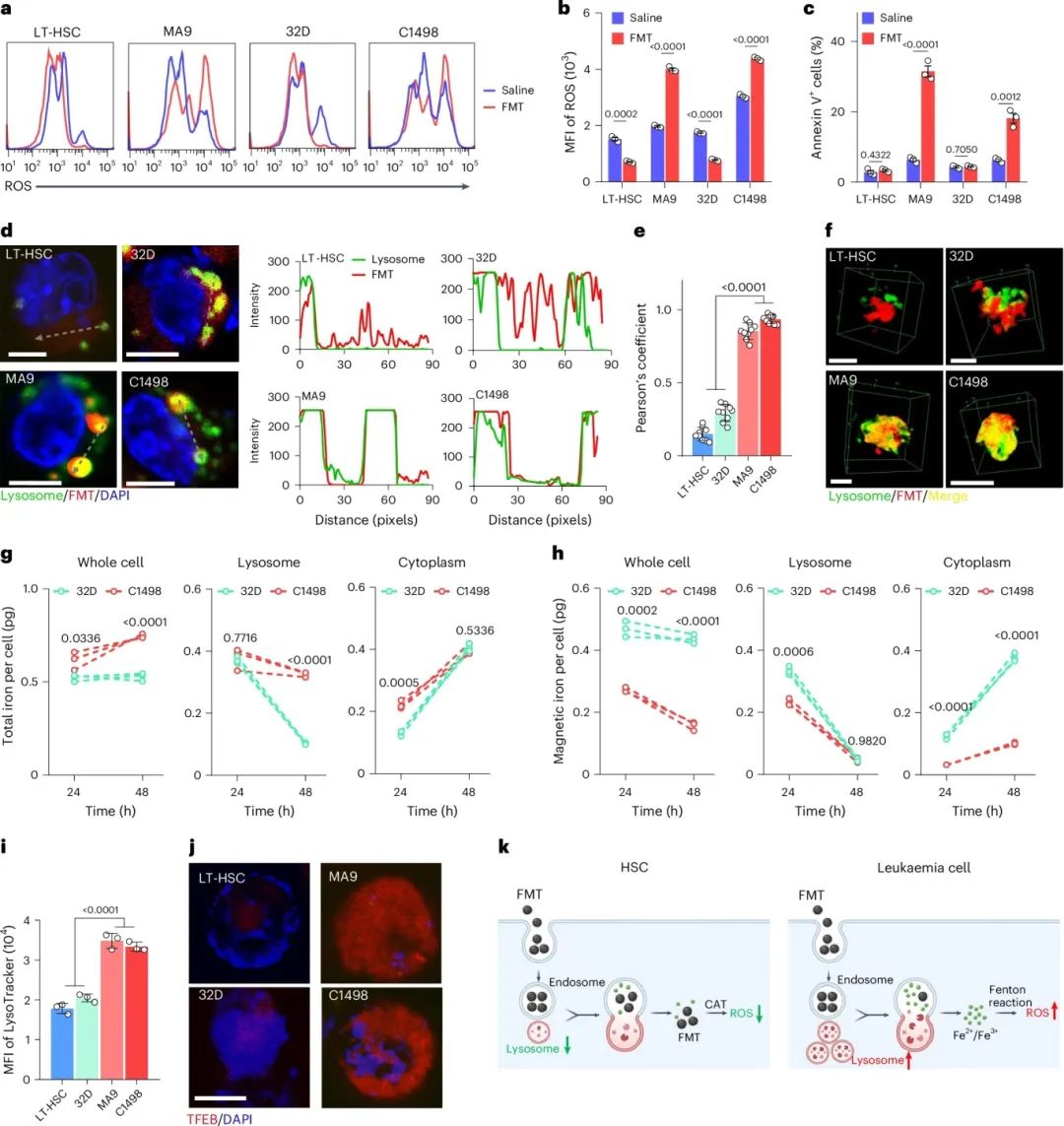
图1 FMT在HSC和AML细胞中的细胞毒性、细胞内分布和溶酶体降解。(a)LT-HSCs、MA9 AML细胞、32D和C1498在50 μg/ml FMT处理48小时后的ROS流式图;(b)LT-HSCs、MA9 AML细胞、32D和C1498在50 μg/ml FMT处理48小时后ROS的平均荧光强度(MFI);(c)LT-HSCs、MA9 AML细胞、32D和C1498在50 μg/ml FMT处理48小时后annexin V+细胞的平均荧光强度(MFI);(d)细胞孵育TRITC标记FMT 48小时后的荧光定位(FMT,红色;细胞核,蓝色;溶酶体,绿色),以及沿选定线的强度分布;(e)FMT和溶酶体之间的皮尔逊相关系数;(f)细胞孵育TRITC标记FMT 48小时后的FMT定位三维堆叠图像(FMT,红色;溶酶体,绿色;合并,黄色);(g)32D和C1498细胞总铁含量、溶酶体和胞浆中的总铁质量;(h)整个细胞、溶酶体和胞质中磁性铁含量的质量,针对32D和C1498;(i)LT-HSCs、MA9 AML细胞、32D和C1498中LysoTracker的MFI值;(j)LT-HSCs、MA9 AML细胞、32D和C1498中TFEB表达和分布的荧光可视化(TFEB,红色;核,蓝色);(k)示意图
(2)FMT提高体外培养HSC的造血能力
研究发现,接受造血干细胞移植(HSCT)患者的植入成功率和预后与移植的造血干细胞(HSC)数量和质量相关,而离体扩增是获取足够数量HSC的方法之一。然而,由于长期培养和活性氧(ROS)积累引起的氧化应激,体外扩增的HSC长期造血重建能力不可持续。FMT对长期培养的HSC具有ROS清除作用(图2a)。28天后,与对照组相比,FMT共培养使LSK细胞和表型LT-HSC数量分别增加2.6倍和4.5倍(图2b,c)。FMT处理后LT-HSC的ROS水平和凋亡率降低(图2d)。除铁蛋白轻链1(Ftl1)轻微上调外,FMT未引起主要铁代谢基因表达差异。系列竞争性移植测定显示,约86.5%的LT-HSC在移植前被FMT标记,且该比例在造血重建期间逐渐降低(图2e,f),但FMT标记的HSC中ROS水平显著降低(图2g)。初次移植期间,FMT共培养组的总体再增殖率增加(图2h),受体表现出更多供体来源的LSK细胞、LT-HSC和成熟谱系(图2i,j),以及更低的ROS水平(图2k)。二次移植中,FMT共培养组的供体来源细胞总体再增殖率和数量增加(图2l-n),这归因于供体来源LT-HSC中ROS水平降低(图2o)。第三次移植中,接受FMT共培养组遗传BM细胞的受体存活120天,而接受对照组BM细胞的受体在移植后6周内全部死亡(图2p)。这些数据表明,离体共培养与FMT处理可有效保护HSC免受ROS诱导的氧化应激和功能丧失。

图2 FMT共培养减轻ROS诱导的氧化应激并增强培养HSCs的长期再殖能力。(a)BM细胞与FMT共培养的示意图;(b)流式图,显示BM细胞与50 μg/ml FMT共培养14天和28天后的LSK及LT-HSC数量;(c)流式图及MFI,显示BM细胞与50 μg/ml FMT共培养28天后LT-HSCs的ROS水平;(d)多代竞争移植试验示意图;(e)流式图及MFI,显示LT-HSCs预移植或供体来源LT-HSCs在移植后8周和16周的FMT标记细胞;(f)流式图及MFI,显示FMT标记或未标记供体来源LT-HSCs在移植后16周的ROS水平;(g)初次受者PB中200个LT-HSCs在10天长的50 μg/ml FMT共培养后的供体嵌合情况;(h)供体嵌合成熟谱系及供体来源的LSK细胞和LT-HSC数量在移植后16周的骨髓中,来自初次受者的样本;(i)供体来源的LT-HSC在移植后16周的ROS流式图及MFI;(j)供体嵌合在二次受者的PB中;(k)供体嵌合成熟谱系及供体来源的LSK细胞和LT-HSC数量在移植后16周的骨髓中,来自二次受者的样本;(l)供体来源的LT-HSC在移植后16周的ROS流式图及MFI;(m)致命剂量照射的受者接受二次受者骨髓细胞后的Kaplan-Meier生存曲线
(3)FMT促进HSC损伤后的再生
研究发现,肿瘤患者接受大剂量化疗或放疗会严重损伤造血干细胞,破坏免疫系统,降低患者生存率。图3a展示了小鼠静脉注射5-FU的治疗方案。注射FMT显著延长了5-FU治疗小鼠的存活期(图3b)。在FMT注射小鼠的外周血中,白细胞和其他造血细胞的计数从第0天至第9天下降更慢,并从第9天至第60天恢复更快(图3c),表明HSC的再生。第8天分析显示,FMT处理小鼠的骨髓中有更多LSK细胞和LT-HSC(图3d),约86.3%的LT-HSC被FMT标记,且分布在细胞质中(图3e),其ROS水平降低(图3f)。因此,FMT显著降低了LT-HSC的ROS水平和细胞凋亡(图3g),对持续造血至关重要。竞争性再增殖试验表明,接受FMT处理小鼠的LT-HSC的小鼠具有更高的造血重建率(图3h,i),说明FMT通过降低5-FU处理后的ROS水平和细胞凋亡,再生功能性HSC。
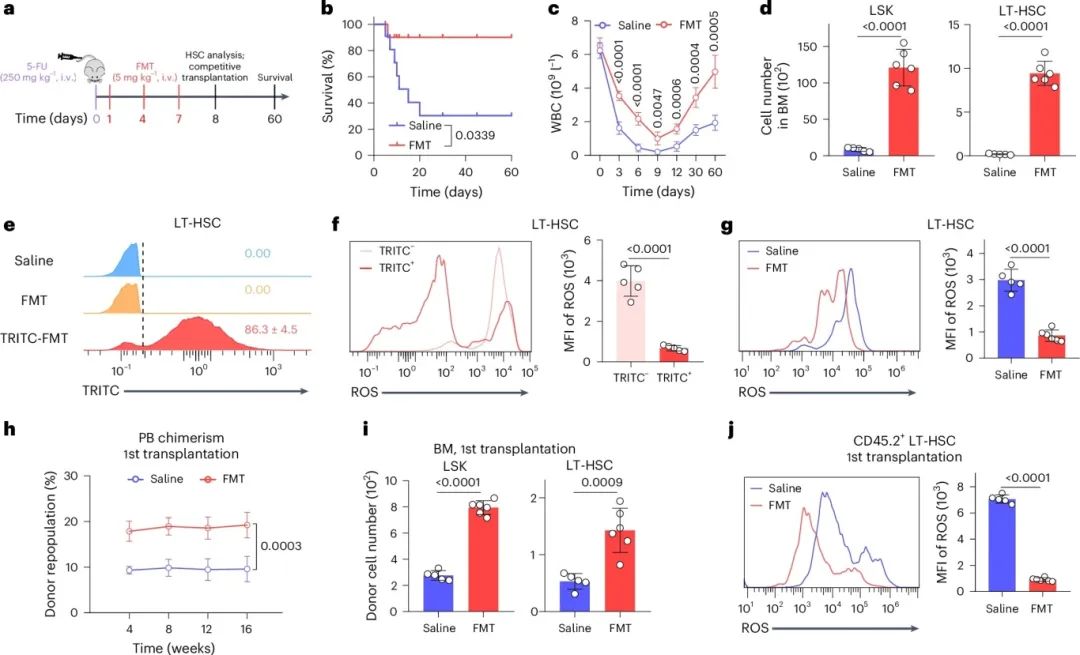
图3 FMT修复由5-FU和致死性TBI引起的造血损伤。(a)5-FU引起的造血损伤中FMT治疗的示意图(i.v.,静脉注射);(b)5-FU预处理小鼠的Kaplan-Meier生存曲线;(c)5-FU预处理小鼠的白细胞计数;(d)5-FU预处理第8天小鼠中的LSK细胞和LT-HSC数量;(e)5-FU预处理并接受FMT治疗第8天的小鼠中FMT标记的LT-HSC的流式图;(f)流式图及MFI,显示5-FU预处理并接受TRITC-FMT治疗第8天小鼠中FMT标记或未标记的LT-HSC中的ROS水平;(g)小鼠在第8天接受5-FU预处理后,LT-HSCs中ROS的流式图及MFI;(h)受者移植了从接受5-FU预处理的小鼠中分选出的200个LT-HSCs后,供体嵌合体在PB中的情况;(i)移植后16周供体来源LSK细胞和LT-HSCs的数量;(j)移植后16周供体来源LT-HSCs中ROS的流式图及MFI
为了进一步证实 FMT 在致死辐射诱导的骨髓消融后保护 HSC 和增强造血恢复中的潜在应用,对小鼠施用全身辐射(TBI),然后进行 FMT 治疗(图 4a)。7.5 戈伊 TBI 的单次剂量导致 24 天内的死亡,而用 FMT 处理的小鼠具有显著更长的存活期(图 4 b)。此外,PB 中的成熟造血细胞和 BM 中的 LT-HSC 通过 FMT 处理很好地恢复(图 4c、d)。FMT 分布在标记的 LT-HSC 的细胞质中,其显示出降低的 ROS 水平(图 4 e、f),并且 FMT 还显著降低 LT-HSC 的 ROS 水平和细胞凋亡(图 4g)。因此,HSC 的造血重建能力也得到恢复(图 4 h-j)。总的来说,这些结果表明,FMT 治疗有效地促进从药物和致命的辐射诱导的造血损伤的恢复。
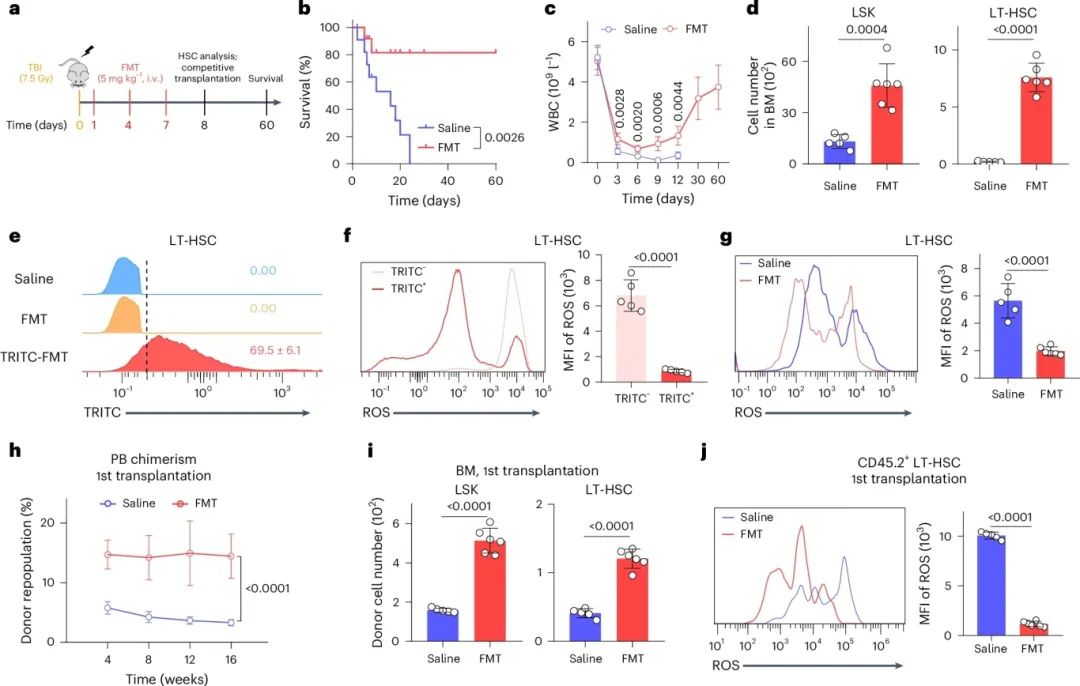
图4 FMT修复致命TBI引起的造血损伤。(a)FMT治疗在TBI引起的造血损伤中的示意图;(b)致命照射小鼠的Kaplan–Meier生存曲线;(c)致命照射小鼠的白细胞计数;(d)致命照射小鼠在第8天的LSK细胞和LT-HSC数量;(f)流式图及MFI,显示致死照射小鼠在第8天接受FMT标记或未标记的LT-HSC中的ROS水平;(g)小鼠在第8天接受致死性照射后,LT-HSCs中的ROS的流式图及MFI;(h)受体移植了从致死性照射小鼠中分选的200个LT-HSCs后,供体嵌合体在PB中的情况;(i)移植后16周供体来源LSK细胞和LT-HSCs的数量;(j)移植后16周供体来源LT-HSCs中的ROS的流式图及MFI
(4)FMT清除应激HSC中的H2O2
为探究FMT处理缓解应激HSC的机制,从5-FU处理小鼠中分选LT-HSC,提取RNA进行RNA-seq(图5a)。主成分分析将5-FU+盐水和5-FU+FMT小鼠与未处理对照小鼠区分开(图5b)。在5-FU处理的LT-HSC中,DNA损伤反应相关基因上调,造血、转录和蛋白质折叠相关基因下调,表明5-FU诱导HSC应激和造血损伤。分析5-FU+FMT与5-FU+盐水小鼠LT-HSC基因表达变化(图5c),发现FMT部分逆转基因表达,GO分析显示造血相关基因表达恢复(图5c)。GSEA显示,FMT处理后,响应5-FU的DNA复制、重组、修复和有丝分裂的上调基因下调,表明FMT减轻5-FU诱导的DNA损伤反应。5-FU诱导的DNA损伤反应与线粒体氧化呼吸相关,导致ROS积累和氧化应激,进而引起DNA损伤和造血损伤。FMT处理后,响应5-FU的电子传递链和线粒体呼吸链复合物I相关上调基因下调(图5d)。
将差异表达基因分为簇1和簇2(图5e),并分别进行GO分析(图5f)。簇1的GO分析显示,5-FU处理上调了对H₂O₂应答的基因,FMT处理后其表达水平降低(图5f,g)。H₂O₂对培养的HSC表现出剂量依赖性细胞毒性。用5μM H₂O₂预处理培养的HSC,减少HSC数量并诱导凋亡,随后用FMT或GSH处理细胞(图4h)。发现FMT显著去除细胞内H₂O₂(图5i,j),降低对H₂O₂应答基因的表达(图5k)。此外,FMT显著增加LSK细胞和LT-HSC数量,增强LT-HSC的集落形成能力并减少凋亡(图5l-n)。总之,FMT的CAT样活性可清除细胞内H₂O₂,减少H₂O₂诱导的DNA损伤和细胞毒性,促进造血损伤的HSC再生。
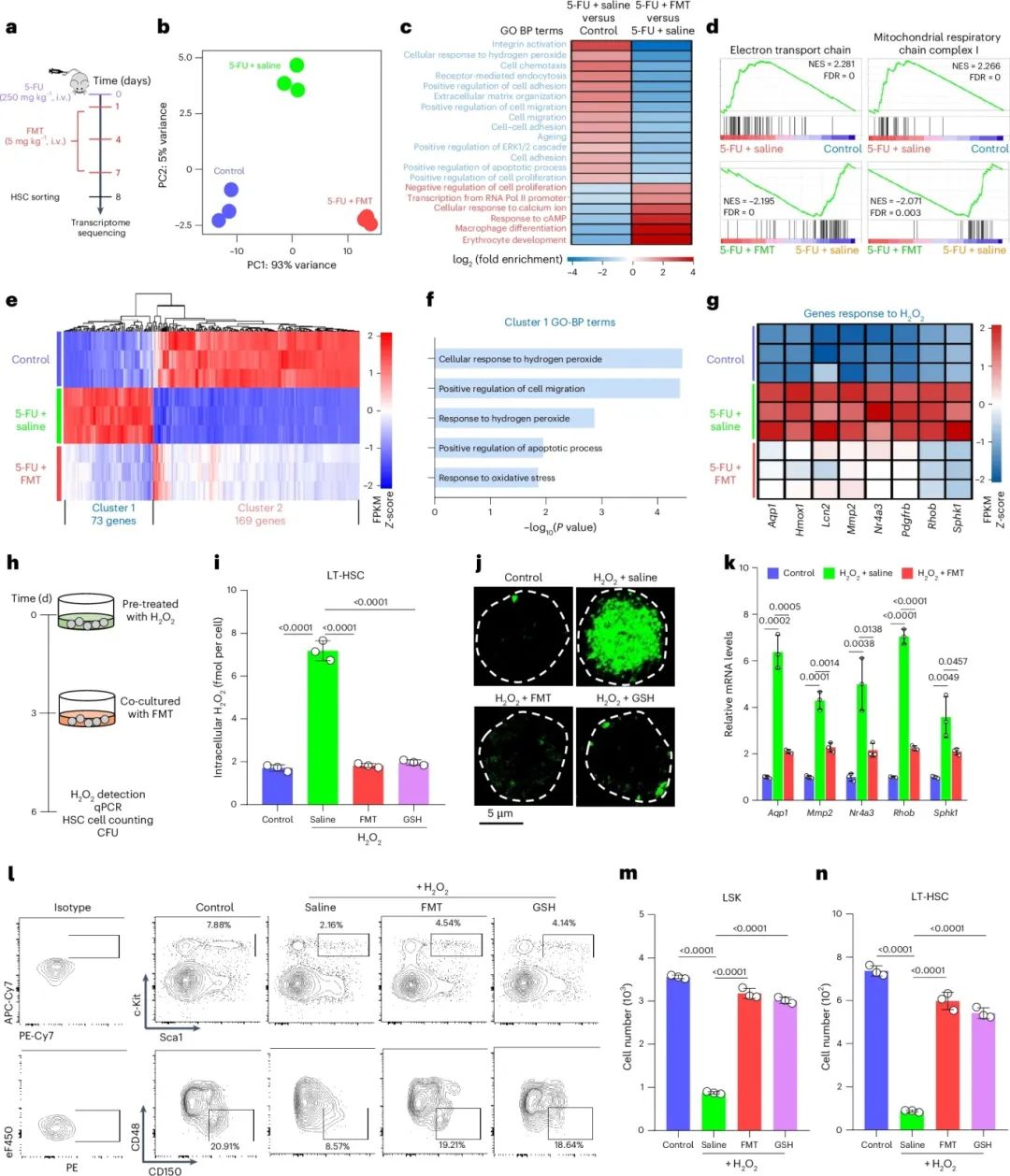
图5 RNA-seq显示FMT能清除应激HSC中的过氧化氢。(a)图示,来自预先用5-FU预处理的小鼠骨髓细胞中分离出的LT-HSCs的RNA-seq数据;(b)主要成分分析,来自预先用5-FU预处理的小鼠骨髓细胞中分离出的LT-HSCs的RNA-seq数据;(c)GO生物过程术语分析,比较5-FU与生理盐水对照组和5-FU与FMT对照组差异表达基因;(d)5-FU与生理盐水对照组和5-FU与FMT对照组差异表达基因的GSEA富集图,NES为归一化富集分数,FDR为错误发现率,统计检验为单侧检验,并进行了多重比较校正;(e)三组间差异表达基因的表达热图;(f)簇1中差异表达基因的GO生物过程术语分析,统计检验为单侧检验,并进行了多重比较校正;(g)三组间过氧化氢反应基因的表达;(h)小鼠骨髓细胞中过氧化氢预处理和FMT共培养的示意图;(i)PBS-、50 μg/ml FMT-或50 μg/ml GSH-共培养的骨髓细胞中LT-HSCs的胞内过氧化氢含量,经5 μM过氧化氢预处理;(j)从PBS-、50 μg/ml FMT-或50 μg/ml GSH-共培养的骨髓细胞中分离出的LT-HSCs的过氧化氢荧光成像,经5 μM过氧化氢预处理;(k)从PBS-或50 μg/ml FMT-共培养的骨髓细胞中分离出的LT-HSCs的过氧化氢反应基因mRNA表达,经5 μM过氧化氢预处理;(l)代表性流式图,显示PBS-、50 μg/ml FMT-或50 μg/ml GSH-共培养的骨髓细胞中LSK细胞和LT-HSCs的数量,经5 μM过氧化氢预处理;(m)PBS-、50 μg/ml FMT-或50 μg/ml GSH-共培养的骨髓细胞中LSK细胞的数量,经5 μM过氧化氢预处理;(n)PBS-、50 μg/ml FMT-或50 μg/ml GSH-共培养的骨髓细胞中LT-HSCs的数量,经5 μM过氧化氢预处理
(5)FMT促进移植HSC的再生
研究发现,FMT在恢复应激HSC中具有潜在治疗益处,并能改善AML小鼠中HSCT的疗效。AML小鼠接受8.5 Gy致死剂量TBI作为HSCT预处理方案,照射后24小时进行HSCT,并在移植后施用FMT六次(图6a)。4周后,对照和FMT处理小鼠的PB、BM和脾脏中几乎检测不到白血病细胞,且PB中成熟血细胞在移植后4周内逐渐恢复(图6b)。FMT处理小鼠的PB血细胞在第15天恢复更快(图6b),28天内寿命延长。第28天分析显示,FMT处理小鼠的BM中总细胞、MPP、LSK细胞和LT-HSC数量增加(图6c、d),LT-HSC的细胞内H₂O₂含量、ROS水平和凋亡减少(图6e)。
为评估FMT处理后移植HSC的长期再生能力,进行二次移植(图6a)。与对照组相比,接受FMT处理小鼠LT-HSC的受体总体再增殖率和供体来源成熟谱系显著增加(图6f,g)。FMT处理组120天内存活小鼠数量(6只)高于对照组(6只中的4只),尽管存活曲线无统计学显著差异。FMT处理后,二次移植HSC的H₂O₂和ROS浓度及凋亡显著降低(图6h和扩展数据图7i,j),供体来源LSK细胞和LT-HSC数量增加(图6i)。第三次移植显示,与对照组相比,FMT治疗组受体小鼠寿命显著延长(图6j)。结果表明,FMT治疗在AML的预处理桥接HSCT治疗中维持了移植HSC的长期造血能力。
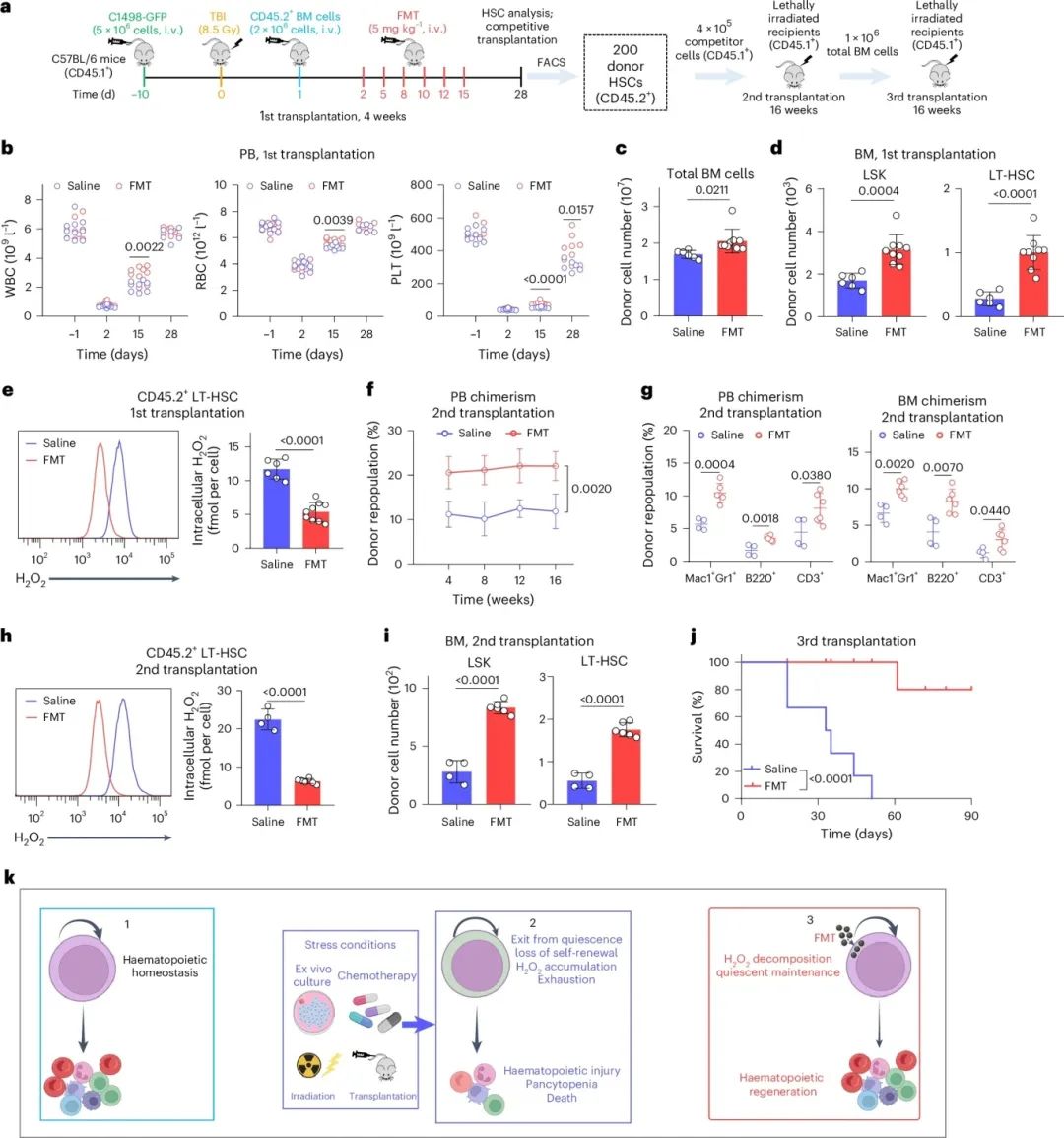
图6 FMT增强了TBI预处理的AML小鼠中移植HSCs的长期再生能力。(a)AML小鼠经TBI预处理和HSCT后接受FMT治疗的示意图;(b)TBI预处理的AML小鼠在不同移植日后的白细胞、红细胞和血小板计数;(c)第28天小鼠骨髓中的总骨髓细胞数,生理盐水组和FMT组;(d)第28天小鼠骨髓中的LSK和LT-HSC数量,生理盐水组和FMT组;(e)第28天小鼠LT-HSCs中胞内过氧化氢的流式图及定量分析,生理盐水组和FMT组;(f)次级受者移植后16周时供体嵌合体在PB中的比例;(g)次级受者移植后16周时成熟谱系在PB和骨髓中的比例;(h)二次移植后16周次级受者LT-HSCs中细胞内过氧化氢的流式图及定量分析,生理盐水组和FMT组;(i)二次移植后16周次级受者骨髓中供体来源LSK细胞和LT-HSCs的数量;(j)接受次级受者骨髓细胞的致死剂量照射受者的Kaplan-Meier生存曲线;(k)示意图
该研究应用了四种不同的应激条件,包括体外培养、化疗、致死剂量的TBI以及HSCT前的预处理,以展示FMT治疗在分解细胞内过氧化氢和促进造血再生方面的潜力。这些数据表明,FMT能有效减轻压力下造血干细胞的活性氧和凋亡,并促进损伤后的造血再生,这归因于其类似CAT的活性。作者还研究了FMT在体内保留造血干细胞的同时治疗低FPN表达的急性髓系白血病的潜在应用。更广泛地说,本研究增进了纳米酶在造血再生中作用的理解,并强调了FMT在压力条件下促进患者造血系统恢复的潜在临床应用。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

