
脊髓损伤导致中枢神经系统(CNS)严重创伤,引发持续的运动、感觉和自主神经功能障碍。SCI后,损伤部位会经历氧化应激(活性氧 ROS 积累)和过度炎症反应,破坏神经元微环境,导致二次神经元丢失。CNS的再生能力有限,内源性神经干细胞祖细胞(eNSPCs)的激活和分化不足,且易向胶质细胞(如星形胶质细胞)分化,形成胶质瘢痕,阻碍轴突再生。目前缺乏有效的 SCI 治疗策略。瘫痪和神经性疼痛等并发症会影响SCI患者的生活质量,并给社会造成沉重负担。

针对上述问题,山东大学齐鲁医学院先进医学研究院冯世青教授研究开发了一种温度响应性透明质酸共轭水凝胶-聚多巴胺纳米颗粒(PDA NPs)结合人间充质干细胞(hMSCs)移植(HPM水凝胶),PDA NPs修饰的水凝胶通过桥接神经组织刺激干细胞的粘附和生长,减轻炎症并促进 eNSPC 神经元分化,协同促进脊髓损伤后的神经再生与功能恢复。用PDA NPs处理的小胶质细胞可将细胞内ROS水平降低65%,并抑制炎性细胞因子如IL-1β(降低35%)和IL-6(降低23%)的表达,从而减轻小胶质细胞的炎症反应。此外,H-P-M水凝胶结合hMSCs移植可以将eNSPCs募集到损伤部位。RNA-seq揭示了H-P-M水凝胶通过MAPK通路促进eNSPCs神经元分化的潜力。该文章于2024年9月27日以《Synergistic restoration of spinal cord injury through hyaluronic acid conjugated hydrogel-polydopamine nanoparticles combined with human mesenchymal stem cell transplantation》为题发表于《Bioactive Materials》(DOI:10.1016/j.bioactmat.2024.09.027)。
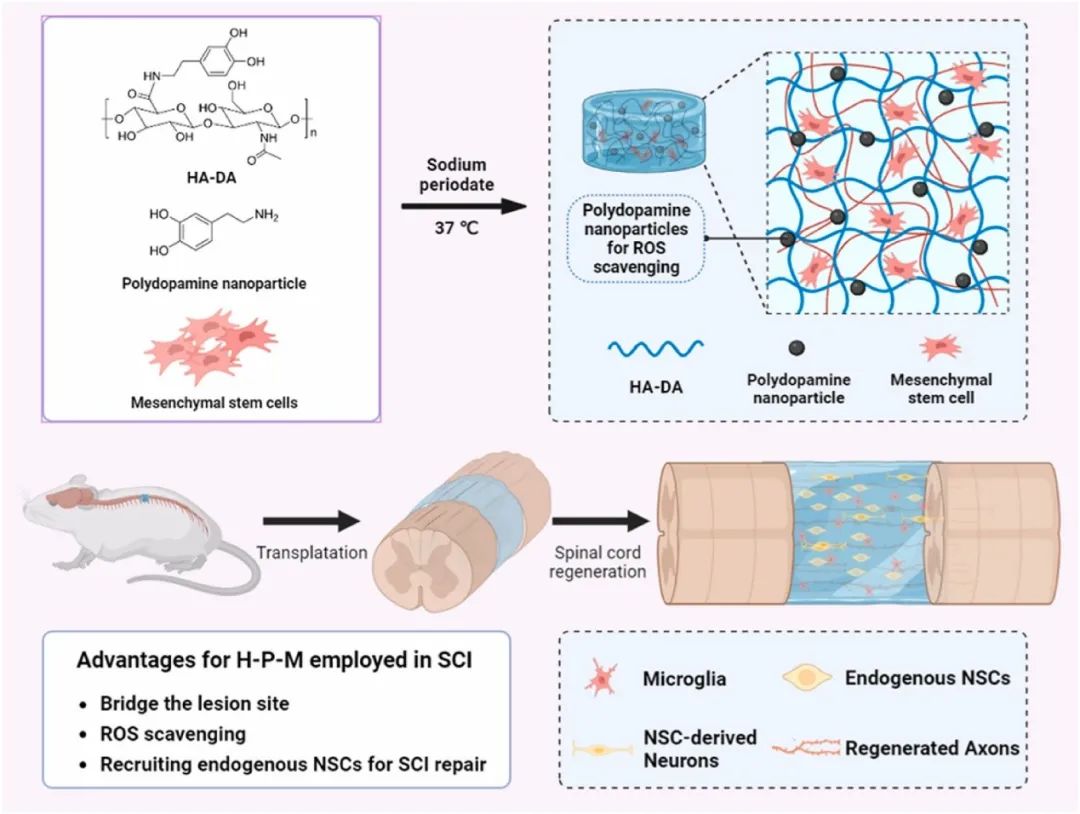
图1 用于 SCI 修复的多功能水凝胶支架的制备和使用示意图
(1)PDA NP修饰水凝胶的制备和表征
PDA NP 掺杂水凝胶的制备过程如图 2A 所示。HA-DA 通过引入多巴胺基团增强粘附性能,其结构经1H NMR(图 2C)和 FTIR(图 2D)验证:HNMR 在 6.7 ppm 处出现新峰,FTIR 在 1730 cm⁻¹处出现新的峰,表明多巴胺成功接枝。PDA NPs 呈球形,直径 230 nm(图 2B),通过与 HA-DA 混合并用 NaIO₄交联制备水凝胶(图 2E)。SEM 显示水凝胶具有均匀多孔网络(图 2F)。流变仪测试显示,水凝胶在 1-500 s 内 G′和 G″稳定,添加 PDA NPs 和 hMSCs 后,HA-DA 水凝胶 G′显著增加至 370.3 ± 1.5 Pa,接近脊髓组织(图 2G)。HA-DA 水凝胶对小鼠脊髓组织的粘附力显著高于 HA 水凝胶(1.6 N 对 0.6 N,图 2H)。
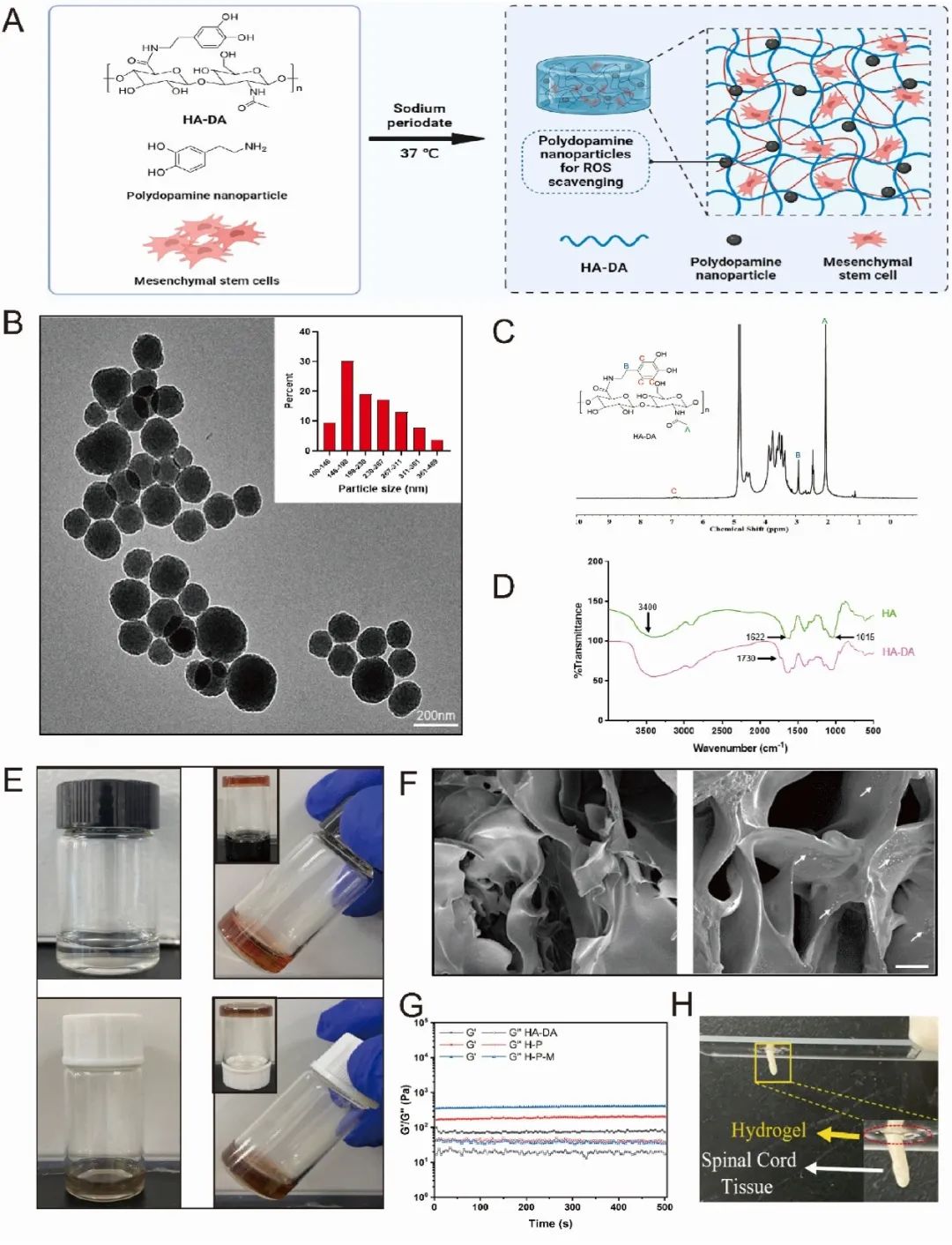
图2 PDA NP修饰水凝胶的制备和特性。(A)热敏PDA NP修饰的HA水凝胶的凝胶化示意图;(B)PDA NP的透射电子显微镜(TEM)图像;(C)HA-DA的核磁氢谱(¹H NMR);(D)FTIR振动显示了HA和HA-DA分子的吸收峰;(E)37°C下含或不含PDA NPs的HA-DA的凝胶化行为;(F)HA-DA水凝胶的扫描电子显微镜(SEM)图像(白色箭头表示PDA NPs的存在);(G)HA-DA、H-P和H-P-M水凝胶的储能模量(G')和损耗模量(G'');(H)水凝胶粘附到脊髓组织的直接视图
(2)PDA NP 修饰水凝胶的生物相容性
流式细胞术显示 hUC-MSCs 表达 CD73、CD90 和 CD105 的阳性率分别为 99.93%、99.98% 和 99.98%,未检测到造血干细胞标志物 CD34 和 CD45(图 3A)。hUC-MSCs 具有成骨、成脂和成软骨的三系分化能力(图 3B-D)。细胞增殖实验表明,PDA NPs 浓度为 50 μg/ml 时对 hMSCs 有显著细胞毒性(图 3E)。Live/Dead 染色显示 50 μg/ml 组活细胞减少,但未见显著细胞死亡,表明高浓度 PDA NPs 抑制细胞增殖(图 3F)。体内实验中,将载 hMSC 的 PDA NP 修饰水凝胶(H-P-M 水凝胶)注射到小鼠脊髓组织中,8 周后,肝肾功能血液检查未发现功能受损指标显著升高(图 3H),且主要器官未见病理变化(图 3G),说明 H-P-M 水凝胶无体内毒性。
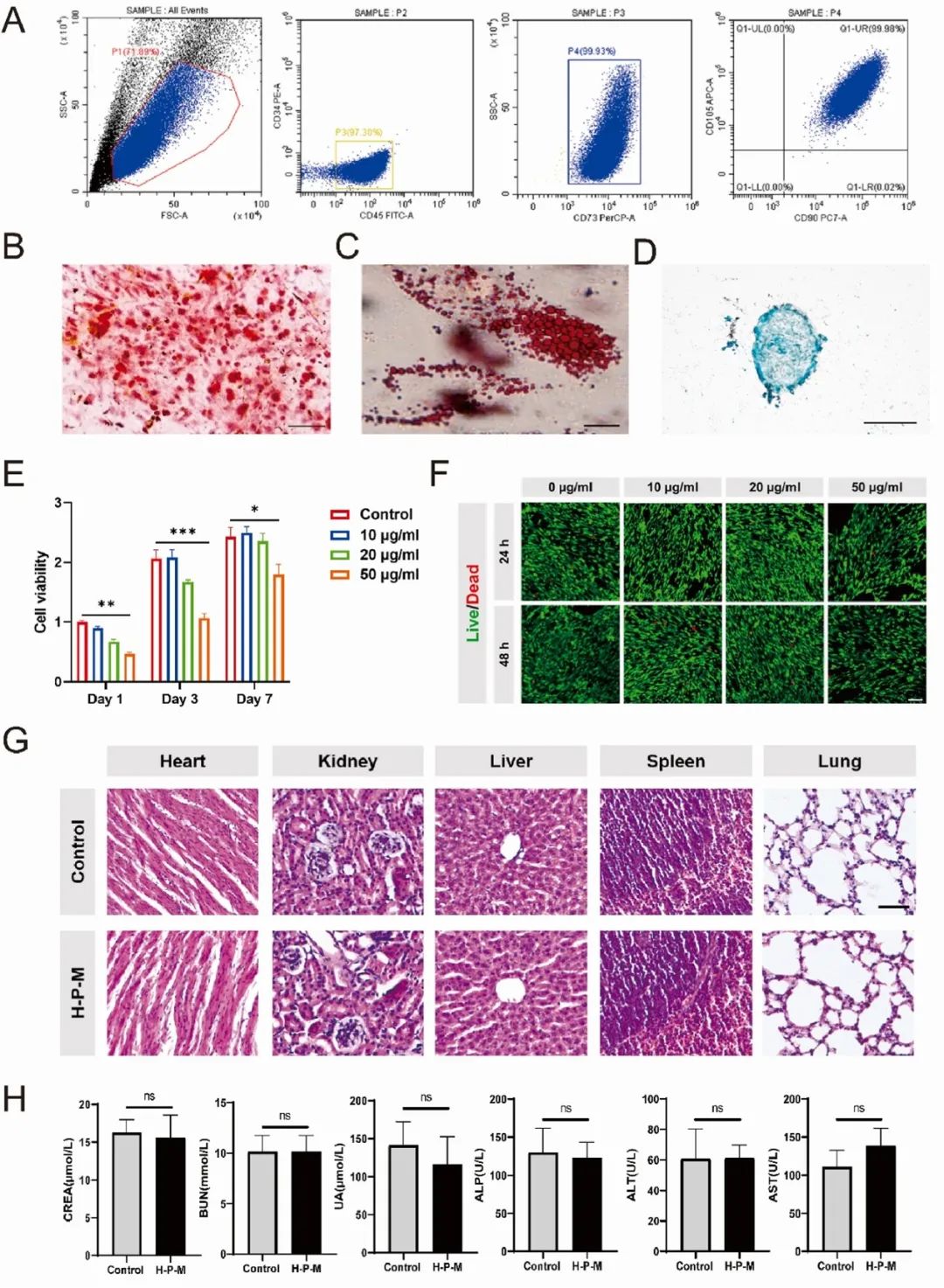
图3 PDA NPs的生物相容性和生物毒性。(A)通过流式细胞术鉴定hUC-MSCs中CD34、CD45、CD73、CD90和CD105的表面标志物;(B)茜素红染色评估成骨分化能力;(C)油红染色评估成脂分化能力;(D)阿尔新蓝染色评估软骨形成分化能力;(E)使用CCK8测定法评估不同浓度PDA NPs处理后1、3和7天hUC-MSCs的细胞活力;(F)用不同浓度的PDA NPs处理后1天和2天对hUC-MSCs进行活/死染色,活细胞由钙黄绿素染色(绿色)表示,死细胞由PI染色(红色)表示;(G)小鼠水凝胶植入后8周心脏、肾脏、肝脏、脾脏和肺的H&E染色图像;(H)小鼠H-P-M水凝胶植入后8周肝肾功能指标(CERA/BUN/UA/ALP/ALT/AST)
(3)H-P-M 水凝胶促进了 NSPCs 在体外分化为神经元
为了验证水凝胶清除 ROS 的能力,LPS 处理的 BV2 细胞在不同浓度 PDA NPs 下培养 24 小时后,细胞内 ROS 水平显著降低:10、20 和 50 μg/ml PDA NP 处理分别降低 52%、65% 和 75%(图 4A-B)。此外,20 μg/ml PDA NP 处理可使 BV2 细胞中炎症因子 IL-6 和 IL-1β 的 mRNA 水平分别降低 23% 和 35%(图 4C-D)。结果表明,20 μg/ml PDA NPs 可有效清除细胞内 ROS 并降低促炎因子水平。进一步实验中,载 hMSC 的 PDA NP 修饰水凝胶(H-P-M 水凝胶)用于神经球形成实验。7 天后,共培养的原代 NSPC 和水凝胶负载的 hMSC 中,Tuj1 mRNA 和蛋白表达分别增加 2.71 倍和 1.03 倍,GFAP 降低 0.44 倍和 0.39 倍,MAP2 mRNA 表达增加 2.46 倍,表明神经元分化增强(图 4E-J)。
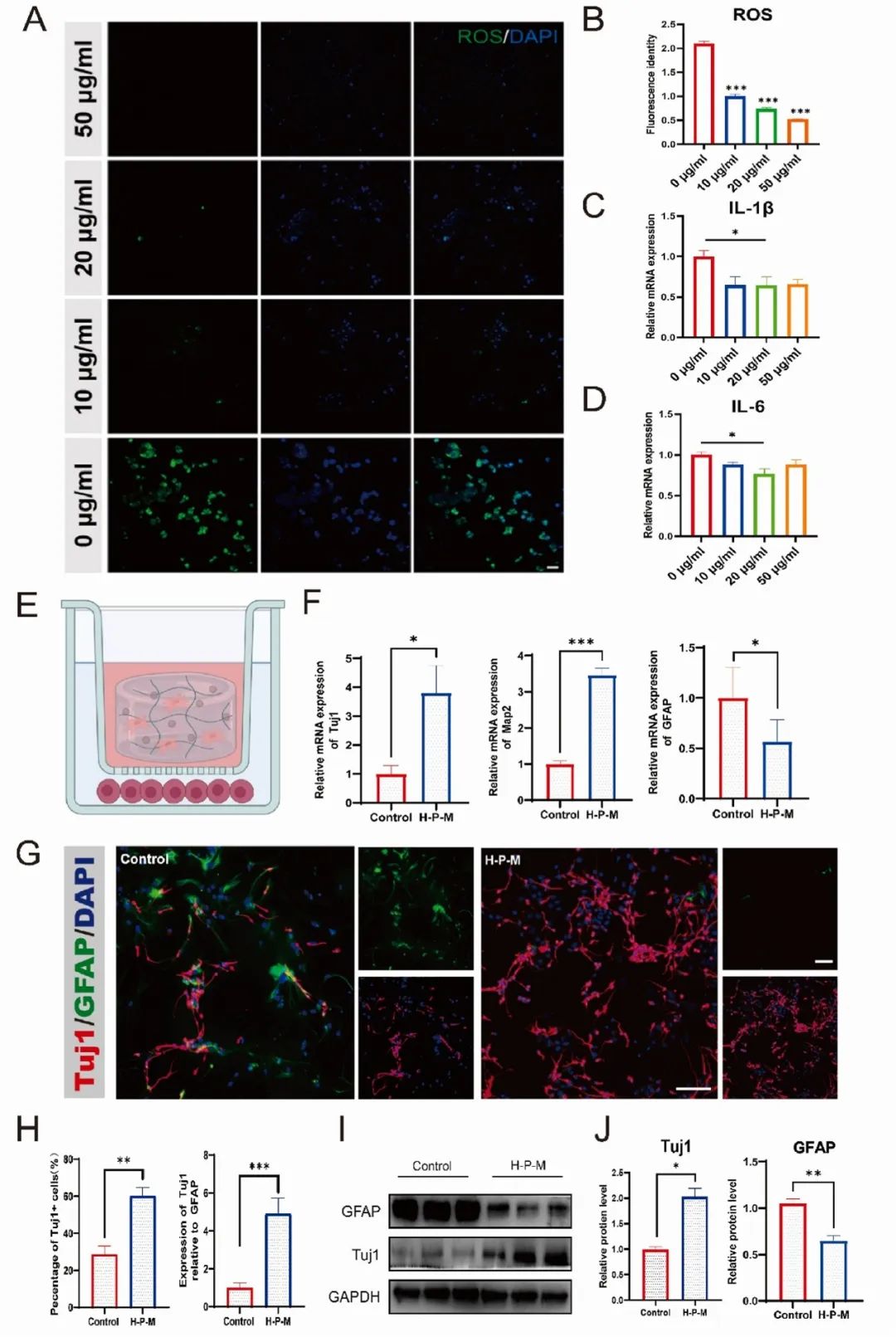
图4 验证H-P-M水凝胶在体外降低ROS并促进NSPC神经元分化。(A)LPS诱导的炎性BV2细胞中ROS的清除活性,用不同浓度(0 μg/ml、10 μg/ml、20 μg/ml、50 μg/ml)的PDA NPs处理1天,ROS(绿色),DAPI(蓝色);(B)DCFH-DA检测LPS诱导的BV2细胞中的ROS水平;LPS诱导的BV2细胞中(C)IL-1β(n = 3)和(D)IL-6(n = 3)的mRNA表达;(E)小鼠NSPCs和H-P-M水凝胶共培养示意图;(F)与或不与H-P-M水凝胶共培养7天后Tuj1、MAP2和GFAP的mRNA表达;(G)NSPCs与或无H-P-M水凝胶共培养7天的GFAP和Tuj1表达的代表性图像,比例尺:50 μm;(H)(G)的定量分析;(I和J)Western blot图像显示与或不与H-P-M水凝胶共培养7天的NSPC的GFAP和Tuj1的蛋白表达及定量分析
(4)H-P-M 水凝胶诱导 SCI 后 5-HT 轴突再生并促进运动功能恢复
为了研究 H-P-M 水凝胶在体内的治疗效果,手术后立即将其注射到病变部位(图 5A)。HE 染色显示,H-P-M 水凝胶处理 8 周后病灶面积显著减少(图 5B),且该组表现出强健的 5-HT 轴突再生,而 SCI 组未观察到(图 5C)。动物行为和电生理学测试表明,H-P-M 水凝胶可显著改善 SCI 小鼠的运动功能恢复。BMS 评分和步态分析显示,治疗后 8 周,H-P-M 水凝胶组的 BMS 评分显著高于 SCI 组(图 5D)。MEP 记录也证实,H-P-M 水凝胶组的 MEP 振幅显著改善(图 5E)。此外,足迹记录分析显示,H-P-M 水凝胶组的后肢运动能力优于 SCI 组(图 5F)。这些结果表明,H-P-M 水凝胶可有效促进 SCI 后的运动功能恢复。
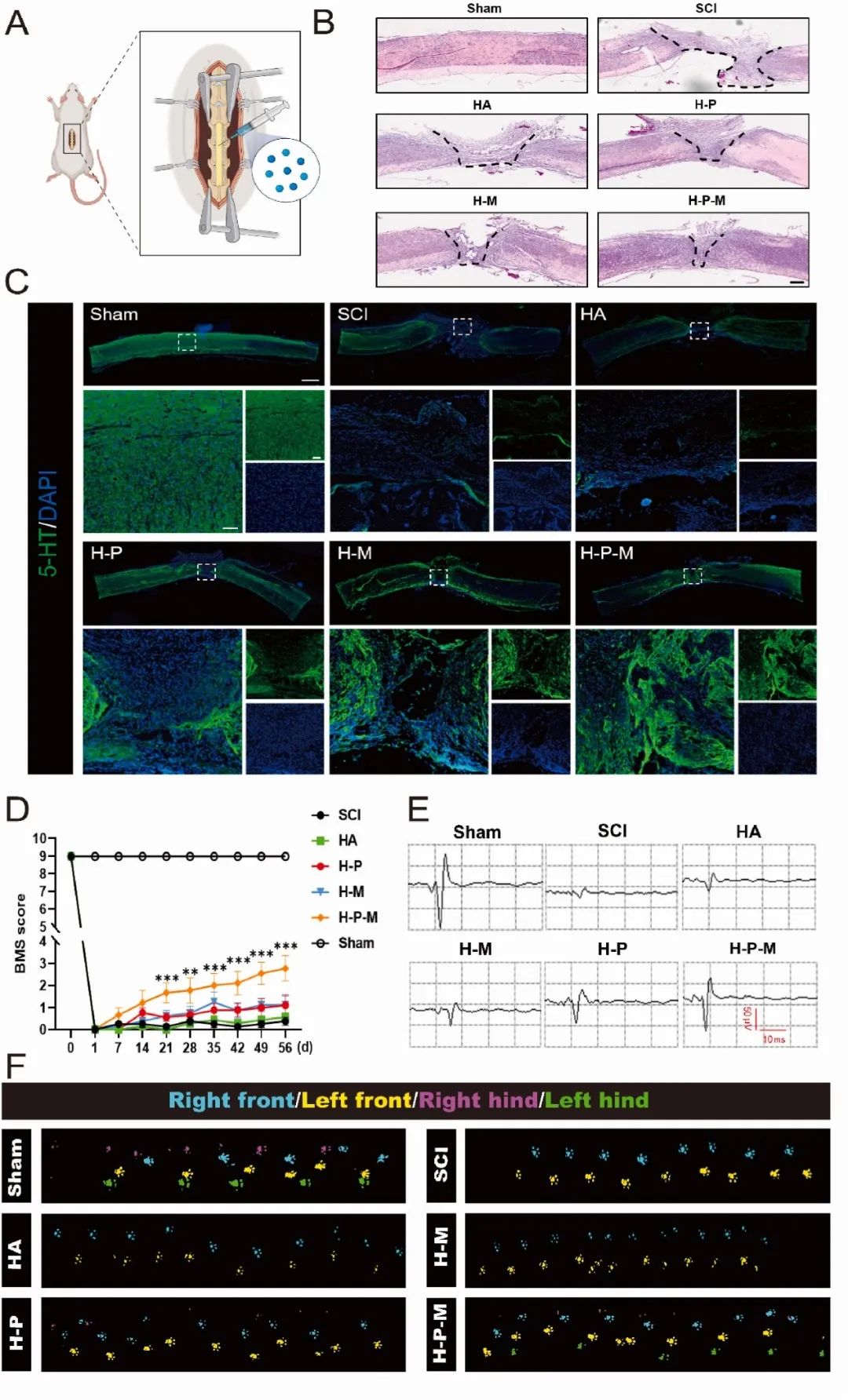
图5 H-P-M水凝胶诱导SCI小鼠5-HT轴突再生并促进运动功能恢复。(A)脊髓横断手术和水凝胶注射示意图;(B)不同治疗组HE染色脊髓切片的代表性图像;(C)水凝胶注射后8周脊髓切片5-HT染色的代表性图像;(D)SCI后不同治疗组的BMS评分(Sham n = 8,SCI n = 8,HA n = 7,H-P n = 9,H-M n = 8,H-P-M n = 9);(E)水凝胶注射后8周不同治疗组MEPs的代表性图像;(F)水凝胶注射后8周不同治疗组足迹的代表性图像
(5)在横断的 SCI 小鼠中,H-P-M 水凝胶表现出减轻炎症反应并促进 eNSPCs 分化为功能性神经元的能力
为了研究 H-P-M 水凝胶对 eNSPCs 募集和分化的影响,使用 Nestin 谱系示踪小鼠追踪受伤脊髓中的 eNSPCs。结果显示,86% 的 Ki67⁺ eNSPCs 在 SCI 后被 tdTomato 标记(图 6D)。与 SCI 组相比,H-P-M 组在损伤中心观察到更多 tdTomato⁺ eNSPCs 积累,且损伤周围区域的 eNSPCs(128.8 ± 6.83 个细胞/mm²)和 Ki67⁺ eNSPCs(58.6 ± 8.14 个细胞/mm²)显著增加(图 6E-G),表明 H-P-M 水凝胶可有效募集 eNSPCs。GFAP、Tuj1 和 Syn1 染色显示 tdTomato⁺ eNSPCs 与神经元标志物 Tuj1 和突触前标志物 Syn1 共定位,表明募集的 eNSPCs 可分化为功能性神经元并整合到神经回路中(图 6H-I)。RNA-seq 数据显示,H-P-M 水凝胶处理组在伤后 7 天有 9160 个差异表达基因(DEGs),其中 5079 个上调,4081 个下调(图 6A)。前 10 个上调的生物过程包括突触组织、神经递质转运和突触可塑性调节,表明神经发生和突触活性增强(图 6A-B)。热图显示神经元标志物(Tubb3、Map2、NeuN)、运动神经元标志物(Chat)和突触小泡标志物(Syp、Snap25)显著上调(|倍数变化|>5,p<0.05),进一步证实神经发生和神经元活性增强(图 6C)。KEGG 富集分析表明,H-P-M 水凝胶通过正向调节 MAPK 信号通路促进 eNSPCs 神经元分化。H-P-M 组中 p-ERK 和 p-JNK 分别增加 2 倍和 3.1 倍(图 6J)。
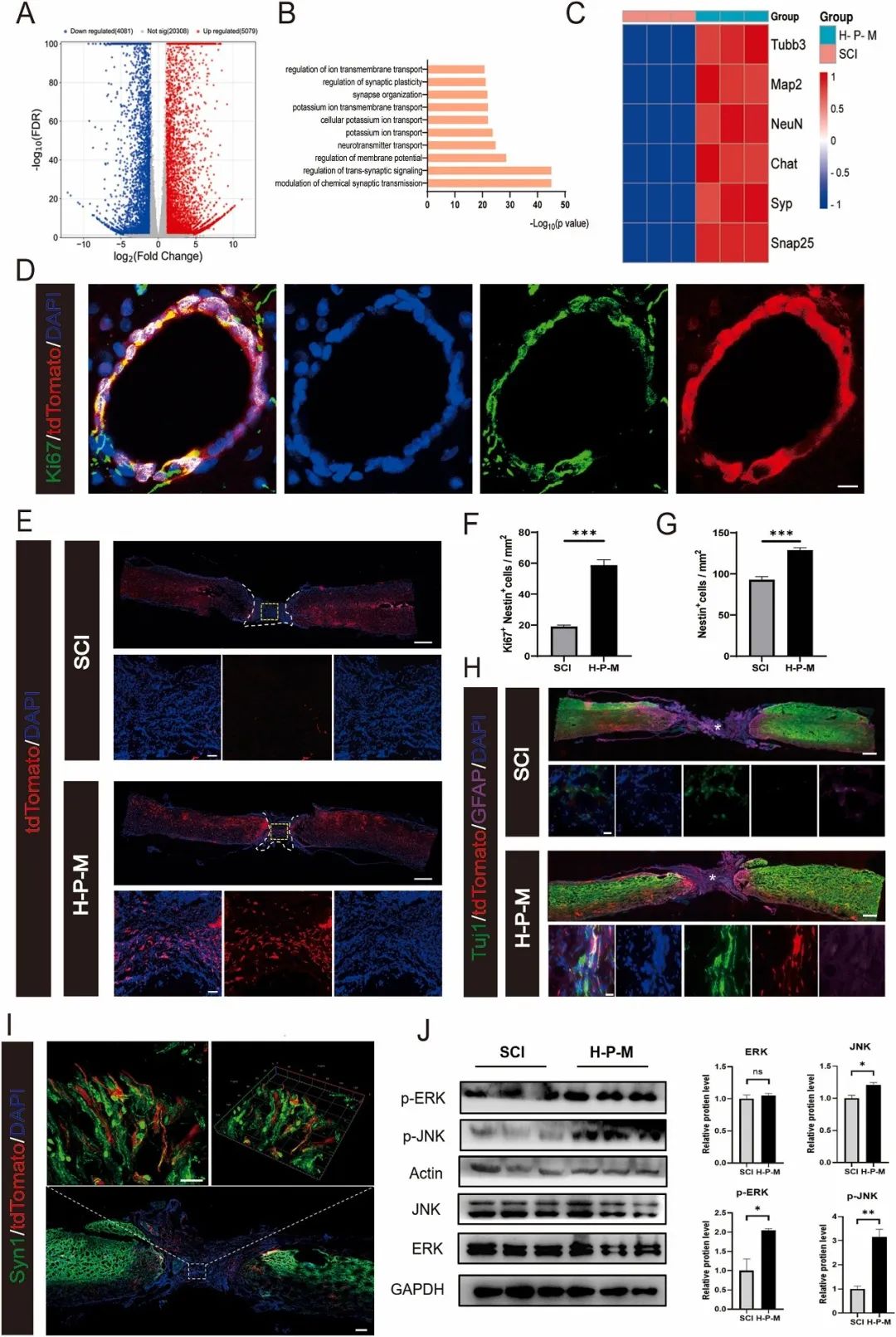
图6 H-P-M水凝胶将eNSPCs募集到损伤部位并促进神经元分化以进行SCI修复。(A)DEGs的结果(FDR < 0.05)由火山图显示;(B)展示了来自上调的DEGs的显著富集的生物过程(BPs);(C)参与神经元分化(Tubb3、Map2、NeuN和Chat)和突触形成(Syp和Snap25)的关键基因的热图;(D)代表性荧光图像显示SCI后Nestin谱系示踪小鼠脊髓切片的Ki67染色,eNSPCs用tdTomato(红色)标记,每组中的细胞核用DAPI(蓝色)标记;(E)代表性荧光图像显示SCI小鼠病灶部位用tdTomato(红色)标记的eNSPC的募集,每组中的细胞核用DAPI(蓝色)标记;(F-G)在水凝胶注射后8周,对损伤部位周围Nestin eNSPCs和Ki67以及Nestin增殖的eNSPCs进行定量;(H)代表性荧光图像显示水凝胶注射后8周脊髓切片的Tuj1和GFAP染色,eNSPCs用tdTomato(红色)标记,每组中的细胞核用DAPI(蓝色)标记;(I)代表性荧光图像显示水凝胶注射后8周脊髓切片的Tuj1和Syn1染色,eNSPCs用tdTomato(红色)标记,每组中的细胞核用DAPI(蓝色)标记;(J)Western blot图像和定量显示JNK、ERK、p-JNK和p-ERK的蛋白表达
GO term 和 GSEA 显示免疫细胞迁移、炎症反应和细胞因子产生下调,特别是 iNOS、IL-1β 和 IL-6 的炎症因子显着下调(|倍数变化|>5 和 p < 0.05),表明 H-P-M 水凝胶注射后炎症反应减轻(图 7A-C)。此外,IBA1 阳性小胶质细胞的促炎因子 iNOS 降低了 39%,而抗炎因子 Arg1 增加了 79%,表明 H-P-M 水凝胶组的炎症反应减轻(图 7D-E)。这些发现表明,H-P-M 水凝胶通过 PDA NPs 的抗炎特性有效抑制原发性机械损伤后的继发性炎症反应,这有助于轴突再生和运动功能恢复。
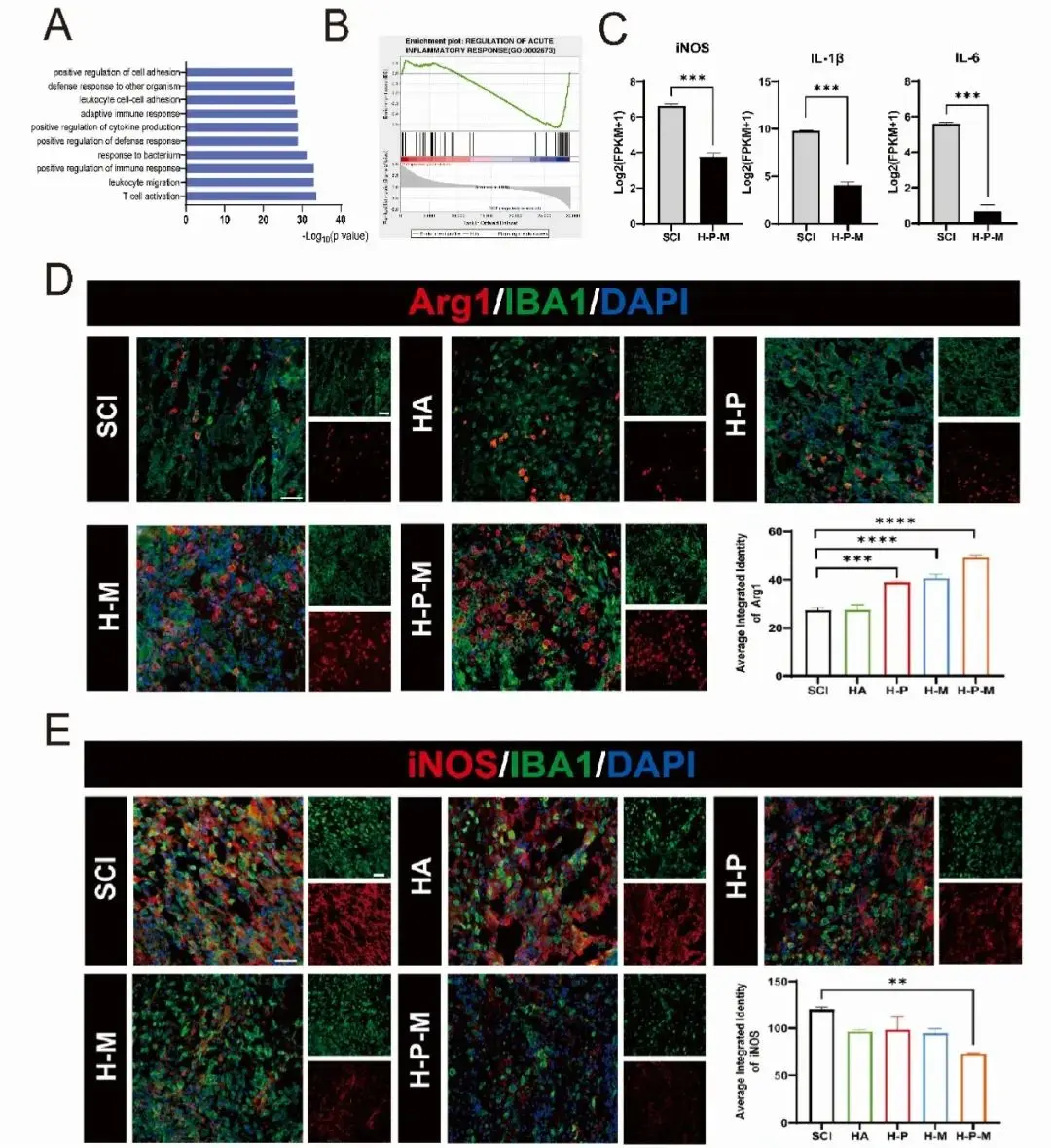
图7 H-P-M水凝胶可减少SCI小鼠促炎因子的释放和小胶质细胞的炎症反应。(A)展示了来自下调的DEGs的显著富集的生物过程(BPs);(B)急性炎症反应基因集的GSEA分析;(C)参与炎症反应的关键基因表达,包括iNOS、IL-1β和IL-6;(D)代表性荧光图像和定量分析显示水凝胶注射后1周每组脊髓切片的Arg1(红色)和IBA1(绿色)染色,每组中的细胞核用DAPI(蓝色)标记;(E)代表性荧光图像和定量分析显示水凝胶注射后1周每组脊髓切片的iNOS(红色)和IBA1(绿色)染色,每组中的细胞核用DAPI(蓝色)标记
该研究针对 SCI 的复杂病理机制,设计了一种多功能水凝胶系统(H-P-M 水凝胶),通过整合透明质酸 - 多巴胺水凝胶(HA-DA)、聚多巴胺纳米颗粒(PDA NPs)及人间充质干细胞(hMSCs),旨在通过多维度协同策略,协同调控氧化微环境、促进内源性神经干细胞祖细胞(eNSPCs)分化及修复神经环路。结合材料工程与细胞治疗,同步调控氧化应激、炎症反应及神经再生,为 SCI 治疗提供了新范式。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

