
协同融合生物力学、生物源性和生物电特性的生物材料,为构建与组织真实、无缝且多功能的生物界面提供了可能性。特别是,生物电子学已经成为捕捉生理信号、监测炎症用于诊断,以及执行靶向治疗的重要工具。然而,传统生物电子学面临的主要挑战在于其与生物组织的整合,主要源于机械、化学和生物特性之间的差异。机械性能的不匹配会导致界面的不连续性,进而影响信号传递的准确性。虽然水凝胶作为中间层在电子系统与生物系统之间起到了桥梁作用,但在满足组织功能调节所需的细胞活性方面可能存在不足。因此,当前生物电子学在炎症监测应用中缺乏同步免疫调节的生物源特性,这一局限性削弱了其在应对多种复杂疾病时的多功能潜力。

针对上述问题,美国芝加哥大学田博之、岳继平团队与来自美国罗格斯大学牛思淼团队提出了一种主动生物集成活体电子平台(ABLE平台),ABLE平台的多功能性源于生物特性、生物力学和生物电特性之间的协同作用。该水凝胶由明胶和木薯淀粉构成双网络结构,其中明胶作为蛋白基质,具有天然来源和优异的成胶性能,木薯淀粉通过糊化和回生处理释放直链淀粉,与明胶形成生物相容性网络。水凝胶具备高含水量(>75%)、超软组织相容性(剪切模量4 kPa)及丰富的羟基,赋予其优异的细菌相容性和黏附性能,能够支持表皮葡萄球菌长期存活(至少4天),并在冻干后可通过复水恢复活性。此外,该水凝胶具有低阻抗(<500Ω)和组织样粘弹性,适合与生物组织无缝整合,可用于长期电生理记录,并支持多种组织应用的机械性能调节。通过电生理记录和无线探测皮肤电阻抗、体温和湿度,ABLE能够监测微生物驱动的银屑病干预。该文章于2024年5月30日以《Active biointegrated living electronics for managing inflammation》为题发表于《 Science 》(DOI:10.1126/science.adl1102)。
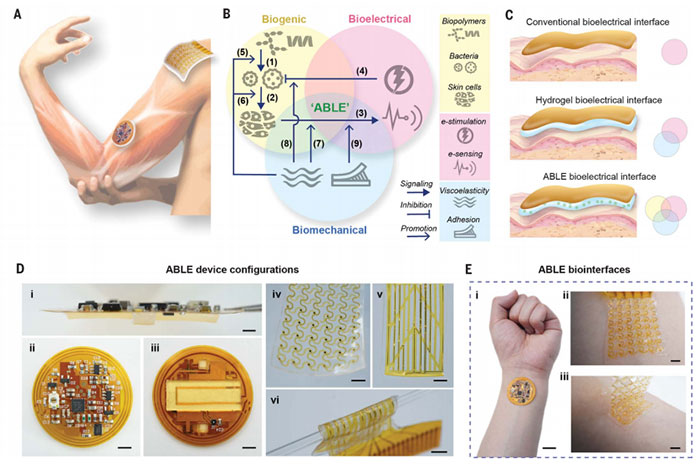
图1 研究示意图
(1)ABLE生物基质的设计与评价
在设计一种适合表皮葡萄球菌(S. epidermidis)长期存活的水凝胶基质时,该研究从自然生物膜中汲取灵感,尤其是那些能够促进细菌存活并调节群体行为的生物膜结构。为模拟生物膜中的关键成分——蛋白质基质和胞外多糖,采用蛋白质与多糖聚合物构建了双网络结构,成功开发出一种生物相容性水凝胶基质(图2A)。其中,明胶因其天然来源和优越的成胶性能被选为主要蛋白基质,相较于合成水凝胶(如聚丙烯酰胺),明胶展现出更优的细菌相容性,同时为细菌群落生长提供了理想的自然环境。多糖成分的筛选则包括多种生物源性与合成聚合物,最终发现木薯淀粉最适合支持表皮葡萄球菌的存活(图2B和C)。在水凝胶制备过程中,研究引入了热冷循环的明胶化与回生过程,显著降低了淀粉的结晶度,改变了颗粒形态,并释放出直链淀粉(图2D)。水化的直链淀粉与细菌相互作用,形成了高度生物相容的网络结构(图2C和E),为细菌的长期存活提供了理想环境。明胶化过程显著延长了细菌在水凝胶基质中的存活时间(图2F)。研究表明,该水凝胶基质中的细菌存活时间可达至少4天,显著优于普通水凝胶。此外,冷冻干燥的活性水凝胶可在-80℃条件下保存长达30天,其活性在存储期间基本不受影响。如有细菌存活损失,通过将复水后的水凝胶在室温下静置一夜即可恢复,甚至超越初始水平,展现出卓越的可复性。这种蛋白-多糖复合水凝胶的设计不仅延长了细菌的存活时间,还提供了一个高效、稳定的生物相容系统,可支持细菌的长期封装。这一创新为生物电子设备与活体细胞的长期集成提供了技术保障,并为进一步的皮肤免疫调节与炎症管理应用奠定了坚实基础。
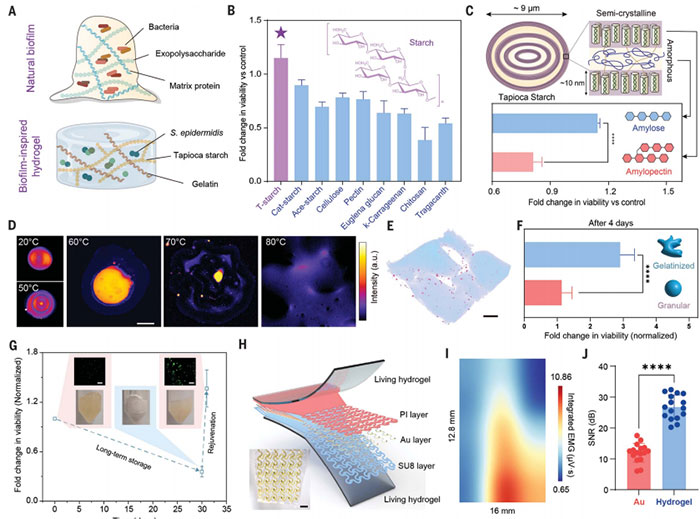
图2.活体生物界面的设计。(A)模拟生物膜的天然组成。(B)不同多糖维持细菌活力的能力。(C)在糊化过程中,直链淀粉从淀粉颗粒内部的无定形薄片中泄漏出来,对细菌的生存能力的影响。(D)淀粉颗粒在不同温度下热处理后的结构变化。(E)表皮葡萄球菌在活的水凝胶基质内的分布。(F)淀粉糊化对细菌在活的水凝胶基质生存能力的影响。(H)记录肌电信号的活体水凝胶混合网状电子装置的结构构型的示意图及照片。(I)空间强度图显示了大鼠腿部 15 个电通道的肌电活动。(J)电生理记录。
(2)ABLE平台监测和治疗皮肤疾病
银屑病的临床表现包括皮肤脱屑、上皮增厚、炎症反应加剧以及宿主皮肤微生物失调等特征,而这些症状与IMQ(imiquimod)诱导的银屑病小鼠模型非常相似,使得该模型成为研究银屑病的经典体内模型。研究人员将ABLE设备应用于银屑病小鼠模型(图3A)进行了一系列实验研究。研究人员使用了一种带有旋涂活体界面的网状电子设备(图1B;图3B)进行临床前评估。这种设备的设计使其能够稳定记录小鼠的六导联心电图(包括I、II、III、aVL、aVR和aVF导联),并通过电生理信号分析提供关于皮肤疾病状况的有价值信息。在健康小鼠的实验中,ABLE设备成功地记录了六导联心电图,且其信噪比保持在18.97 dB(图3C),表现出良好的信号稳定性。然而,在患有银屑病症状的小鼠中,心电图的信噪比明显下降,降至7.96 dB(图3D)。这一变化主要与银屑病导致的皮肤增厚有关,增厚的皮肤阻碍了信号的正常传输。尽管如此,这一信号变化提供了关于皮肤病理变化的定性数据,使得ABLE设备成为监测银屑病及其相关皮肤问题的有效工具。值得注意的是,当ABLE设备应用于银屑病小鼠的皮肤上4天后,实验结果显示,记录到的心电图信噪比相比于治疗前显著提高,表明皮肤症状得到了缓解(与第0天相比)。这种显著的改善反映了ABLE系统中的活体组分在银屑病小鼠模型中发挥的积极作用,尤其是在调节和缓解皮肤炎症方面。这一发现不仅证明了ABLE设备在记录电生理信号方面的高效性,还展示了其通过生物发生线索调节银屑病等炎症性皮肤疾病的潜力。
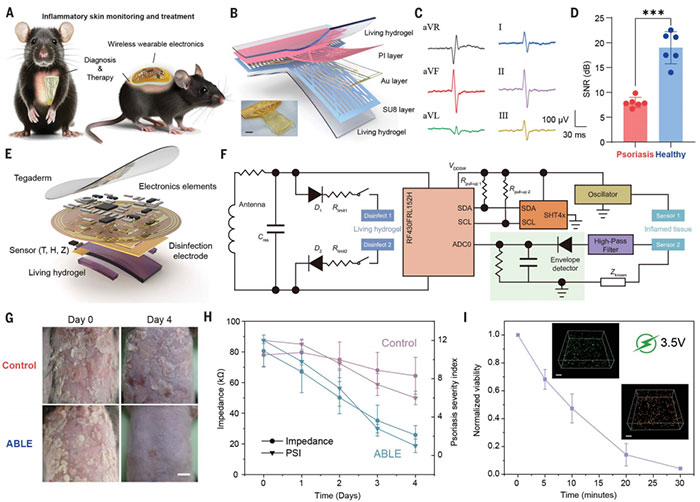
图3. ABLE 能够记录银屑病的电生理信号,诊断并治疗银屑病。(A)ABLE在牛皮癣诊断和治疗中的功能示意图。(B)用于sECG记录的活体水凝胶混合网状电子装置的结构示意图和照片。(C)有代表性的六导联心电图信号显示 I、II、III、aVL、aVR 和 aVF 导联的心律。(D)活体生物电子设备报告。(E)基于 FPCB 的 ABLE 结构示意图。(F)用于皮肤监测和活体水凝胶调制的无线生物电子学电路图。(G)ABLE 治疗牛皮癣的第 0 天和第 4 天的代表性照片。(H)用 ABLE 测量牛皮癣皮损阻抗。(I)ABLE 上的消毒电极通过 3.5 V 的直流电压在 30 分钟内对活水凝胶进行消毒。图为消毒前(上)和消毒后(下)的共聚焦图像。
(3)ABLE疗法的机制研究
研究人员发现,ABLE治疗不仅对银屑病小鼠的皮肤产生了显著疗效,还能够影响全身免疫系统的功能。特别是在治疗第4天时,观察到小鼠脾脏重量的减轻,这表明ABLE设备能够有效调节全身免疫反应,改善免疫系统的功能。这一结果表明,ABLE不仅在局部治疗上具有优势,还能够发挥全身性的免疫调节作用。治疗效果还延伸至直接治疗区域相邻的银屑病皮肤组织,进一步证明了该系统的广泛作用。通过血红素和伊红(H&E)染色,发现治疗后的银屑病皮肤组织中,表皮增厚、过度角化和皮肤炎症的情况得到了显著缓解(图4A)。这种改善表明,ABLE系统能够有效缓解银屑病典型的皮肤病变。相对而言,单独使用含有生物电子设备的水凝胶基质(即不含细菌成分的载体)对银屑病的治疗效果则较为有限,说明活体细菌成分在治疗过程中的关键作用。免疫组织化学(IHC)分析进一步揭示了ABLE治疗对免疫细胞的调节作用。细胞角蛋白14和F4/80的免疫组化染色显示,在ABLE治疗后,巨噬细胞的活性明显降低(图4B)。同时,CD4和CD8的IHC染色结果显示,T辅助细胞(CD4阳性)和细胞毒性T细胞(CD8阳性)的数量显著减少,进一步证实了ABLE对T细胞亚群的有效调控。流式细胞术分析银屑病皮肤组织中的免疫细胞群体显示,ABLE治疗后,CD4阳性T细胞的比例显著减少,这进一步支持了ABLE在调节免疫反应中的作用。此外,Ki-67免疫染色结果表明表皮细胞增殖明显减少,提示治疗过程中皮肤细胞的过度增生得到了有效抑制。血管生成也是银屑病发病的一个重要方面,CD31免疫荧光和IHC染色显示,在ABLE治疗后的样本中,皮肤中的扩张血管数量相较于对照组(IMQ诱导的银屑病小鼠,无治疗)显著减少(图4C)。这一结果表明,ABLE不仅调节了免疫反应,还能有效抑制过度的新生血管形成,进一步改善银屑病的临床症状。炎症因子的水平分析进一步支持了这些发现。通过对治疗后皮肤组织中细胞因子的分析,结果显示,促进炎症细胞招募、调节角质形成细胞增殖和银屑病进展的关键细胞因子如白细胞介素-17(IL-17)、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)和IL-1等的水平显著降低(图4D)。这些细胞因子的减少表明,ABLE通过调节免疫细胞和细胞因子的作用,显著缓解了银屑病的炎症反应。
(4)基因测序分析
为了进一步了解ABLE对皮肤微生物群的影响,研究人员对治疗后的小鼠皮肤样本进行了16S核糖体RNA基因测序分析。线性判别分析效应大小(LEfSe)的结果表明,ABLE能够显著调节银屑病小鼠的皮肤微生物群,将其从银屑病状态恢复到更健康的状态(图4E)。基于beta多样性的主坐标分析(PCoA)显示,治疗组小鼠的皮肤微生物群与对照组相比有显著差异,但与健康小鼠的微生物群极为相似,表明ABLE治疗能够恢复皮肤微生物的健康平衡。在物种水平上,进一步的分析显示,治疗后皮肤上S. epidermidis的丰度有所降低(图4F),这表明在ABLE的生物电子控制下,S. epidermidis相关的安全问题较低。同时,与银屑病发展密切相关的S. aureus丰度也显著减少(图4F),进一步证明了ABLE系统在抑制病原菌方面的潜力。研究还发现,ABLE治疗能够调节其他皮肤微生物的丰度,例如红球菌属(Rhodococcus erythropolis)和酸性杆菌属(Delftia acidovorans),这些微生物的变化可能有助于改善皮肤健康,虽然这些结果仍需要进一步的系统性研究。总体而言,ABLE系统通过调节免疫反应、细胞增殖、新生血管生成和细胞因子介导的炎症等多个机制,展现了其在治疗银屑病中的广泛潜力。同时,微生物群调节的作用也为银屑病的精准治疗提供了新的思路和可能性。未来的研究可能会进一步揭示ABLE系统在其他炎症性皮肤疾病中的应用潜力,推动其在临床治疗中的广泛应用。

图4. ABLE 用于研究疾病治疗中的活体生物界面-组织相互作用。(A)H&E 染色的代表性图像。(B)代表性的细胞角蛋白 14 和 F4/80 双重免疫组织化学染色图像。(C)代表性的 CD31 免疫荧光染色图像。(D)皮损的细胞因子分析。(E)LEfSe 物种分析。(F)金黄色葡萄球菌(S. aureus)的相对丰度。(G)热图显示与银屑病相关基因的表达谱。(H)基因本体论(GO)和弦图显示。(I)GO富集分析。(J)ABLE调节炎症性皮肤环境并在 IMQ 诱导的银屑病中发挥治疗作用的机制示意图。
研究小结:
该团队验证了集成活体生物界面-生物电子设备在生物医学应用中的疗效。在IMQ诱导的银屑病模型中,活体生物电子设备通过活体界面显著改善了治疗效果,展示了其在临床应用中的潜在价值。该设备实现了活体材料与电气系统的高效连接,为探索生物系统与非生物系统之间的相互作用提供了全新途径。尽管蠕虫疗法在某些自身免疫性疾病中展现了显著疗效,但因缺乏全面研究而存在诸多局限性。而活体生物电子学的兴起,为深入研究潜在有害生物与人体组织之间的动态关系提供了可控性的新视角。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

