
银屑病又称“牛皮癣”,是一种常见的慢性自身炎症性皮肤疾病,以斑块型银屑病为主,全球发病率0.5-4%,且呈逐年上升趋势。该病反复发作,不能治愈。外用药物是银屑病治疗的基石,是轻症银屑病的主要治疗手段以及中重度银屑病的重要辅助治疗方式。常见的外用治疗手段比如糖皮质激素,可能存在皮肤感染、多毛、刺激等不良反应。靶向IL-23、IL-17A或TNF-α生物制剂虽然能有效改善银屑病皮损,但是难以实现皮损全部清除。更为棘手的是,银屑病皮损在停止治疗后,绝大多数患者会出现复发情况。因此,研发更有效、安全的外用治疗手段,尤其是针对改善银屑病顽固皮损、减少银屑病复发,具有重要的临床意义。近年来,口服小分子Janus激酶(JAK)抑制剂,尤其是酪氨酸激酶2变构抑制剂(TYK2i)在银屑病治疗中显示出良好的疗效和安全性,但其外用制剂效果却不尽如人意。因此,本研究将TYK2抑制剂负载于冰片水凝胶上(TYK2i-BO-gel),通过小鼠模型从预防、治疗、减少复发三个方面证实其效果均显著优于TYK2i-gel。值得注意的是,TYK2i-BO-gel抑制银屑病复发方面,效果优于目前临床最常使用的强效糖皮质激素,且安全性良好,具有较好的临床转化前景。

针对上述问题,中山大学石臻睿团队,通过冰片水凝胶负载酪氨酸激酶2抑制剂,增加其经皮渗透,同时减少抗菌肽、抑制辅助T细胞17(Th17)相关免疫反应,从而有效治疗银屑病皮肤损害,并减少其复发,为银屑病提供一种更安全有效的外用治疗策略。该研究于2024年07月09日以《Topical treatment of tyrosine kinase 2 inhibitor through borneol-embedded hydrogel: Evaluation for preventive, therapeutic, and Recurrent management of psoriasis》为题发表于《Bioactive Materials》(DOI: 10.1016/j.bioactmat.2024.07.013)。
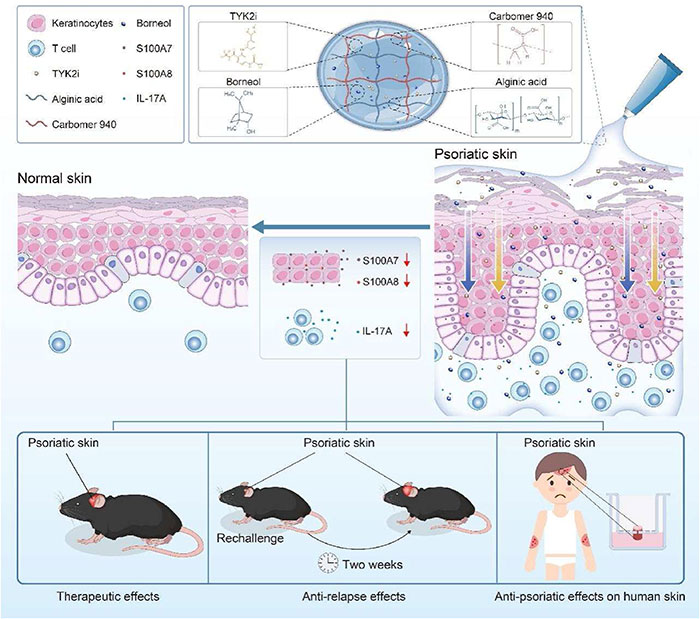
研究示意图
(1)外用TYK2i水凝胶制剂对IMQ小鼠银屑病样皮炎(PsD)有较好的治疗效果
如图1A所示,将含有TYK2i(0.1%)的玉米油和IMQ按照时间表分别涂抹在耳部皮肤上,即玉米油TYK2i分别在上午和下午施用,每天两次,而IMO分别在中午施用,因此它们不会混合。TYK2i的浓度是基于这样一个事实,即布雷波西替尼乳膏(一种TYK2/JAK1的选择性抑制剂)在治疗银屑病时,在3%的浓度与0.1%的浓度相比,没有表现出优越性。IMQ诱导的银屑病皮肤炎症表现为典型的红斑、增厚和结垢,在含有TYK2i的玉米油处理的小鼠中,这些症状轻度减轻(图1B)。这些处理导致耳部厚度(平均±SEM: 0.45±0.019 mm vs.0.37±0.008 mm, p = 0.01)和PSI评分(平均±SEM: 5.62±0.18 vs.4.66±0.33,p = 0.02)部分降低(图1C),表皮厚度轻微降低(平均±SEM: 48.97±2.77 μm vs.40.35±0.77 μm, p = 0.02)(图1D和E)。虽然表皮增生有中度改善,但两组小鼠表皮中Ki-67(细胞增殖标志物)的核染色没有差异(图1F)。组织学分析显示,tyk2i处理小鼠的Munro微脓肿(表皮角质层(SC)中中性粒细胞的显微集合)减少了55% (p = 0.02)(图1G)。同样,通过 RT-PCR 观察到几种银屑病相关标志物(包括 Il1b、Il6 和 Cxcl2)和抗菌肽 (AMP)(包括 S100a8 和 S100a9)的转录物减少了约 50%(图 1H)。每天上午将载药或载tyk2i的水凝胶涂在耳上,中午施用IMQ(图1I)。结果,用TYK2igel处理的小鼠没有表现出相对于用载药的小鼠的体重减轻(数据未显示),但每天使用tyk2gel可显著减少红斑、结垢、耳肿胀(平均±SEM: 0.40±0.018 mm vs.0.30±0.010 mm, p = 0.0003)和PSI评分(平均±SEM:(6.0±0.65 vs.2.2±0.47,p = 0.0002)(图1J和K)。H&E 染色进一步显示,TYK2i 凝胶处理的小鼠表皮增生减少 40% 以上 (p = 0.025)(图 1L 和 M),免疫组织化学 (IHC) 结果显示,用载有 TYK2i 的水凝胶处理后,耳切片中 Ki-67 的染色明显较弱。
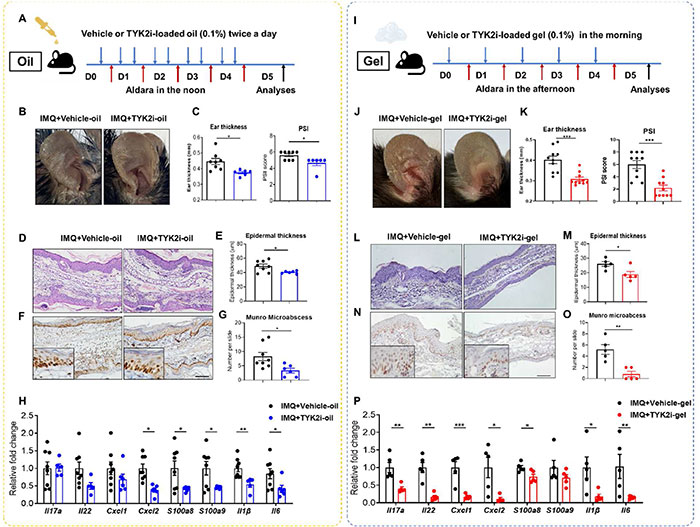
图1. 外用TYK2抑制剂凝胶制剂治疗银屑病样皮炎(PsD)的疗效优于玉米油制剂。(A)实验方案示意图:WT C57BL/6小鼠耳部每天早晚分别用玉米油(对照品)或溶于玉米油中的deucravacitinib (TYK2抑制剂,TYK2i) (w/w 0.1%)局部处理,中午用咪喹莫特(IMQ);(B)代表性照片,(C)耳厚和银屑病严重程度指数(PSI)评分,(D) H&E切片图像,(E)表皮厚度分析,(F) Ki-67免疫组化(IHC)染色,(G)微脓肿数量,(H)耳皮肤中银屑病相关标记物的基因表达。(I)实验方案示意图:每天上午用载药或载tyk2凝胶(w/w 0.1%)局部处理小鼠耳,下午用IMQ处理:(J)代表性照片,(K)耳厚度和PSI评分,(L) H&E切片图像,(M)表皮厚度分析,(N) Ki-67免疫组化染色,(O)微脓肿数量,(P)耳皮肤中牛皮癣相关标记物的基因表达
(2)局部应用BO增强TYK2i预防治疗PsD
由于炎症性银屑病皮肤的酸性环境pH值在5.0左右,而正常皮肤的pH值在6.0左右,因此在pH分别为5.0和6.0的PBS中定量TYK2i- BO -gel的释放率。如图2C所示,在pH 5.0和pH 6.0的PBS中,培养2小时后,TYK2i在水凝胶中的释放率分别为26.5%和22.7%。随后,TYK2i的释放率在pH 5.0和pH 6.0时逐渐增加到57.6%和60.8%。为进一步确定加入 BO 是否能增强 TYK2i 治疗 PsD 的有效性。局部皮质类固醇 (TC) 是治疗银屑病最广泛的方法之一,在接下来的实验中被用作阳性对照。结果显示,与载体凝胶组相比,每日使用 TYK2i-BO-gel 可改善 PsD 症状,达到与 TC 治疗相当的水平,耳朵厚度 (平均值 ± SEM:0.35 ± 0.008 mm vs.0.23 ± 0.003 mm,p < 0.0001) 和 PSI (平均值 ± SEM:5.9 ± 0.48 vs.1.0 ± 0.30,p < 0.0001) 均有所减少 (图 2D 和 E)。值得注意的是,与 TYK2i-gel 相比,TYK2i-BO-gel 治疗显著抑制了耳部水肿 (p = 0.039)。 组织学和 IHC 分析进一步证实,与使用载体凝胶治疗的小鼠相比,使用 TYK2i-BO-hydrogel 治疗的小鼠的 Ki-67 染色强度、表皮厚度 (平均值 ± SEM:42.24 ± 3.09 μm vs.21.70 ± 0.68 μm,p<0.0001) 和 Munro 微脓肿计数 (平均值 ± SEM:2.0 ± 0.65 vs.0.0 ± 0.0,p=0.005) 均显著降低 (图 2F-I)。同样地,与载体凝胶组相比,TYK2i-BO-gel 组的 cLN 细胞计数减少(× 106,平均值±SEM:9.79±0.53 vs.4.33±0.29,p=0.0001),脾脏重量有下降趋势(平均值±SEM:94.40±6.28 mg vs.77.80±3.09 mg,p=0.14)(图 2J 和 K)。
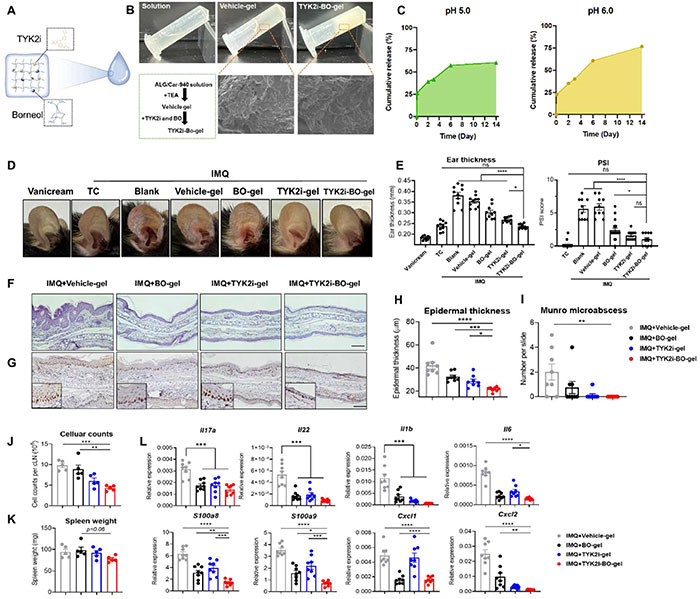
图2. 局部联合使用 BO 和 TYK2i 可有效改善 PsD。(A) TYK2i-BO-gel 形成示意图。(B) 载体凝胶和 TYK2i-BO-gel 的展示照片和 SEM 图像,比例尺 = 100 μm。(C) 孵育 14 天后,在 pH 5.0 和 pH 6.0 的 PBS 中,TYK2i-BO-gel 中的释放率。每天早上用 vanicream 或 IMQ 对小鼠耳朵进行指示性治疗,持续 5 天:(D) 代表性照片,(E) 耳朵厚度和 PSI 评分,(F) H&E 切片图像,(G) Ki-67 IHC 染色代表性图像,(H) 表皮厚度的组织学分析和 (I) 微脓肿数量,(J) 颈部淋巴结细胞计数和 (K) 脾脏重量,(L) 耳部皮肤中银屑病相关标志物的基因表达
(3)局部应用 BO 可增强 TYK2i 治疗 PsD 的效果
IMQ 模型是银屑病研究中常用的模型,通常模拟急性皮肤炎症,但它也存在局限性,例如非预期的全身影响、机制不明、由于副作用不断升级和炎症减轻而不适合用于慢性研究。通过尾静脉注射IL-23小环装DNA (IL-23 MC), 引起系统过表达IL-23诱导小鼠银屑病皮炎的产生。在注射 IL-23 MC后5天,C57BL/6 小鼠即可出现显著的银屑病皮炎表型。在注射IL-23 MC第6天开始,每天使用基质胶、TYK2i-gel或TYK2i-BO-gel治疗。TYK2i‑BO-gel在外观(耳朵皮肤水肿程度)、组织学角度(表皮厚度,Munro 微脓肿)方面,治疗效果均显著优于其它处理组。此外,局部应用 TYK2i-BO-gel可改善IL‑23过表达引起的脾脏肿大,提示全身炎症反应同样得到改善。流式细胞术分析表明,TYK2i-BO-gel治疗组耳部皮肤中白细胞总数、中性粒细胞、T细胞和γδ-low T细胞以及CCR6+ γδ-low T 细胞的浸润均减少。值得注意的是,TYK2-BO-gel 导致 Th17 相关分子(包括 Il17a、Il17f 和 Il22)的 mRNA 水平均明显下调。然而,TYK2i-gel 和 BO-gel 组则无明显改变。这些结果表明,在 IL-23 介导的 PsD 模型中,与 TYK2i 或 BO 凝胶相比,TYK2i-BO 水凝胶具有更高的抗银屑病治疗效率。
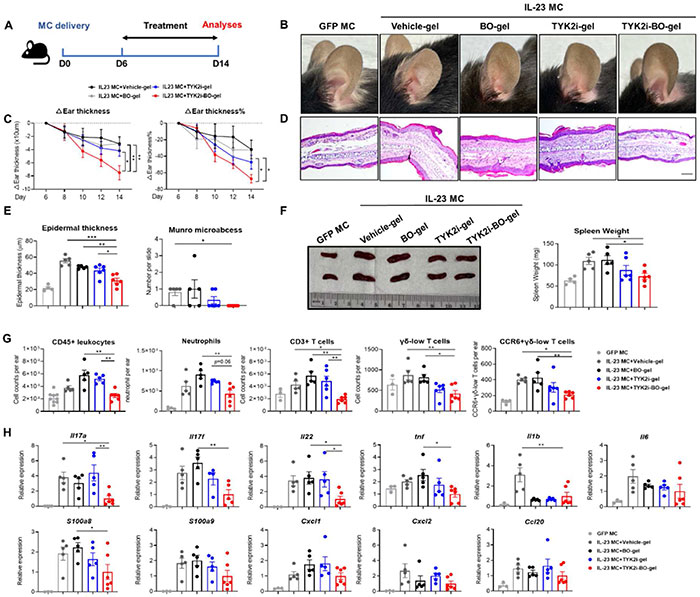
图3. 局部应用 BO 可增强 TYK2i 对 PsD 的治疗作用。(A)实验方案示意图:在 IL-23 MC 给药后第 6 天开始,连续 8 天用载体凝胶、BO 负载凝胶(w/w 2%)、TYK2i 负载凝胶(w/w 0.1%)、TYK2i-BO 凝胶(含 0.1% TYK2i 和 2% BO,w/w)治疗 C57BL/6 小鼠。GFP MC 作为对照给药。(B)耳朵的代表性照片。(C)耳朵厚度的绝对变化和变化百分比(相对于第 6 天)。(D)耳部皮肤组织的 H&E 切片图像。(E)表皮厚度和微脓肿数量的组织学分析。(F)脾脏的代表性图像和重量分析。 (G) 流式细胞术检测耳部皮肤中 CD45+ 白细胞、中性粒细胞、CD3+ T 细胞、γδ-low T 细胞和 CCR6+ γδ-low T 细胞的绝对数量。(H) 耳部皮肤中银屑病相关标志物的基因表达
(4)局部应用 BO 可增强 TYK2i 预防 PsD 复发的效果
银屑病治疗的一大挑战是停药后易复发。为评估 TYK2i-BO-gel 是否抑制复发,使用改良 IMQ 诱导的 PsD 模型(图 4A)。在小鼠耳部涂抹 IMQ 3 周,第 6 天分别用载体凝胶、TC 霜、TYK2i-gel 和 TYK2i-BO-gel 治疗,治疗持续至第 20 天。随后小鼠休息 2 周,再用 IMQ 刺激 4 天。结果显示,与 TYK2i-gel 相比,TYK2i-BO-gel 治疗效果更显著,其耳肿胀程度接近 TC 组(图 4B)。然而,局部 TC 组小鼠体重显著减轻,反映全身炎症更为明显(图 4C)。再次攻击后,预处理组均表现出皮肤炎症改善,但 TYK2i-BO-gel 组耳厚变化(图 4D,4E)、PSI 评分及表皮厚度改善最显著(图 4F-H)。此外,TYK2i-BO-gel 组 Ki-67 染色较弱,Munro 微脓肿数量显著减少(图 4I),并且皮肤中中性粒细胞与 γδ-low T 细胞数量减少(图 4J 和 K)。与 TC 和 TYK2i-gel 组相比,TYK2i-BO-gel 组白细胞数量显著降低,可能与 F4/80 阳性巨噬细胞和 CD4 阳性 T 细胞浸润减少有关。
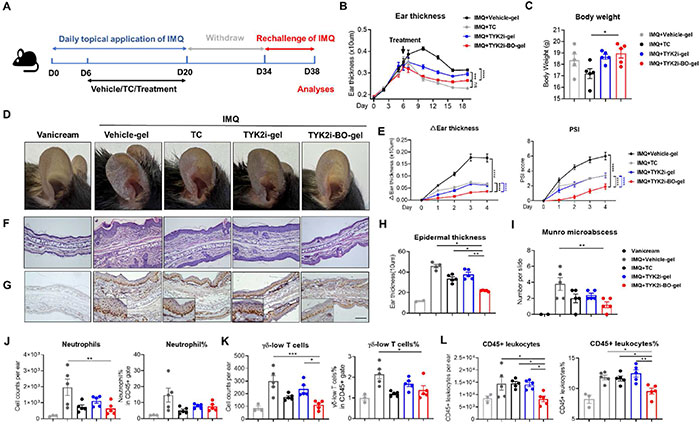
图4. 局部应用 BO 可增强 TYK2i 预防 PsD 复发的效果。(A) 小鼠模型建立和治疗方案。(B) 从第 0 天到第 20 天测量耳朵厚度。(C) 第 20 天接受不同治疗后 IMQ 诱发的 PsD 小鼠的体重。(D) 代表性照片,(E) 耳朵厚度(相对于第 34 天)和 PSI 评分的绝对变化,(F) H&E 切片图像,(G) Ki-67 IHC 染色代表性图像,(H) 表皮厚度的组织学分析和 (I) 微脓肿的数量,(J-L) 流式细胞术测定耳部皮肤中 CD45+ 白细胞、中性粒细胞和 γδ-low T 细胞的绝对数量
(5)TYK2i-BO-gel 可有效抑制人类银屑病皮肤炎症
从患者银屑病皮损处取活检组织,均匀切成三份,放入六孔板中。用载有载体、TYK2i 或 TYK2i 加 BO 的水凝胶对每个活检组织进行局部处理。培养 8 小时后,从组织中分离 RNA 并进行 RTPCR(图 5A)。应用 TYK2i-gel 和 TYK2i-BO-gel 类似地抑制了促炎标志物的转录,包括 IL1B、IL6、CXCL1 和 CXCL2。与 TYK2i-gel 相比,TYK2i-BO-gel 在抑制 Th17 相关细胞因子 (IL17A 和 IL17F) 和 CCL20 方面表现出更高的效率,CCL20 是 IL-17 产生 T 细胞血液-皮肤运输以及 PsD 完全表达所需的关键趋化因子。值得注意的是,只有 TYK2i-BO-gel 能够抑制 S100A7 和 S100A8 的转录,这两种基因对于角质形成细胞的分化失调和银屑病病变中的炎症过程至关重要(图 5B)。
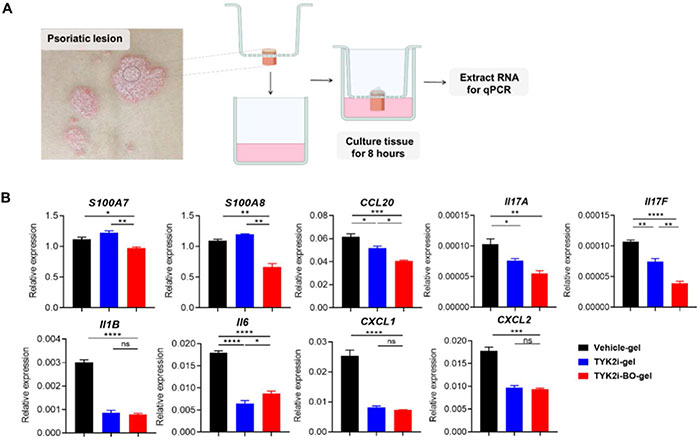
图5. BO 增强 TYK2i 抑制银屑病患者皮肤炎症的效果。(A)银屑病皮损活检样本分别用载体凝胶、TYK2i 凝胶或 TYK2i-BO 凝胶处理 8 小时后提取 mRNA。(B)不同处理组中银屑病相关标志基因的表达水平
(6)BO促进TYK2i的经皮渗透并协同加强其抗炎作用
如图6A所示,在IL-23 MC小鼠模型中,随着BO量的增加,皮肤中的TYK2i量逐渐增加。详细地,在施用72小时后,在没有加载BO的TYK2i-凝胶组的治疗后,皮肤中的TYK2i量为124.8±80.9μg。然而,经TYK2i-BO-gel处理后,皮肤中的TYK2i量比TYK2i-gel组高4倍。这一结果表明BO以剂量依赖的方式有效地增强了药物吸收。接下来,为了观察TYK2i-BO-凝胶在皮肤中的定位,该团队局部制备并在IL-23模型小鼠的耳皮肤上施用负载罗丹明B和冰片的水凝胶,即RhoB-BO-gel,然后在局部施用后第3天收集皮肤用于冷冻切片。共聚焦显微镜显示,RhoB-BO-gel中的荧光穿透整个表皮,而RhoB-凝胶主要积聚在SC中(图6B),表明BO促进了药物在银屑病皮肤中的经皮渗透,并将提高TYK2i-BO水凝胶的优异治疗效果。接下来用5种细胞因子(IL-17A、IL-22、IL-1α、OSM和TNF-α)的组合刺激角质细胞,作为银屑病的体外模型。细胞因子的混合物促进角质细胞中多种促炎介质的转录,其中BO显著抑制AMPs的表达,包括S100A7和S100A8(图6C)。TYK2i以剂量依赖的方式抑制AMP的表达,BO的加入进一步抑制了它们的转录物(图6D)。BO 本身并不影响 IL17A 的转录,但会增强 TYK2i 的抑制作用,这一点可以从 TYK2i 加 BO 治疗组的细胞中 mRNA 水平与仅用 TYK2i 治疗的细胞相比降低近 50% 得到证明(图 6F)。流式细胞术通过检测小鼠 cLN 中 CD3+T 细胞中 IL17A 的蛋白质水平证实了 BO 和 TYK2i 的协同作用(图 6G)。同样,单独使用 BO 治疗不会影响 STAT3 的磷酸化,但会增强 TYK2i 的抑制作用(图 6H 和 S20)。与体外实验结果一致,与使用载体凝胶、BO 凝胶或 TYK2i 凝胶治疗的小鼠相比,使用 TYK2i-BO 凝胶治疗的小鼠耳朵表皮中的 P-STAT3 染色较弱,真皮中的细胞浸润较弱(图 6I)。
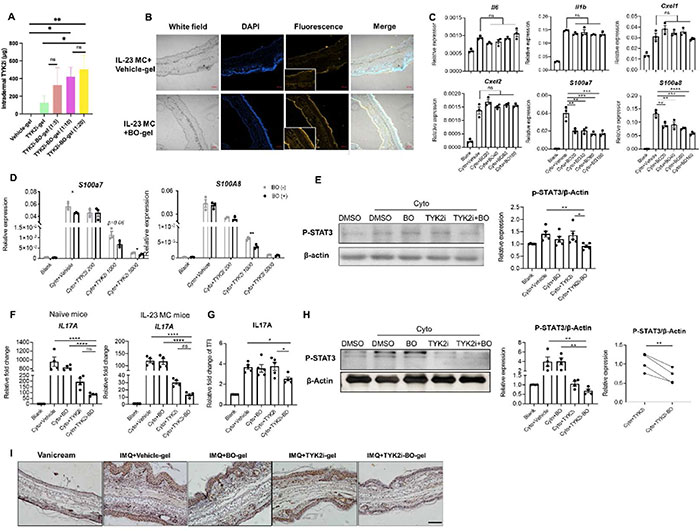
图6. BO 促进经表皮渗透并抑制炎症。(A)在 IL-23 MC 小鼠模型中局部治疗载体凝胶、TYK2i 凝胶和 TYK2i-BO 凝胶 72 小时后皮肤中的 TYK2i 量。(B)给药 24 小时后,负载载体或 BO 的凝胶渗透到涂有荧光罗丹明 B 的 IL-23 MC 小鼠银屑病皮肤的共聚焦图像。(C)在细胞因子混合物刺激下与所示浓度 BO(μg/mL)共培养的 HaCat 细胞中银屑病相关促炎标志物的转录本。 (D) 在细胞因子混合物的刺激下,HaCat 细胞与所示浓度的 TYK2i (nM) 和 BO 共培养时 S100A7 和 S100A8 的转录本。(E) BO 或/和 TYK2i 对 IL-23和 IL-1β诱导的 HaCat 细胞中 STAT3 (P-STAT3) 磷酸化的影响。 (F)在IL-23和IL-1β存在下与媒介物、BO、TYK 2 i或TYK 2 i加BO孵育24小时后,来自未处理小鼠或IL-23 MC递送小鼠的cLN细胞中的IL 17 A的转录物。(G)来自未处理cLN的CD 3 + T细胞中IL-17 A的总荧光强度(TFI)的相对倍数变化。(H) BO或/和TYK2i对IL-23 )和IL-1β诱导的cLN细胞P-STAT3的影响。(I) vanicream、IMQ +载体凝胶、BO-gel、TYK2i -gel或TYK2i-BO-gel局部处理小鼠耳PSTAT3免疫化学染色代表性图像
研究小结:
本研究首次探讨了将 BO 添加至 TYK2i 的局部治疗中作为银屑病治疗的新策略。针对目前治疗中银屑病复发和治疗抵抗性病变的难题,研究发现 TYK2i-BO-gel 不仅能够达到与糖皮质激素(TCs)相当的疗效,还显著预防银屑病复发,满足了这一领域的重要未被满足的医疗需求。此外,该局部水凝胶制备工艺具有稳健性和可扩展性,所用试剂和药物均为临床批准产品,具备进一步临床转化的潜力,可作为单一疗法或辅助治疗特别是针对抵抗性病变及高复发患者的选择。TYK2i-BO-gel 的优异抗银屑病疗效可能由以下两种机制贡献:(1)增强透皮吸收:BO 在碳羧基聚合物/海藻酸凝胶中提高了皮肤渗透性,促进 TYK2i 渗入银屑病炎症部位的深层皮肤层;(2)协同抑制关键细胞因子和信号通路:TYK2i-BO-gel 抑制角质形成细胞中抗菌肽(AMPs)的表达,同时通过调节 STAT3 信号通路抑制 Th17 免疫反应。未来研究应聚焦于 TYK2i-BO-gel 预防银屑病复发的潜在机制,特别是驻留记忆 T 细胞的作用。此外,为推动临床转化,还需评估该制剂在头皮、指甲、手掌、足底及褶皱区等特定部位病变中的疗效,以及开展长期体内毒性研究以确保临床使用的安全性。最后,探索该制剂在特应性皮炎等其他炎症性皮肤疾病中的潜在应用,以及解决银屑病相关共病(如银屑病关节炎)的可能性,也具有重要意义。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

