
牙周炎是一种以牙周组织炎症为特征的破坏性疾病,炎症环境显著削弱了牙周膜干细胞(PDLSCs)的成骨分化能力,阻碍牙周组织再生。氧化应激与线粒体功能障碍密切相关,是导致干细胞功能衰退的关键因素。线粒体作为细胞代谢和分化的核心器官,在炎症条件下因活性氧(ROS)过度产生而加剧细胞损伤。因此,靶向线粒体功能障碍成为提升PDLSCs再生能力的重要策略。白藜芦醇(RSV)因其抗氧化、调节线粒体功能及促成骨作用,被认为是牙周再生的潜在药物。然而,其短半衰期和低稳定性限制了临床应用。通过生物材料构建稳定的RSV递送系统可有效克服这一局限性。

基于上述问题,第四军医大学田北明(音译)和何小涛(音译)教授团队,为了改善炎症环境下牙周膜干细胞(PDLSCs)的成骨分化能力,开发了一种基于胍基化乙二醇壳聚糖(GGC)与锌离子配位的白藜芦醇(RSV)纳米递送系统(GGC-Zn²⁺-RSV)。通过胍基修饰实现线粒体靶向,锌离子提供抗氧化功能,配位交联提升系统稳定性。该研究系统评估了GGC-Zn²⁺-RSV的理化性质、线粒体靶向能力及其对细胞行为和线粒体功能的影响,并通过体内实验验证其促成骨效果。研究结果揭示了GGC-Zn²⁺-RSV在改善线粒体功能、缓解氧化应激和促进牙周组织再生中的机制,为牙周炎治疗提供了新策略和理论依据。该文章于2024年12月04日以《Mitochondria-targeted delivery of zinc-coordinated resveratrol nanoparticles rescues the osteogenic potential of periodontal ligament stem cells compromised by inflammation for periodontal wound healing》为题发表于《Chemical Engineering Journal》(DOI:10.1016/j.cej.2024.158296)。
(1)GGC-Zn2+-RSV的制备和表征
该研究制备并表征了GGC-Zn²⁺-RSV纳米颗粒,通过锌离子与GGC络合实现RSV的交联,制备过程简化且未使用有毒交联剂(图1A)。FTIR光谱显示,GGC在1553 cm⁻¹和1302 cm⁻¹处出现了C= N和C-N的特征峰,证明了胍基的成功接枝(图1B)。拉曼光谱进一步确认了该化学反应,新增的特征峰在1156 cm⁻¹和1512 cm⁻¹,分别对应胍基的C-N伸缩振动和N-H弯曲振动(图1C)。DLS和TEM分析表明,GGC-Zn²⁺-RSV纳米颗粒的平均粒径为136.4 nm,分散性良好,TEM显示其形态均匀,且溶液中表现出清晰的Tyndall效应(图1D–F, 1G–I)。XPS分析在1046.06 eV和1022.99 eV处检测到锌离子特征能量,证实了锌的成功掺入(图1K),UV吸收光谱显示306 nm的RSV特征峰,进一步验证了RSV的载入(图1L)。XRD图谱中观察到16.25°、19.09°、22.44°和23.70°的衍射峰,与RSV的晶体特征一致,表明成功交联形成了金属-酚类纳米颗粒(图1M)。在稳定性测试中,颗粒在尿素和Tween 20环境下表现出不同的响应特性,同时在EDTA溶液中发生膨胀,验证了其金属-酚类材料的稳定性(图1N)。pH响应性测试表明,在酸性环境下,RSV的释放速率显著增加(图1O)。DPPH抗氧化活性实验显示,GGC-Zn²⁺-RSV的自由基清除能力具有持续性和稳定性,相比RSV更加优越(图1P)。
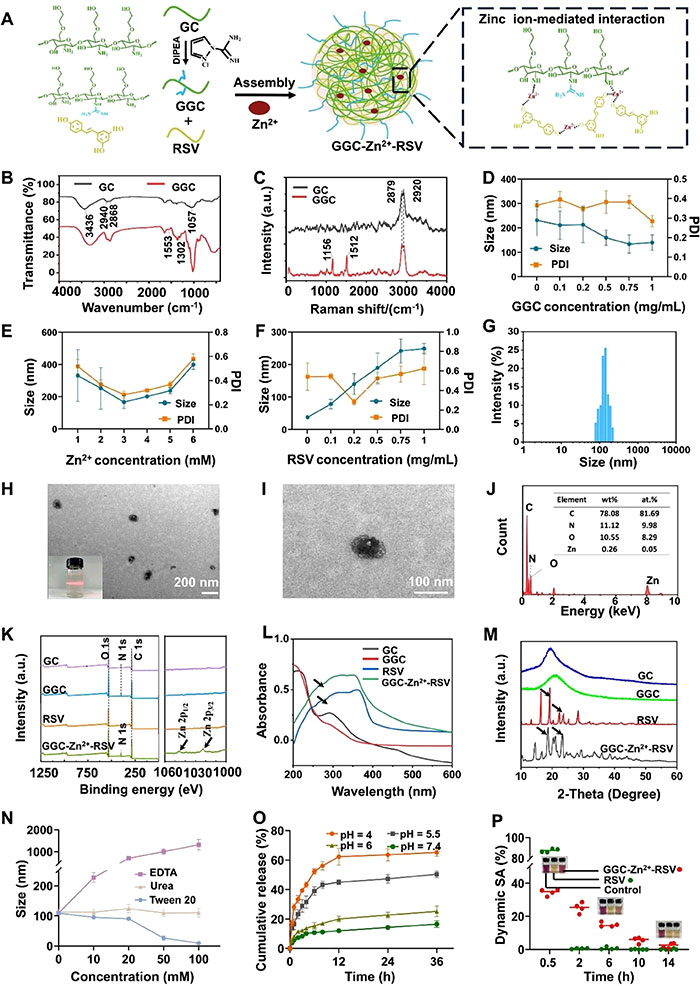
图1. GGC-Zn2+-RSV的制备与表征。 (A) GGC-Zn2+-RSV的制备示意图。首先将壳聚糖(GC)接枝胍基,得到GGC,然后通过锌金属离子配位将GGC与RSV交联,合成GGC-Zn2+-RSV;(B) FTIR光谱显示GC(–OH伸缩振动峰在3436 cm−1,C-H伸缩振动峰在2940 cm−1和2868 cm−1,C-O伸缩振动峰在1057 cm−1)和GGC(C = N伸缩振动峰在1553 cm−1,C-N振动峰在1302 cm−1)的特征吸收峰;(C) 拉曼光谱显示GC(2920 cm−1, 2879 cm−1归因于–CH2)和GGC(C-N伸缩振动峰在1156 cm−1,N-H弯曲振动峰在1512 cm−1)的特征吸收峰;(D-F) 不同浓度的GGC(D)、Zn2+(E)和RSV(F)对合成的GGC-Zn2+-RSV颗粒直径和多分散指数(PDI)的影响,通过动态光散射(DLS)分析测定(n = 3);(G) 用0.2 mg/mL RSV、1 mg/mL GGC和3 mM Zn2+合成的GGC-Zn2+-RSV颗粒的粒径分布;(H) 代表性TEM图像及Tyndall效应(左下角),显示了在培养基中均匀分散的纳米级GGC-Zn2+-RSV颗粒;(I) 单个纳米颗粒的高倍TEM图像;(J) GGC-Zn2+-RSV的EDX光谱,C、O、N和Zn的信号分别出现在0.277、0.392、0.525和8.630 keV;(K) GC、GGC、RSV和GGC-Zn2+-RSV的XPS光谱,在GGC-Zn2+-RSV的全谱中观察到Zn的结合能分别为1046.06 eV(Zn 2p1/2)和1022.99 eV(Zn 2p3/2);(L) GC、GGC、RSV和GGC-Zn2+-RSV的UV-Vis光谱,GGC-Zn2+-RSV的UV-Vis光谱中也观察到了RSV的特征峰(约306 nm)(由黑箭头标出);(M) GC、GGC、RSV和GGC-Zn2+-RSV的XRD图谱,在GGC-Zn2+-RSV和RSV的XRD图谱中观察到16.25°、19.09°、22.44°和23.70°的衍射峰(由黑箭头标出);(N) 与不同浓度的EDTA、尿素和Tween 20孵育后的GGC-Zn2+-RSV粒径变化(n = 3);(O) 在不同pH值的PBS中孵育后,GGC-Zn2+-RSV中RSV的体外累计释放(n = 3);(P) DPPH实验显示在0.5、2、6、10和14小时孵育后的RSV和GGC-Zn2+-RSV的动态抗氧化活性(SA)(n = 5)。数据以均值±标准差表示
(2)GGC-Zn2+-RSV对PDLSCs的细胞毒性
如图2A所示,当RSV浓度超过10 μM时,显著抑制了细胞活力。GC-Zn2+-RSV和GGC-Zn2+-RSV的安全浓度相同,且每种浓度为5 μM时未对细胞活力产生影响,表明胍基接枝未引起额外的细胞毒性。增殖曲线显示,PDLSCs在不同培养条件下的生长情况良好,然而RSV或纳米粒子浓度超过5 μM时,增殖速率显著下降。CCK-8实验结果表明,随着药物浓度的增加,细胞相容性逐渐下降,确认了5 μM为最佳治疗浓度。从活死细胞分析(图2)中也可以得出一致的结论,观察到的绿(活细胞)和红(死细胞)染色表明相同的细胞活性结果。
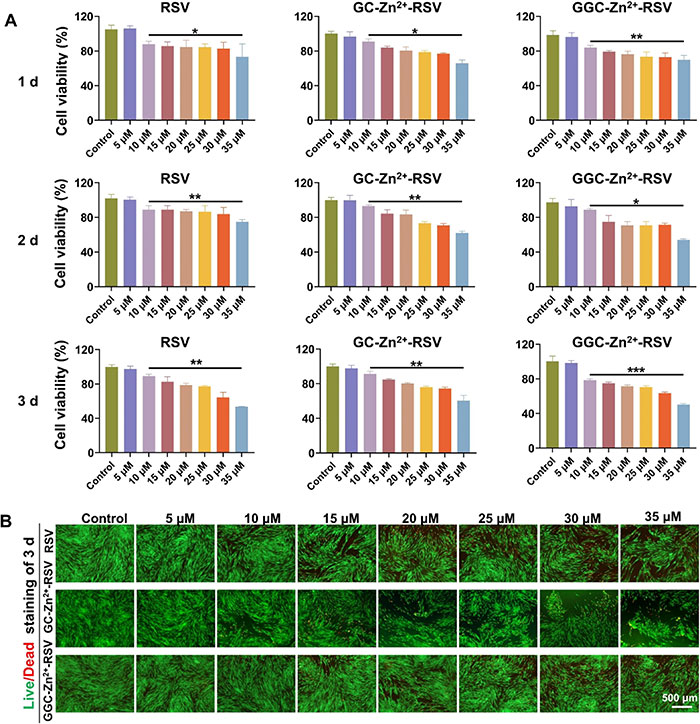
图2. RSV、GC-Zn2+-RSV和GGC-Zn2+-RSV的细胞相容性。(A) CCK-8实验数据显示RSV、GC-Zn2+-RSV和GGC-Zn2+-RSV在1天、2天和3天后的PDLSCs活力影响(n = 5);(B) 代表性的活/死染色图像显示不同浓度的RSV、GC-Zn2+-RSV和GGC-Zn2+-RSV孵育后,活细胞(用绿色荧光标记)和死细胞(用红色荧光标记)的情况
(3)GGC-Zn2+-RSV促进RSV在PDLSCs中的溶酶体逃逸和线粒体递送
该研究评估了GGC-Zn2+-RSV对PDLSCs的细胞内摄取和递送行为。流式细胞术分析(图3A)显示,随着时间的推移,纳米粒子的细胞摄取逐渐增加,且GGC- Zn2+-RSV在前6小时相比GC-Zn2+-RSV有轻微增加,但在8小时后两者几乎无差异(图3B)。GGC- Zn2+-RSV能够通过其缓冲效应促进溶酶体逃逸,这一点通过滴定实验(图3C)得到验证,GGC-Zn2+-RSV在酸碱滴定过程中pH变化较小。进一步的Cl−流入曲线分析(图3D)表明,GGC-Zn2+-RSV显著增加了Cl−的流入,支持其溶酶体逃逸的能力。此外,胍基作为脂溶性阳离子,可以靶向线粒体。通过荧光共定位分析(图3E、F和G、H),结果显示,GGC-Zn2+-RSV在8小时时未定位于溶酶体,而是更强烈地定位于线粒体,表明GGC-Zn2+-RSV能够高效逃逸溶酶体并转运至线粒体。这一现象与GGC-Zn2+-RSV较强的线粒体靶向性密切相关。
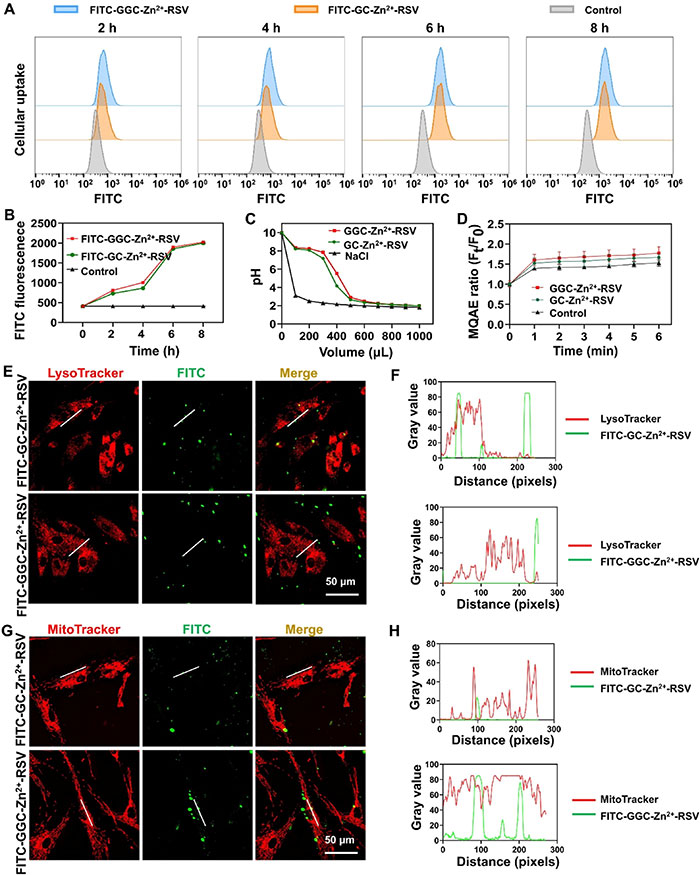
图3. GC-Zn2+-RSV和GGC-Zn2+-RSV在PDLSCs中的细胞摄取和内流运输。(A) 代表性的流式细胞术图像显示PDLSCs在2、4、6和8小时孵育后对FITC标记的GC-Zn2+-RSV和GGC-Zn2+-RSV的摄取情况。PBS处理的细胞作为对照。(B) GC-Zn2+-RSV和GGC-Zn2+-RSV在2、4、6和8小时孵育后的FITC标记平均荧光强度的定量。(C) NaCl、GC-Zn2+-RSV和GGC-Zn2+-RSV的滴定曲线,显示添加0.1 M HCl后的pH变化。NaCl的滴定曲线作为对照。(D) PDLSCs在不同时间点(1、2、3、4、5、6分钟)孵育MQAE探针后的荧光强度(n = 3)。PBS处理的细胞作为对照。(E) 代表性的免疫荧光图像显示LysoTracker(溶酶体)与FITC标记的GC-Zn2+-RSV或GGC-Zn2+-RSV在8小时共孵育后的共定位情况。(F) GC-Zn2+-RSV、GGC-Zn2+-RSV和溶酶体在PDLSCs中荧光共定位的分析。(G) 代表性的免疫荧光图像显示MitoTracker(线粒体)与FITC标记的GC-Zn2+-RSV或GGC-Zn2+-RSV在8小时共孵育后的共定位情况。(H) GC-Zn2+-RSV、GGC-Zn2+-RSV和线粒体在PDLSCs中的荧光共定位分析。数据以均值±标准差表示。白色线条代表共定位分析的感兴趣区域
(4)GGC-Zn²⁺-RSV增强炎症条件下PDLSCs的成骨能力
该研究评估了GGC-Zn²⁺-RSV是否能够作为一种再生治疗,恢复炎症引起的成骨功能损伤。2周的成骨诱导后进行ALP染色(图4A),结果表明在TNF-α和IL-1β的存在下,ALP活性显著降低,表明炎症减弱了PDLSC的成骨分化能力。GGC-Zn²⁺-RSV组的ALP阳性面积最大,表明其具有优越的成骨效果。此外,GC-Zn²⁺-RSV和GGC-Zn²⁺-RSV组的ALP活性均高于纯RSV组,表明纳米粒子提高了RSV的生物利用度,且具有更好的治疗效果。进一步的组间比较表明,GGC-Zn²⁺-RSV相比GC-Zn²⁺-RSV具有显著的促成骨作用,说明通过胍基接枝修饰纳米粒子直接影响了PDLSC的成骨分化并取得了更好的效果(图4B)。此外,通过阿利新红染色评估21天后的成骨表现(图4C和D),进一步确认了GGC-Zn²⁺-RSV在促进炎症损伤PDLSC的成骨分化中的优越性,该组中存在最大且最深的阿利新红矿化结节。在正常组中,PDLSC被埋入矿化基质中,形成更大的隆起,并伴随着小针状、片状晶体的钙分泌现象。相比之下,受到炎症刺激后,钙化晶体的结构变为颗粒状沉积,且钙化晶体的数量减少。值得注意的是,GGC-Zn²⁺-RSV组逆转了炎症并导致强劲的钙分泌,这与染色结果一致。通过qRT-PCR检测在2周成骨诱导后PDLSC的成骨相关基因表达(图4E),结果显示,炎症因子的加入显著降低了Runx2、ALP、Col-1和OCN的表达,而RSV、GC-Zn²⁺-RSV和GGC-Zn²⁺-RSV治疗可在不同程度上逆转这一趋势。深入比较研究表明,GGC-Zn²⁺-RSV组的促成骨效果尤为显著,因其ALP、Col-1和OCN的表达水平最高。该研究还通过免疫荧光分析检测了ALP和Runx2的蛋白表达(图4F-H),结果表明,RSV、GC-Zn²⁺-RSV和GGC-Zn²⁺-RSV显著增加了这两种蛋白的荧光强度。两种纳米粒子组中,ALP表达的改善更为明显,而GGC-Zn²⁺-RSV在Runx2蛋白表达上的改善最为显著,表明其在促进成骨分化方面具有优越性。通过WB检测OCN带的相对灰度值(图4I和J)得出的结论一致,这些结果与ALP、阿利新红染色及SEM分析结果一致。综合来看,这些数据表明GGC-Zn²⁺-RSV在治疗中的绝对优势,表明RSV载药纳米医学与胍基修饰的结合是恢复炎症损伤成骨的最佳选择。这一结果可能是由于纳米粒子的内在稳定性高于纯RSV,且胍基接枝提高了纳米粒子在PDLSC中的生物利用度。
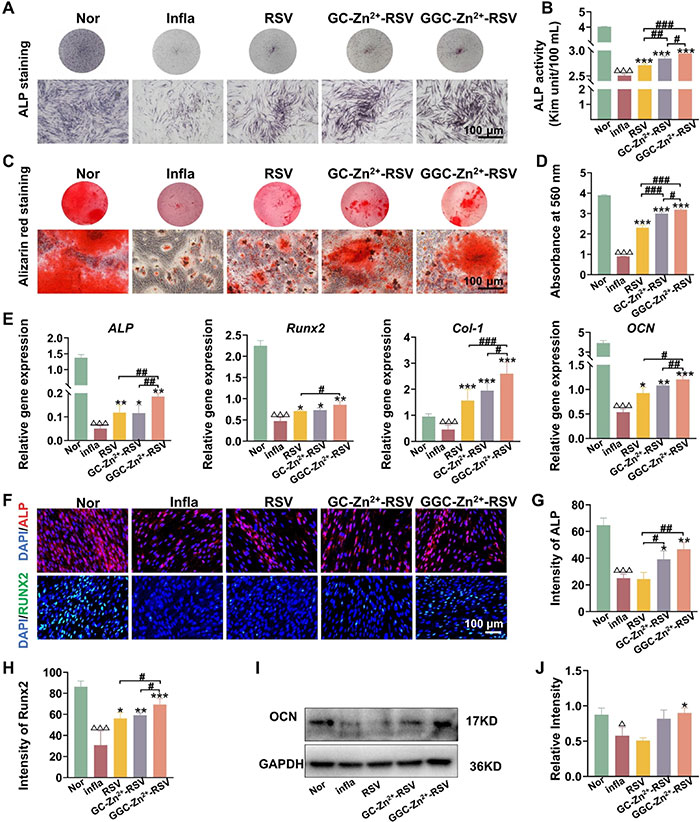
图4. 在炎症条件下(Infla)培养的PDLSCs经RSV、GC-Zn2+-RSV或GGC-Zn2+-RSV处理后的成骨分化。正常成骨培养基(Nor)处理的细胞作为对照。(A) PDLSCs在成骨诱导2周后的碱性磷酸酶(ALP)染色代表图像。(B) PDLSCs在成骨诱导2周后的ALP活性的定量分析(n=3)。(C) PDLSCs在成骨诱导3周后的Alizarin红染色代表图像。(D) Alizarin染色的钙沉积物定量(n=3)。(E) PDLSCs在成骨诱导2周后,qRT-PCR检测的成骨相关基因(ALP、Runx2、Col-1和OCN)的相对表达(n=5)。(F) 代表性免疫荧光图像显示成骨相关蛋白(ALP和Runx2)在成骨诱导2周后的表达。(G和H) PDLSCs中ALP(G)和Runx2(H)荧光强度的定量分析(n=3)。(I) PDLSCs在成骨诱导2周后,Western blot检测的OCN蛋白的相对表达。(J) OCN蛋白表达水平的半定量分析(标准化为GAPDH水平),以相对灰度密度表示(n=3)
(5)GGC-Zn²⁺-RSV缓解炎症条件下PDLSCs的线粒体功能障碍
该研究进一步验证了GGC-Zn²⁺-RSV在改善炎症引起的线粒体功能障碍和氧化应激中的作用。通过DCFH-DA检测发现,炎症环境中PDLSCs的ROS水平显著升高,而GGC-Zn²⁺-RSV处理组的ROS和脂质过氧化物(MDA)水平显著下降,显示其优越的抗氧化效果(图5A-C)。同时,GGC-Zn²⁺-RSV显著提高了SOD、GPx和CAT等抗氧化酶的活性,其效果优于RSV和GC-Zn²⁺-RSV组(图5D-F),表明胍基修饰增强了抗氧化效能。Transwell实验显示,GGC-Zn²⁺-RSV处理显著促进了PDLSCs的迁移能力。在观察线粒体功能时,JC-1染色表明GGC-Zn²⁺-RSV能有效改善线粒体膜电位(MMP),减少线粒体去极化现象(图5G-H)。此外,MitoSOX检测显示GGC-Zn²⁺-RSV处理组显著降低了线粒体ROS水平,并通过TEM观察发现其显著减少了炎症导致的线粒体肿胀,保持了线粒体结构的完整性(图5I-K)。ATP检测结果进一步表明,GGC-Zn²⁺-RSV组在线粒体功能恢复方面表现最佳,显著提高了细胞的ATP水平(图5L)。综上,GGC-Zn²⁺-RSV通过促进溶酶体逃逸和线粒体靶向递送,优化了RSV在线粒体中的利用,显著缓解了炎症环境中的氧化应激,保护了线粒体功能,从而极大地促进了PDLSCs的成骨分化能力。
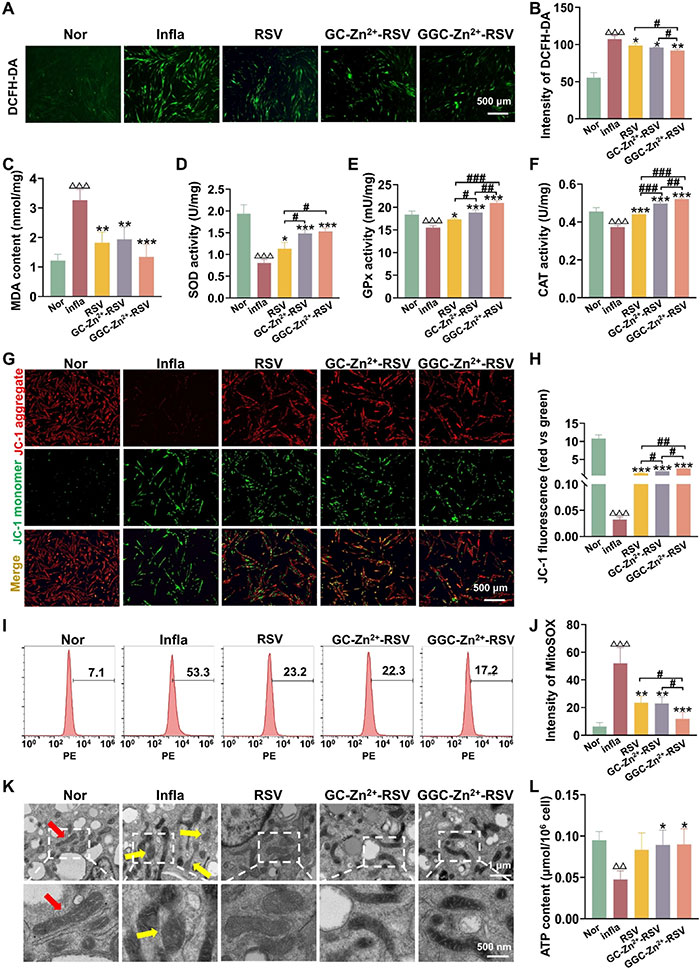
图5. GGC-Zn²⁺-RSV缓解炎症条件下PDLSCs的氧化应激和线粒体功能障碍。细胞在炎症条件(Infla)下培养,并分别用RSV、GC-Zn²⁺-RSV或GGC-Zn²⁺-RSV处理3天。正常成骨培养基(Nor)培养的细胞作为对照。(A) 代表性荧光图像显示通过DCFH‐DA探针检测的PDLSC诱导过程中细胞内ROS水平。(B) DCFH-DA荧光强度的定量分析(n=3)。(C) 各组PDLSCs中MDA的含量(n=3)。(D-F) 各组PDLSCs中抗氧化酶SOD(D)、GPx(E)和CAT(F)的表达水平(n=3)。(G) 通过JC-1染色检测PDLSCs的线粒体膜电位。红色荧光表示健康线粒体内JC-1聚集物的存在,而绿色荧光则表示膜电位受损线粒体内的细胞质JC-1单体。(H) PDLSCs线粒体膜电位的定量分析(n=3)。(I) 通过流式细胞术分析MitoSOX探针检测PDLSCs中线粒体ROS水平。(J) 线粒体ROS水平的定量分析(通过MitoSOX相对荧光强度表示)。(K) 代表性TEM图像显示PDLSC线粒体形态。红色箭头表示健康线粒体,黄色箭头表示肿胀的线粒体。(L) 各组PDLSCs的细胞内ATP产量(n=3)
(6)GGC-Zn²⁺-RSV促进实验性牙周炎的创面愈合
该研究进一步验证了GGC-Zn²⁺-RSV在缓解牙周炎引起的炎症损伤及抑制牙周组织破坏方面的治疗潜力。通过建立牙周炎大鼠模型,并局部注射纳米粒子(图6A)。micro-CT结果显示,结扎和LPS注射导致牙槽骨吸收加剧,牙齿周围骨高度降低,成功建立了牙周炎模型(图6B)。与牙周炎组相比,RSV、GC-Zn²⁺-RSV和GGC-Zn²⁺-RSV均显著减轻了牙周骨吸收,其中GGC-Zn²⁺-RSV治疗效果最佳。牙槽骨相关参数(BV/TV、Tb.Th及牙槽骨损失)进一步证实了这一结果(图6C)。牙周炎组显示BV/TV和Tb.Th显著降低,骨损失程度增加。RSV和GC-Zn²⁺-RSV组对骨参数和骨高度的影响有限,而GGC-Zn²⁺-RSV组显著改善了骨参数和骨高度,展现出在炎症条件下的显著优势。H&E和Masson染色(图6D和E)结果表明,正常组的牙周膜纤维密集、完整且排列有序,而牙周炎组的牙周组织中胶原纤维断裂、降解,并伴随大量炎症细胞浸润。三种治疗组均表现出一定的保护作用,显著减少了结缔组织的退化程度。由于纯RSV半衰期较短,其保护效果不够持久,牙周纤维稀疏且排列较乱,而GGC-Zn²⁺-RSV组的牙周膜纤维排列更加有序,与micro-CT结果一致。TRAP染色进一步验证了GGC-Zn²⁺-RSV对牙周组织的保护作用(图6F)。牙周炎组在牙槽骨边缘分布了大量红色沉淀物,表明炎症引起的破骨细胞生成活跃。而GGC-Zn²⁺-RSV组的染色细胞数量最少,破骨细胞活性显著受到抑制。这些结果表明,GGC-Zn²⁺-RSV在抑制牙周组织破坏和促进牙周炎创面愈合方面具有显著优势。
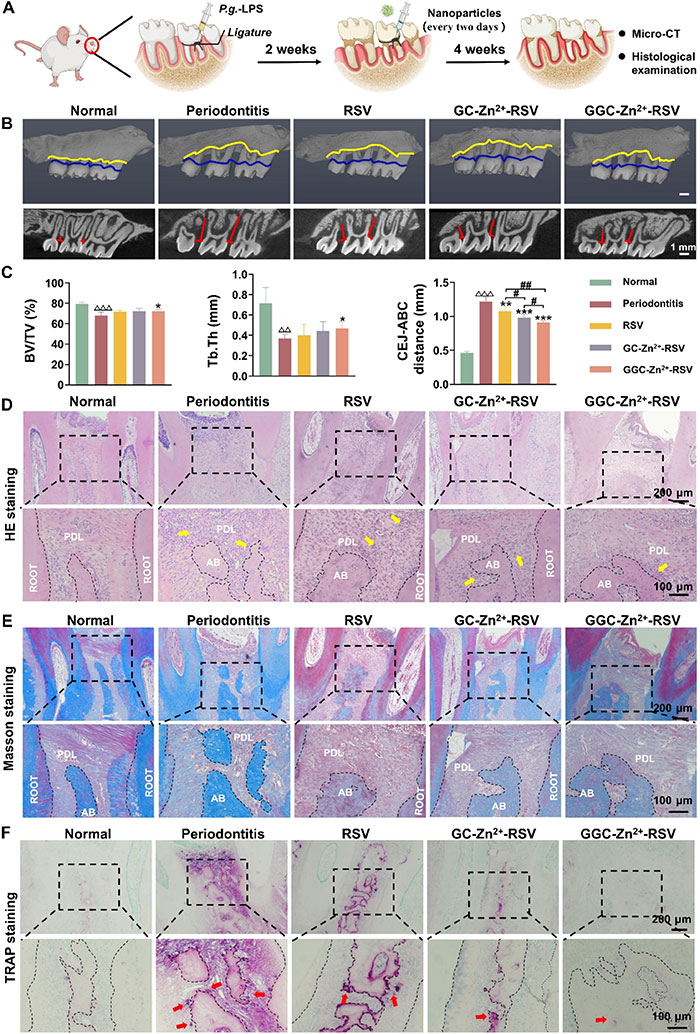
图6. GGC-Zn²⁺-RSV对牙周炎引起的骨破坏的治疗效果。RSV、GC-Zn²⁺-RSV和GGC-Zn²⁺-RSV分别在第2至第6周每两天注射一次到上颌第二磨牙的牙龈沟中。未添加任何试剂的PBS作为负对照(牙周炎)。(A) 示意图展示通过结扎和Porphyromonas gingivalis来源的脂多糖(P.g.-LPS)注射建立大鼠牙周炎模型,然后局部注射RSV、GC-Zn²⁺-RSV或GGC-Zn²⁺-RSV进行治疗。(B) 上颌骨的三维(上)和切面微CT图像(下)。黄色曲线表示牙槽骨嵴(ABC),蓝色曲线表示牙釉质-牙本质交界(CEJ)。红线表示第二磨牙在近中和远中位置的CEJ-ABC距离。(C) 通过微CT扫描定量分析BV/TV、Tb.Th以及上颌第二磨牙ABC与CEJ之间的距离(n=5)。 (D-F) 代表性H&E(D)、Masson(E)和TRAP(F)染色的牙周组织。黄色箭头表示炎症细胞,红色箭头表示TRAP阳性多核细胞。PDL代表牙周膜,root代表牙根,AB代表牙槽骨
(7)GGC-Zn²⁺-RSV通过缓解氧化应激和干细胞募集促进牙周健康
该研究评估了3-硝基酪氨酸(3-Nitrotyrosine)的表达以表征牙周组织中的氧化损伤。结果显示,牙周炎组中3-硝基酪氨酸表达显著升高,提示氧化应激水平较高(图7A和B)。GGC-Zn²⁺-RSV治疗显著降低了3-硝基酪氨酸的表达,优于GC-Zn²⁺-RSV,展现出最强的抗氧化效果。氧化应激会削弱干细胞的迁移能力,而增强干细胞迁移可能促进干细胞疗法。体内实验进一步评估了不同治疗对干细胞募集的影响,通过标记间充质干细胞标志物CD73和CD90(图7C-F),结果表明,健康牙周组织中CD73和CD90表达丰富,而牙周炎组织中表达减少。GGC-Zn²⁺-RSV组的CD73和CD90表达恢复程度最大,定量分析结果进一步证明其在干细胞募集中的显著优势。在成骨方面,ALP作为典型的成骨分化标志物,其免疫组化结果显示,ALP的表达趋势与CD73和CD90一致(图7G)。定量分析表明,GGC-Zn²⁺-RSV组与牙周炎组之间存在显著差异,GGC-Zn²⁺-RSV能够通过刺激ALP表达弥补炎症环境下成骨分化效率低下的问题(图7H)。综合来看,GGC-Zn²⁺-RSV通过动员干细胞和缓解氧化应激,在促进牙周健康再生方面展现出优异功能,其基于线粒体靶向能力的RSV纳米载体系统为治疗牙周炎提供了一种有效手段。
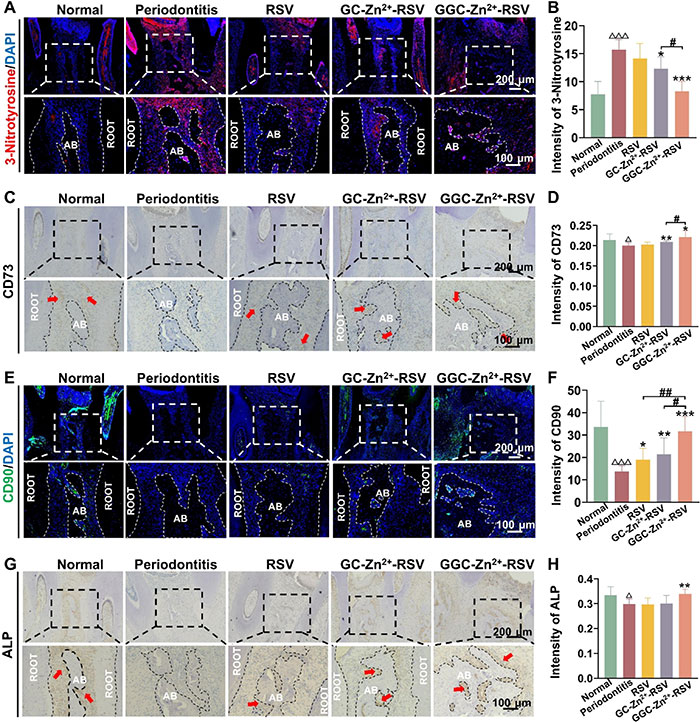
图7. GGC-Zn²⁺-RSV促进实验性牙周炎大鼠的抗氧化应激、干细胞招募和成骨作用。RSV、GC-Zn²⁺-RSV和GGC-Zn²⁺-RSV分别在第2至第6周每两天注射一次到上颌第二磨牙的牙龈沟中。未添加任何试剂的PBS作为负对照(牙周炎)。(A 和 B) 代表性免疫荧光图像(A)及定量分析(B)显示牙周组织中3-硝基酪氨酸的表达(n=5)。(C 和 D) 代表性免疫组化图像(C)及定量分析(D)显示牙周组织中CD73的表达(n=5)。(E 和 F) 代表性免疫荧光图像(E)及定量分析(F)显示牙周组织中CD90的表达(n=5)。(G 和 H) 代表性免疫组化图像(G)及定量分析(H)显示牙周组织中ALP的表达(n=5)。root表示牙根,AB代表牙槽骨。红箭头表示免疫组化染色阳性区域
【研究小结】
该研究设计了一种基于RSV的纳米载体系统,通过调节线粒体功能和激活修复机制,验证了GGC-Zn²⁺-RSV在促进PDLSCs分化和迁移中的作用,并证实其局部注射对实验性牙周炎的治疗是安全有效的。此设计实现了靶向治疗的目标,显著改善线粒体功能和RSV的利用率,同时降低了高剂量用药的副作用风险。然而,研究也存在一定局限性。该研究选择Zn²⁺驱动纳米粒子的组装,但其生物学效应尚未完全明确。此外,牙周微环境复杂,干细胞和免疫细胞在组织再生中均具有重要作用,但该研究仅关注PDLSCs,GGC-Zn²⁺-RSV对免疫细胞的影响尚待进一步探索。未来的研究方向将包括针对研究局限性的深入探讨,特别是细胞与生物材料相互作用机制的进一步研究。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

