
口腔致病性细菌感染(如龋齿)引发的生物膜问题是当前公共卫生领域的重大挑战。变异链球菌(S. mutans)通过形成酸性、缺氧的生物膜微环境,不仅导致牙齿矿化组织的破坏,还对抗生素治疗产生显著耐药性。目前临床常用的高剂量抗生素和手术切除方法因渗透性不足及对健康组织的损伤而存在局限性。可见光介导的光疗(包括光热疗法和光动力疗法)因其微创、可控等优势受到关注,但传统光疗方法在温控精确性、缺氧环境适应性和药物选择性方面仍存在不足。因此,开发一种结合光热疗法和光动力疗法的双模光疗药物递送系统,具有自调节机制并适应生物膜微环境,将为彻底清除细菌生物膜提供新的治疗思路,同时最大限度减少对健康组织的损伤。

针对口腔细菌生物膜感染治疗面临的抗生素耐药性、治疗损伤及光疗局限性等问题,南开大学张新歌和郭东升团队设计了一种适应性超分子纳米制剂,由含氟烃链的胍基修饰杯状芳烃(GC5AF5)与四磺酸锌酞菁(ZnPcS4)构成。该纳米制剂(ZnPcS4@GC5AF5, GFZ)能够在腺苷三磷酸(ATP)刺激下实现从光热疗法(PTT)到光动力疗法(PDT)的可控切换。研究表明,ZnPcS4的预装载导致光动力效应被抑制(关闭状态),光热活性增强(高状态);在光热疗法引发细菌膜破裂和ATP释放后,ATP的竞争包合触发ZnPcS4释放,恢复光动力活性(开启状态)并降低光热活性(低状态)。此外,GC5AF5的含氟烃链具备携氧能力,进一步提升了光动力疗法中单线态氧(1O2)的生成效率,加速生物膜的清除。通过集成GC5AF5的识别、组装及携氧特性,该制剂实现了PTT与PDT的动态切换,提高了治疗的精准性和效果,为难治性细菌生物膜感染提供了一种高效、低副作用的治疗方案。相关研究在2024年9月24日以“A Supramolecular Nanoformulation with Adaptive Photothermal /Photodynamic Transformation for Preventing Dental Caries”为题发表于《ACS Nano》 (DOI:10.1021/acsnano.4c06051)上。
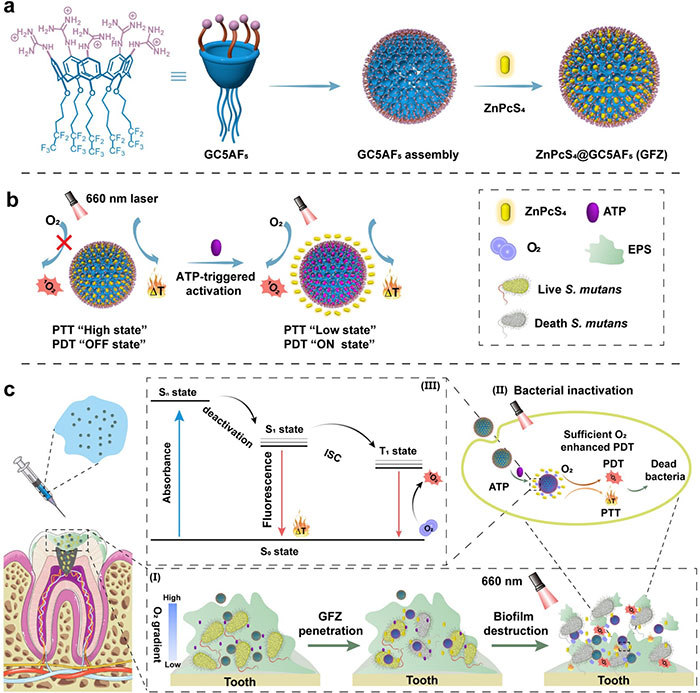
图1.采用PTT和程序激活PDT来恢复口腔菌群并预防龋齿
(1)超分子纳米载体及GFZ的设计与制备
研究人员设计了一种基于杯芳烃的适应性纳米制剂(GFZ),通过引入胍基修饰和氟碳链,构建了具有强结合能力和氧气携带功能的分子GC5AF5,并实现了与光敏剂ZnPcS4和ATP的高效结合。GFZ通过自组装形成稳定的纳米结构,动态光散射(DLS)结果显示粒径分布一致(约174 nm),如图 2b 所示。加载光敏剂ZnPcS4后,虽然粒径变化不显著,但表面电位和紫外-可见吸收光谱的变化验证了ZnPcS4的成功加载(图 2c 和 2d)。此外,GFZ在不同pH条件下表现出良好的稳定性(图 2e),透射电子显微镜(TEM)观察到其粒径约为130 nm的球形形貌(图 2f)。含氟碳链显著提升了GFZ的氧气携带能力,氧气溶解度测试表明GFZ溶液的氧气含量比PBS高出25%(图 2g),这有助于缓解生物膜的缺氧微环境。在ATP浓度梯度实验中,GFZ展现出良好的响应性,在高浓度ATP(>100 μM)条件下,ZnPcS4释放后荧光显著恢复(图 2j),而在低浓度ATP(10 nM)条件下无明显变化,表明该系统能够在感染部位高选择性激活光动力活性,从而实现治疗模式的按需切换并增强治疗效果。
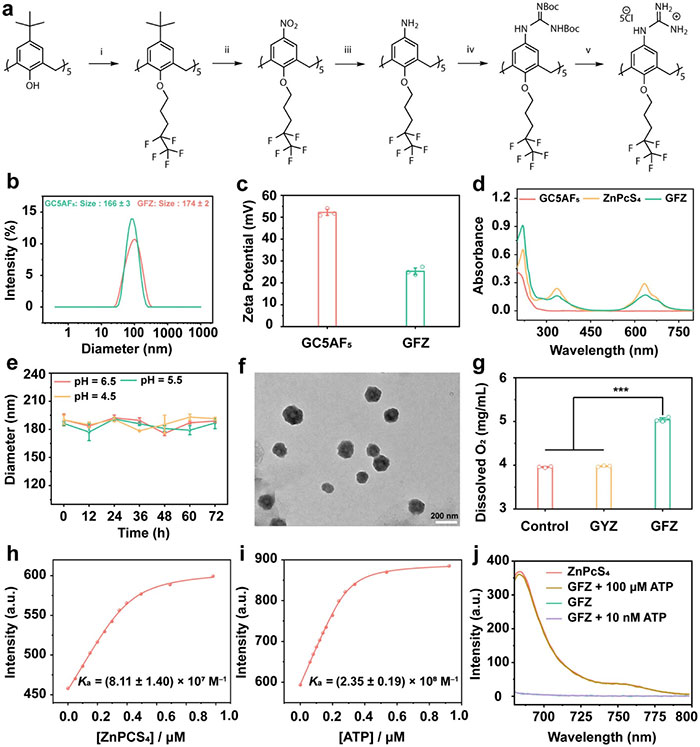
图2.GC5AF5和 GFZ的合成与表征。 (a) GC5AF5合成。(b) GC5AF5和 GFZ的动态光散射。 (c) GC5AF5和 GFZ的 Zeta 电位图。 (d) HEPES 缓冲液(10 μM,pH 7.4)中 GC5AF5、ZnPcS4和 GFZ的紫外可见吸收光谱。(e) 不同 pH 水平下 GFZ 的水动力学尺寸随时间的变化。(f) GFZ 的 TEM 图像。 (g) PBS、GYZ 和 GFZ 的氧解离。(h) HEPES 缓冲液(10 mM,pH 7.4)中 fluorescein@GC5AF5 (0.5/0.7 μM) 与 ZnPcS4的竞争荧光滴定符合 1:1 竞争结合模型(λex = 512 nm)。 (i)基于 1:1 竞争结合模型(λex = 512 nm),分析了使用荧光素@GC5AF5 (0.5/0.7 μM)对 HEPES 缓冲液(10 mM,pH 7.4)中的 ATP 进行竞争性荧光滴定。(j)在添加 10 nM 和 100 μM 浓度的 ATP 后,在没有和存在 GC5AF5(2.0 μM)的情况下记录了 ZnPcS4 (2.0 μM)的荧光光谱
(2) GFZ的光热和光动力功效
本研究评估了GFZ的光热和光动力性能。光热性能测试表明,不同浓度的GFZ溶液在660 nm激光照射下显著升温,100 μM GFZ溶液3分钟内升至约60 °C并保持稳定,足以引发蛋白质变性和细菌死亡(图 3a 和图3b),在五次光照开关循环中表现出优异的稳定性(图 3c)。GFZ的光热转换效率达到24.4%,是游离ZnPcS4的3倍(图 3d),归因于杯芳烃的络合诱导猝灭效应。光动力性能测试显示,在ATP加入前,GFZ的光动力活性几乎完全被猝灭,而ATP置换后荧光强度显著恢复,表明光动力活性成功恢复(图 3e)。此外,GFZ较对照组GYZ产生了更多的活性氧(ROS)(图 3f),这得益于氟碳链的携氧能力,显著提升了光动力疗效。GFZ的工作原理如图 3g 所示,在ATP竞争结合前,ZnPcS4的激发单线态通过光诱导电子转移回到基态,表现为荧光猝灭和增强的光热效应;在ATP加入后,ZnPcS4被释放,模式切换至光动力疗法(PDT),ZnPcS4通过系统内交叉(ISC)激发分子氧生成单线态氧(^1O2),伴随荧光恢复和少量热效应。此外,氟碳链的携氧功能进一步增强了ROS的生成。综上,GFZ兼容PTT和PDT两种模式,可按需切换并提升疗效,为难治性生物膜感染的智能光疗提供了有力工具。
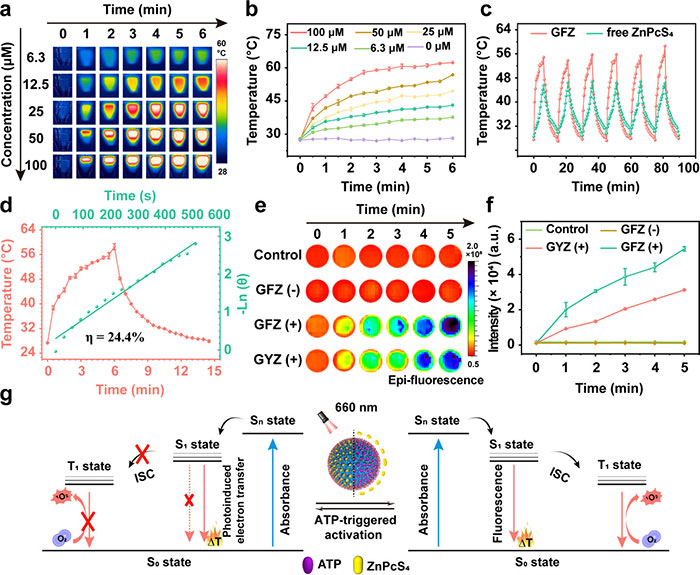
图3. GFZ 的受控光热和光动力活性。(a)伪彩色图像和(b)不同 GFZ 浓度下随照射时间的温度变化。(c)六次激光照射期间 GFZ 的温度曲线。(d)660 nm 下 GFZ 的光热转换效率。使用 2′,7'-二氯荧光素二乙酸酯法,PBS、GFZ (+,添加 ATP)、GYZ (+,添加 ATP) 和 GFZ (−,无 ATP) 的 ROS 生成随时间的变化:2′,7′-二氯二氢荧光素的荧光成像 (e) 和荧光强度 (f)。(g)GFZ 可增强光热效应和光动力效应的原理示意图
(3) GC5AY 和 GC5AF5对变形链球菌的体外抗粘附活性
本研究评估了GC5AY和GC5AF5的细菌捕获能力、抗黏附性能及穿透细菌细胞壁的能力。通过共培养实验和共聚焦激光扫描显微镜(CLSM)成像发现,PBS组中的细菌呈分散状态,而GC5AY和GC5AF5处理组形成了明显的细菌聚集体,表明两种纳米载体对变异链球菌(S. mutans)具有良好的诱导聚集能力。在80分钟内,GC5AY和GC5AF5的聚集率分别达到约98.1%和97.6%,且聚集效率随样品浓度增加而提高(图 4a 和图 4b)。在人类牙龈成纤维细胞(HGF)模型中,GC5AF5显著减少了变异链球菌对宿主细胞的黏附,细菌黏附率降至8.8 ± 3.3%(图 4c),CLSM图像进一步证实了GC5AF5的抗黏附特性(图 4d)。此外,FITC标记实验表明,GC5AF5能够穿透细菌细胞壁并进入细胞内部,细菌簇表现出强绿色荧光(图 4e 和图 4f)。三维共定位成像显示,FITC的荧光与细菌的蓝色荧光重叠,进一步证实了GC5AF5在细菌内部的分布。穿透能力可能与GC5AF5中阳离子胍基团与细菌膜上负电荷磷酸基团之间形成的多个盐桥有关。综上,GC5AY和GC5AF5不仅具有优异的细菌捕获和抗黏附能力,还能穿透细菌细胞壁,为增强PDT疗效提供了良好基础。
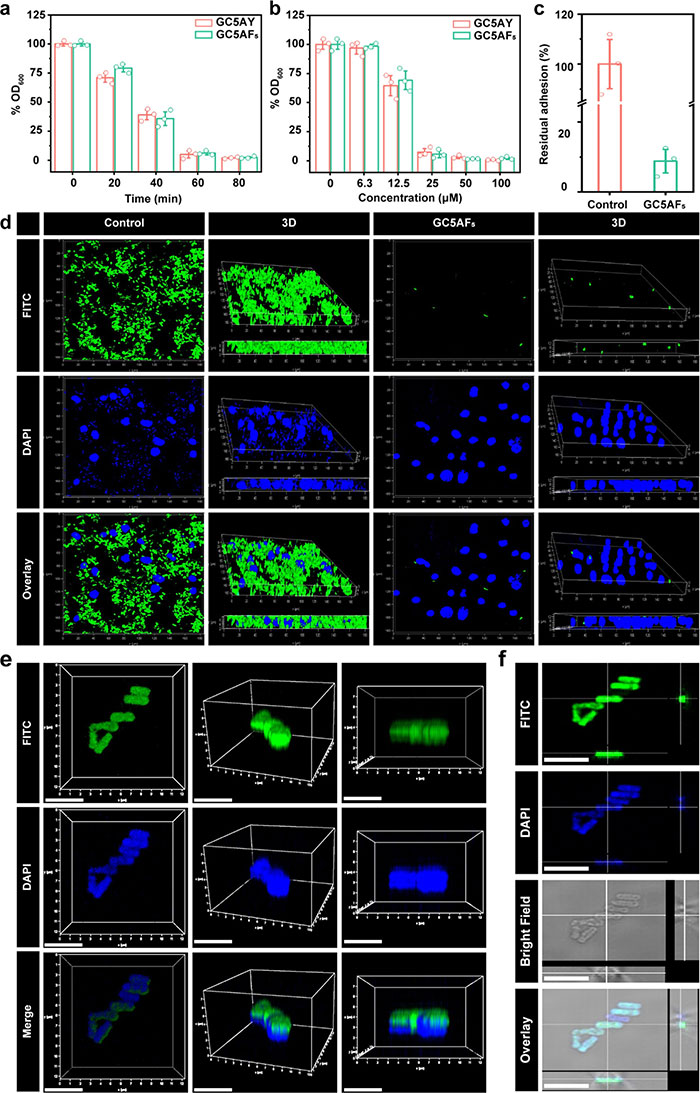
图4. GC5AF5在细菌聚集、抗粘附和内化方面的功效。GC5AY 和 GC5AF5在不同 (a) 时间间隔和 (b) 浓度下对抗变形链球菌的聚集率,以 OD600的百分比变化表示。 (c) 用 GC5AF5处理后变形链球菌对 HGF的残留粘附。 (d) 用无菌 PBS 洗去未粘附的细菌后,用 DAPI 染色的 HGF 的 CLSM,感染了用 FITC 标记的变形链球菌,有或没有 GFZ。 (e、f) CLSM 图像显示细菌对 FITC 标记的 GC5AF5的内化
(4) GFZ的体外抗菌活性
本研究通过标准菌落计数法和活/死染色实验评估了GFZ对变异链球菌(S. mutans)的光疗抗菌活性。在无660 nm激光照射下,GC5AY、GC5AF5、GFZ@ATP和GFZ(−)组的杀菌活性较弱,但在ATP处理后,GFZ组的杀菌效率显著提高,表明ATP触发ZnPcS4释放后激活了GC5AF5的抗菌活性(图 5a 和图 5b)。在660 nm激光照射下,GYZ和GFZ组的杀菌率分别达到86.7%和99.9%,GFZ表现出更高的抗菌效率,这归因于GC5AF5的携氧能力增强了PDT过程中单线态氧(^1O2)的生成。活/死染色实验进一步验证了GFZ的抗菌活性(图 5c)。PBS组中细菌呈分散状态,且大部分为绿色,表明细菌存活;而GFZ处理组中的细菌则形成聚集,随着处理组从GC5AY、GC5AF5到660 nm照射下的ZnPcS4、GYZ和GFZ,黄色荧光信号(绿色和红色叠加)逐渐增强,表明细胞损伤和死亡。这表明富含胍基的GC5AF5通过多个盐桥与细菌膜上的阴离子组分(如脂多糖和磷脂)快速结合,从而增强了光疗的抗菌效果。扫描电子显微镜(SEM)观察显示,PBS组中的变异链球菌呈原始杆状,表面光滑且结构完整;而在660 nm激光照射下,GYZ和GFZ处理组的细菌表面出现明显损伤和不规则孔洞,其中GFZ组几乎完全杀灭了细菌(图 5d)。这些结果表明,GC5AF5通过提高ZnPcS4周围的氧浓度并延长ROS寿命,在体外显著增强了光动力抗菌活性。
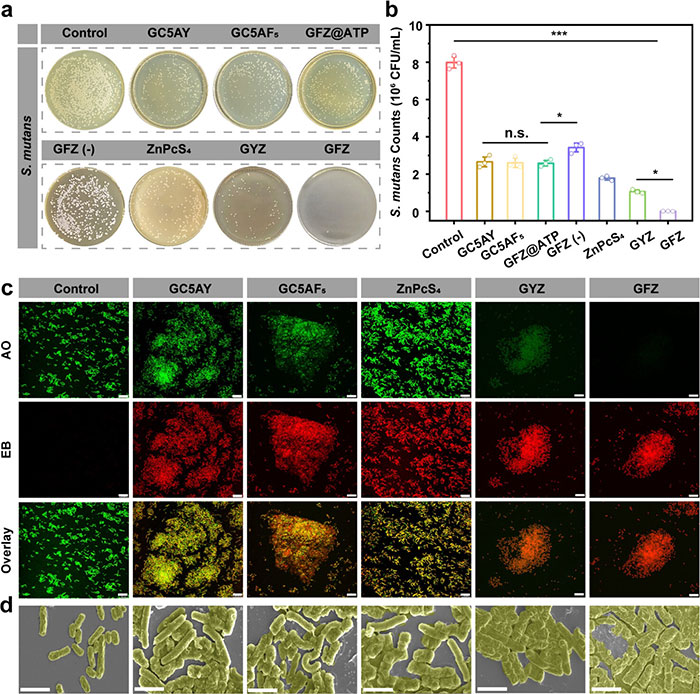
图5. 660 nm 照射下 GFZ 对变形链球菌的体外抗菌效果。(a)用 PBS、GC5AY、GC5AF5 、GFZ@ATP、GFZ(-,无光)、ZnPcS4 、GYZ 和 GFZ 组处理后的变形链球菌菌落的照片表示。(b)通过平板计数法定量分析暴露于不同处理后的变形链球菌存活率。(c)不同处理后记录的具有 AO/EB 双荧光染色的变形链球菌的 CLSM 图像。(d)处理前后变形链球菌形态的 SEM 图像
(5)增强生物膜渗透和体外抗生物膜评估
本研究评估了GFZ在抗细菌生物膜中的渗透能力和光疗效果。GFZ在660 nm光照下激活光热特性(图 6a),引发细菌膜破裂和ATP释放,触发ZnPcS4释放,实现PTT和PDT的切换。标记实验显示,GFZ能在60分钟内完全穿透厚约16 μm的成熟生物膜(图 6b),并通过缓解缺氧微环境显著提高ROS生成和PDT疗效(图 6c)。荧光成像与结晶紫染色显示,GFZ可有效减少生物膜质量,清除率超过90%,明显优于GYZ组(图 6d–6f)。在人类离体牙模型中,GFZ组在660 nm光照下5分钟的清除率达94%(图 6g 和图 6h),得益于ATP激活的ZnPcS4释放、携氧能力及治疗模式切换,展现出高效的抗生物膜潜力。
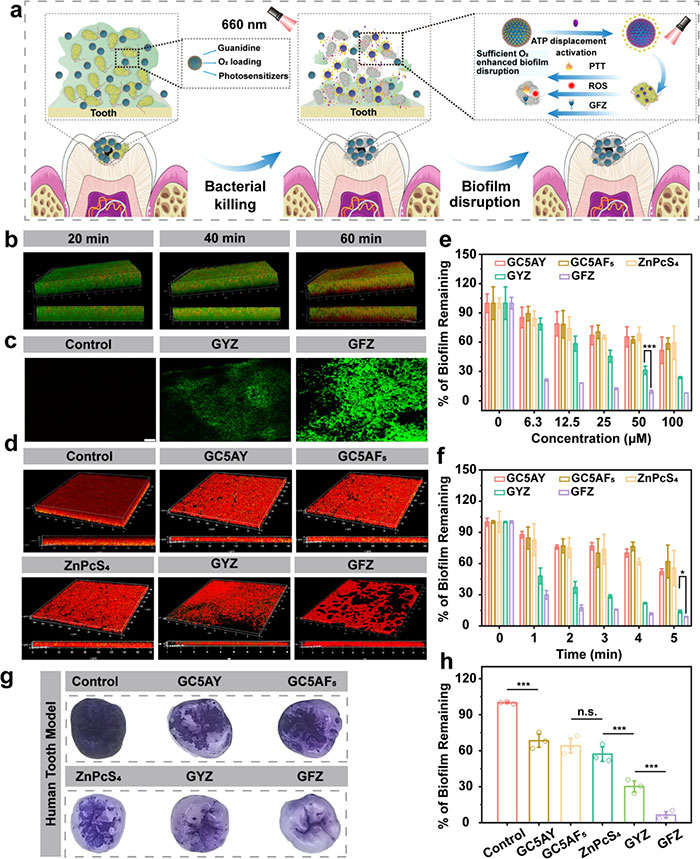
图6. GFZ 穿透和清除生物膜。(a)ATP 响应型 GFZ 示意图。(b)CLSM 图像展示了 20、40 和 60 分钟处理后罗丹明 B@GC5AF5在变形链球菌生物膜内的深度依赖性渗透。(c)2′,7′-二氯二氢荧光素的荧光强度。(d)各种处理后残留生物膜的活/死荧光染色图像。(e)不同处理浓度下剩余变形链球菌生物膜的定量分析。(f)评估不同持续时间的 660 nm 激光照射下生物膜减少的情况。(g)去除孤立牙齿上变形链球菌生物膜的效果。(h)OD590值用于评估不同样品处理的生物膜根除效果
(6)体内抑制龋齿
本研究在体内评估了GFZ对防治龋齿的效果。建立的啮齿动物模型模拟了严重人类龋齿的特征,变异链球菌(S. mutans)感染的大鼠幼崽被喂食高糖饮食,并接受GFZ及660 nm光照(1.0 W/cm²)处理(图 7a)。红外热成像显示,处理组口腔在5分钟内加热至46°C,表明GFZ在体内仍具有良好的光热性能(图 7b)。在21天治疗期间,大鼠健康状况良好,体重未见明显差异(图 7c)。抗菌实验结果显示,GFZ可消灭99%的变异链球菌,显著优于GC5AY/GC5AF5(33%)和GYZ(62%)(图 7d 和图 7e)。结晶紫染色结果显示,GFZ处理后牙齿表面的龋致细菌生物膜几乎完全被清除,成功阻止了龋齿的发展(图 7f 和图 7g)。
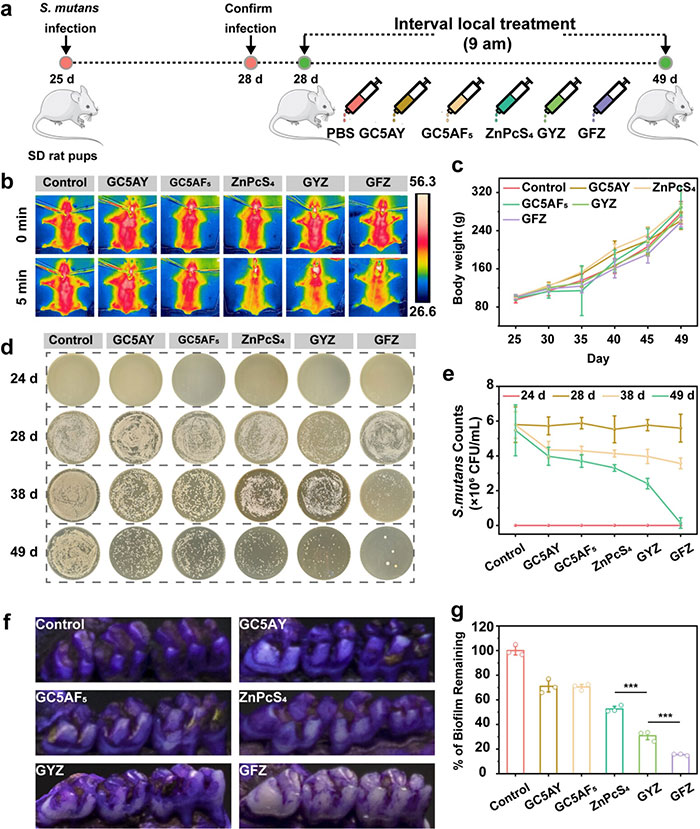
图7. 局部 GFZ 对体内S. mutans生物膜相关口腔疾病的治疗效果。(a) 治疗S. mutans生物膜感染大鼠幼崽的实验程序示意图。 (b) 使用各种治疗方法对S. mutans生物膜感染大鼠幼崽的光热图像。(c) 实验期间大鼠幼崽的体重。 (d) 不同治疗组在第 24、28、38 和 49 天的 BHI 琼脂平板上的细菌菌落照片。(e)治疗后S. mutans生物膜感染糖尿病大鼠的剩余细菌变化。(f) 感染变形链球菌生物膜后的大鼠幼崽牙齿的代表性照片和相应的结晶紫染色图像。 (g) 通过结晶紫染色对剩余的生物膜进行量化
通过Keyes评分和微型CT分析进一步量化GFZ对龋齿的防治效果。结果表明,与其他组相比,GFZ组在釉质及牙本质损伤(E、Ds、Dm、Dx)评分上显著降低,牙齿光滑面和沟裂处的龋病也显著减少(图 8a–8c)。微型CT图像显示,GFZ组牙釉质脱矿程度最低,牙齿光滑面和沟裂处均保持完整;而其他组牙釉质脱矿严重,部分达到牙髓腔(图 8d)。综上,GFZ通过消除致龋生物膜、抑制牙釉质脱矿及阻止龋病发展,展现出卓越的体内防龋潜力,为龋齿治疗提供了一种高效策略。
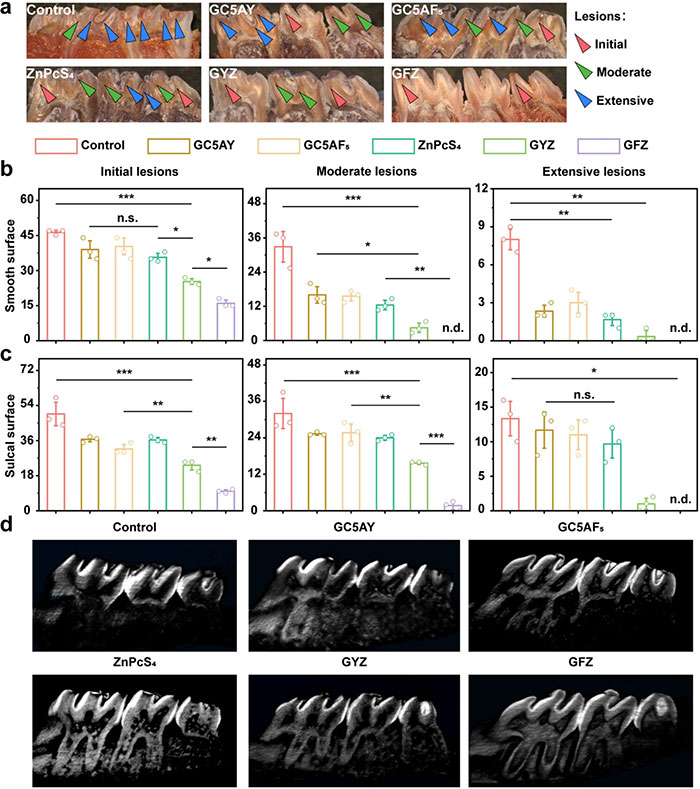
图8. 使用 Keyes 评分和微型 CT 分析评估防龋治疗效果。(a)龋病病变的代表性图像。(b)从光滑表面记录的龋齿评分。(c)从龈沟表面记录的龋齿评分。龋齿评分是根据 Larson 修改的 Keyes 评分系统记录的。(d)活体上颌磨牙的微型 CT 图像
(7)对体内口腔微生物群的影响
本研究评估了GFZ对口腔微生物多样性和组织毒性的影响。微生物组测序显示,各治疗组的口腔微生物组成无显著差异,Shannon指数(多样性)和Chao指数(丰富度)分析表明GFZ组与对照组在微生物多样性方面无明显差异(图 9a–9c)。ASV水平的聚类分析显示,GFZ组和PBS组的微生物群结构相似(图 9d)。值得注意的是,GFZ组中与致龋相关的链球菌属(Streptococcus)丰度显著降低,表明GFZ可能通过减少酸性环境来抑制龋齿的发展(图 9e)。Bray-Curtis距离主成分分析(PCA)进一步证实了各组微生物群结构无显著变化(图 9f)。苏木精-伊红(H&E)染色结果表明,GFZ对牙龈和腭组织无明显毒性,未出现增生、炎症或坏死迹象(图 9g)。综上,GFZ能够有效抑制口腔疾病进展,同时保持口腔微生物生态平衡和组织完整性,为安全、高效的口腔疾病治疗提供了潜在的解决方案。
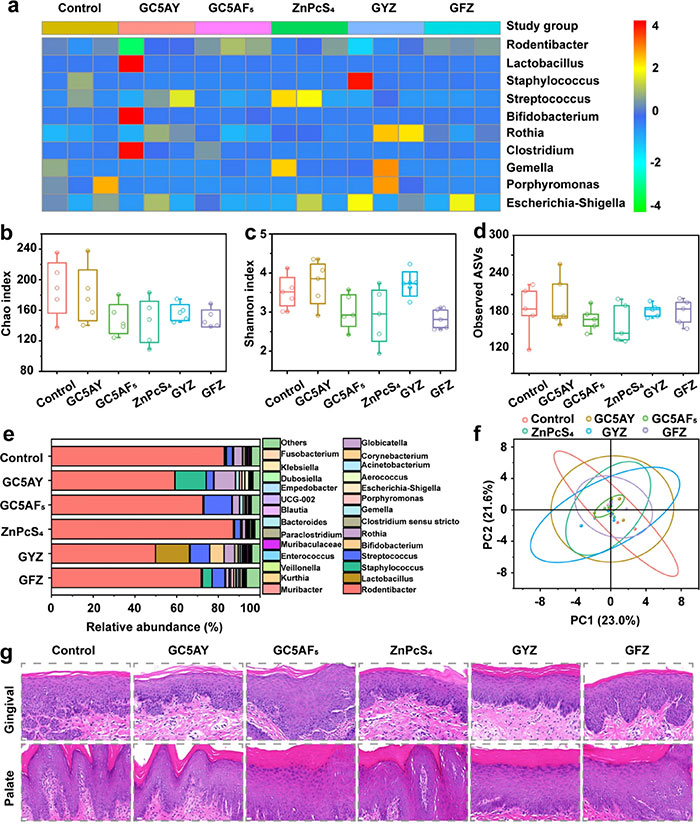
图9. 局部应用对 21 天治疗后口腔微生物群和软组织的影响进行评估。(a)按治疗组分类的所有样本中鉴定出的关键细菌属的热图表示。(b)Shannon 多样性指数和(c)OTU 级别的 Chao 丰富度指数,比较微生物多样性。(d)各组间丰富度和多样性没有显著差异。(e)不同样本组中物种级别分类群的相对丰度。(f)加权 UniFrac PCA,表示每组的 β 多样性;分析显示,GFZ 组在样本之间具有相似的组成。(g)接受不同治疗组治疗的动物牙龈和腭组织的组织病理学
小结:
该研究团队开发了一种强大的超分子纳米制剂,可以自适应地增强不同光疗模式的治疗效果,并根据ATP反应智能地切换治疗模式。得益于杯芳烃支架的络合诱导猝灭和氟碳链的携氧能力,GC5AF5作为大环载体,可以适应PTT和PDT。此外,我们通过高效识别细菌破裂后释放的ATP,实现了从PTT到PDT的按需转换。在避免局部高温的同时产生大量的ROS,不仅实现了对病原菌生物膜的精准消灭,而且还最大限度地减少了对正常组织的损伤。此外,由于带正电的胍基和疏水性氟碳链的修饰,GC5AF5还可以破坏细胞膜的完整性,表现出一定的抗菌能力。因此,GC5AF5既是一种强大的载体,又具有治疗活性,充分体现了其多功能整合特性。大环化合物易于修饰、良好的识别和组装性能使其成为多功能整合的优质平台,在抗菌膜等复杂疾病的联合治疗中具有巨大的潜力。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

