
近年来,前交叉韧带(ACL)损伤的发生率持续上升,导致膝关节不稳定、疼痛及功能障碍,并增加软骨损伤和骨关节炎的风险。ACL通过细胞外基质(ECM)形成韧带与骨之间的机械连接,但损伤后缺乏有效的自我修复能力,目前重建手术仍是主要治疗手段。PET人工韧带因其高机械强度和术后恢复快等优点在ACL重建中广泛应用,但其惰性和疏水性导致术中摩擦产生的碎片持续激活M1巨噬细胞,诱导慢性炎症微环境,同时移植物-骨界面形成无序纤维瘢痕组织,阻碍血管和骨组织生长,导致骨隧道扩大和移植物融合不良,成为临床应用中的关键挑战。现有的表面改性策略(如β-TCP、丝素蛋白、石墨烯和羟基磷灰石)尽管改善了成骨能力,但忽视了对纤维瘢痕组织和炎症的调控。

针对上述问题,华南理工大学刘昌胜院士团队开发了一种多层免疫调节水凝胶涂层来控制愈合过程中移植物-骨界面的早期炎症。该功能涂层包括两个关键模块:(i)抗炎糖模块,其中糖胺聚糖(GAG)类似物——硫酸多糖(SCS)调节巨噬细胞极化并结合生长因子,从而减少炎症细胞因子的释放并防止瘢痕组织形成。(ii)润滑模块由GelMA水凝胶组成,模拟细胞外基质(ECM),支持细胞生物相容性,同时实现SCS的可控释放。此外,原生ACL表面具有水合润滑层,可减轻典型生理条件下的机械刺激。受此启发,该研究团队将具有增强交联密度和更多交联点的8臂PEGDA纳入GelMA水凝胶的分子网络中。PEGDA水凝胶和水分子之间的氢键稳定了润滑区域,降低了机械摩擦,并减少了最初的炎症刺激。此外,它还提高了凝胶的机械强度和稳定性。这种抗炎方法有望显著影响ACL重建,并在生物医学中具有更广泛的应用潜力。该文章于2024年11月15日以《Immunoregulative coating for scarless healing in anterior cruciate ligament reconstruction》为题发表于《Bioactive Materials》上(DOI: 10.1016/j.bioactmat.2024.11.007)。
研究示意图
(1)水凝胶的制备与表征
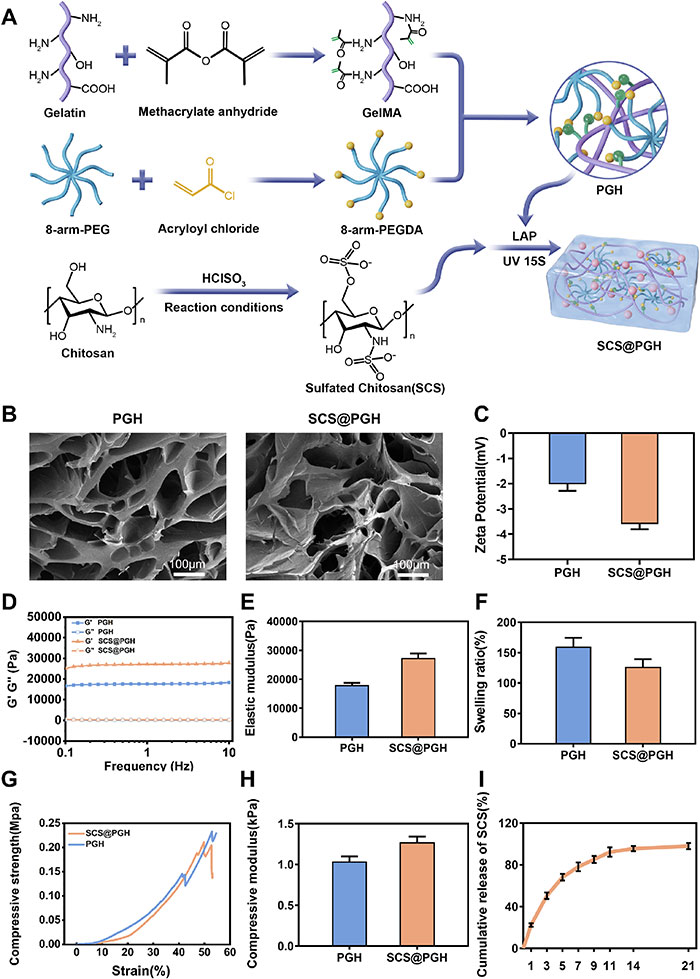
该团队开发了一种双网络水凝胶GelMA-PEGDA(PGH),作为SCS控制释放的载体(SCS@PGH)(图1A)。通过1H-NMR在5.4和5.6 ppm处的新信号证实了GelMA成功偶联甲基丙烯酸(MA),甲基丙烯酸化程度约为39%。结合PEGDA后,进一步增强了水凝胶的结构,并通过加入SCS和光引发剂(LAP)在蓝光下形成二次网络SCS@PGH。SEM图像显示,PGH和SCS@PGH均具有数百微米的多孔结构,SCS的加入未显著改变孔隙大小(图1B)。此外,SCS的引入使zeta电位由-2 mV略微下降,增强了水凝胶与生长因子的静电相互作用(图1C)。频率扫描(0.1-10 Hz)表明,SCS@PGH的存储模量(G')始终高于损耗模量(G″),达到25 kPa,表现出稳定的网络结构(图1D),其弹性模量略高于PGH,可能由氢键和静电相互作用增强所致(图1E)。SCS的加入将水凝胶的膨胀率从150%降低至120%,但未显著影响孔隙度,确保了充分的营养和气体交换(图1F)。压缩试验显示SCS@PGH的压缩模量为1.0-1.5 kPa(图1G, H)。甲苯胺蓝定量分析结果表明,SCS在初期快速释放,随后释放速率减缓并达到平台期(图1I)。
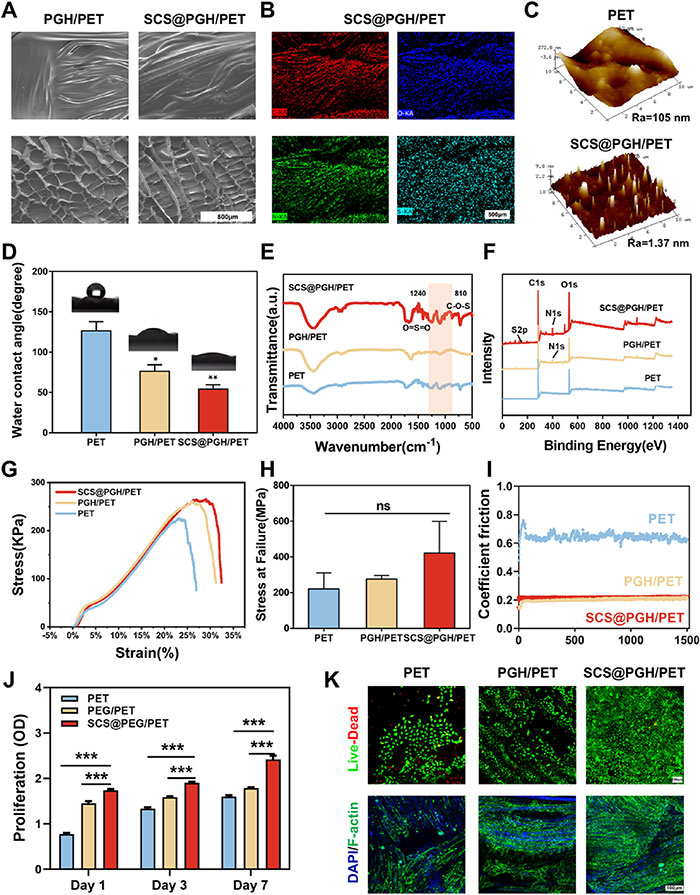
图1. 水凝胶的制备与表征。A)合成水凝胶的化学结构。B)水凝胶的SEM图像。C) PGH和SCS@PGH的Zeta电位。D)水凝胶的储存模量(G′)和损耗模量(G″)。E)两种水凝胶在完全膨胀状态下的压缩弹性模量。F)两种水凝胶的溶胀比。G)压缩曲线和H) PGH和SCS@PGH水凝胶的压缩模量。I)SCS@PGH中SCS的累积释放曲线
(2)涂层的制备与表征
通过O₂等离子体处理制备的水凝胶涂层在PET膜与水凝胶之间形成弱交联,确保涂层牢固附着于基材。随后,将不同水凝胶溶液涂覆在PET表面,制得具备润滑与抗炎性能的PGH/PET和SCS@PGH/PET涂层。SEM与AFM分析表明,涂层表面均匀光滑,冻干后呈多孔结构(图2A)。EDS验证了SCS@PGH/PET中C、O、N、S等元素的均匀分布(图2B),确认了SCS的成功掺入。AFM数据显示,SCS@PGH/PET的表面粗糙度由PET的105 nm降至1.37 nm(图2C),而WCA测试表明,涂层显著提升了亲水性,从而促进细胞黏附与流体渗透(图2D)。FTIR与XPS分析进一步确认了涂层的化学组成,其中在1240 cm⁻¹和815 cm⁻¹处分别检测到O=S=O和C-O-S基团特征峰,XPS检测到S2P峰(图2E、F)。机械性能测试表明,PGH/PET与SCS@PGH/PET组摩擦系数约为0.2,比纯PET降低66.67%(图2G-I),展现出优越的润滑性与拉伸强度。MTT实验表明水凝胶涂层显著提高细胞增殖率,尤其在SCS@PGH组中表现突出(图2J)。活/死染色与肌动蛋白染色进一步证实涂层增强了HUVEC细胞的黏附与延展性,利于细胞的快速定植与组织修复(图2K)。综合来看,SCS@PGH/PET涂层在润滑性能、生物相容性及细胞支持方面表现优异,为组织修复提供了理想的涂层材料。

图2. 涂层的制备与表征。A)涂层的SEM显微照片。B)显示SCS@PGH/PET元素分布的EDS图。C) PGH/PET和SCS@PGH/PET的AFM图像。D)不同涂层的水接触角。E) FTIR光谱。F) XPS光谱。G)抗拉强度,H)不同涂层失效时的应变。I)摩擦时间曲线系数。J)不同涂层对HUVECs细胞活力的影响。K) HUVECs的活细胞/死细胞染色和共聚焦荧光图像
(3)水凝胶包被移植物的体外免疫调节
为探讨水凝胶涂层对巨噬细胞极化的影响,该研究团队通过体外培养模型研究了PGH/PET、SCS@PGH/PET和PET样品对骨髓源性巨噬细胞(BMDM)的刺激作用(图3A)。流式细胞术初步结果显示,SCS显著促进M1向M2极化(图3B、C)。免疫荧光染色表明,SCS@PGH/PET处理组的巨噬细胞CD206阳性标记物明显增加,形态以拉长为主;而PET处理组CD197表达更高,形态以圆形单核细胞为主(图3D)。PGH/PET组的CD197阳性细胞减少,CD206表达水平最低。M1和M2相关基因表达分析进一步证实了这些结果(图3E),显示SCS显著上调修复性抗炎基因(CD206、TGF-β、VEGF),并下调促炎基因(IL-1β、IL-6、TNF-α)。ELISA检测共培养3天的细胞因子分泌量(图3F)显示,SCS处理组M1相关因子(TNF-α、IL-1β、IL-6)分泌减少,而M2相关因子分泌显著增加,尤其是TGF-β增长最为显著。这些结果表明,SCS显著促进了促炎M1向抗炎M2的极化,同时调节炎症因子的分泌,进一步验证了水凝胶润滑特性对改善巨噬细胞促炎状态的积极作用。
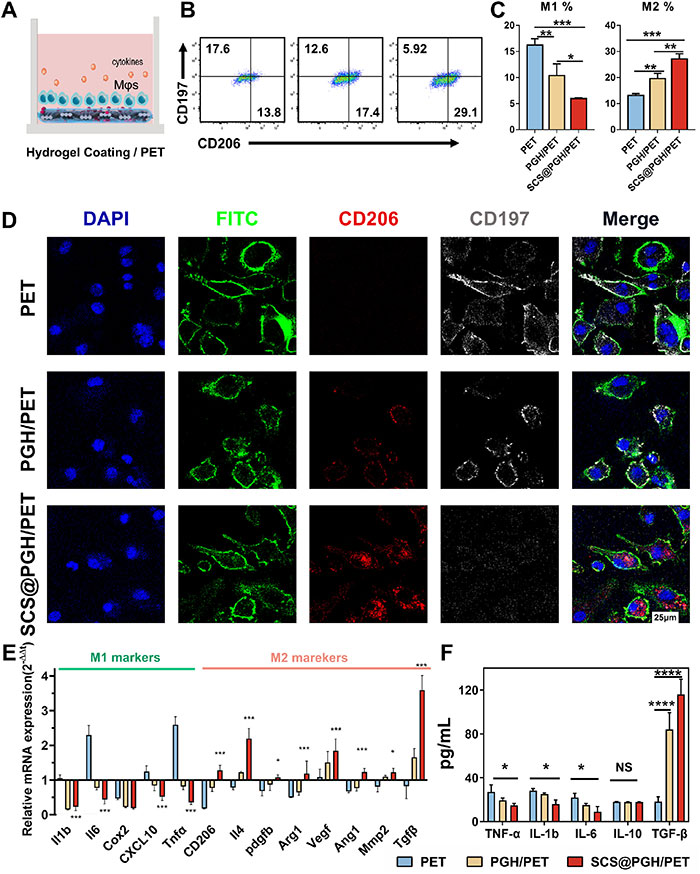
图3.Mφs对不同涂层的体外免疫应答。A) Mφs在不同样品上共培养示意图。B) m - φs的极化C) CD197 (M1)和CD206 (M2)在样品模拟3天后(n = 3)通过流式细胞术定量分析。D)不同样品上3天后m - φs极化的荧光显微镜图像。E)巨噬细胞相关基因M1和M2的相对mRNA表达水平。F)炎症因子的ELISA分析
(4)包衣接枝处理Mφs CM对体外血管生成行为的影响
植入物引发的炎症反应常伴随血管生成,为组织修复提供氧气和营养。本研究评估了巨噬细胞对内皮细胞血管生成行为的影响,通过巨噬细胞条件培养基(CM)培养人脐静脉内皮细胞(HUVECs)开展实验。结果显示,SCS@PGH/PET组显著增强HUVEC的迁移能力,48小时伤口愈合率达78%,为PET组的1.6倍(图4A、B)。血管生成基因分析表明,SCS@PGH/PET组VEGF、Ang1和Esm-1基因表达显著上调(图4C)。免疫荧光染色显示,SCS@PGH/PET组VEGFR2表达增强,表明润滑水凝胶包被和SCS的加入通过激活受体促进内皮细胞的增殖、迁移及功能(图4D)。在离体主动脉环模型中,SCS@PGH/PET组微血管生成显著增强,表现为动脉环发芽和尖端细胞突出(图4E、F)。此外,巨噬细胞极化不仅促进血管生成,还影响成骨分化。SCS@PGH/PET组在巨噬细胞CM刺激下,第7天碱性磷酸酶(ALP)染色最为显著,表明成骨分化加快;茜素红S染色进一步证实矿化结节形成最多,表明成骨效率提升。这些结果表明,SCS通过调节巨噬细胞极化,不仅增强血管生成,还显著促进骨髓间充质干细胞的成骨分化能力。
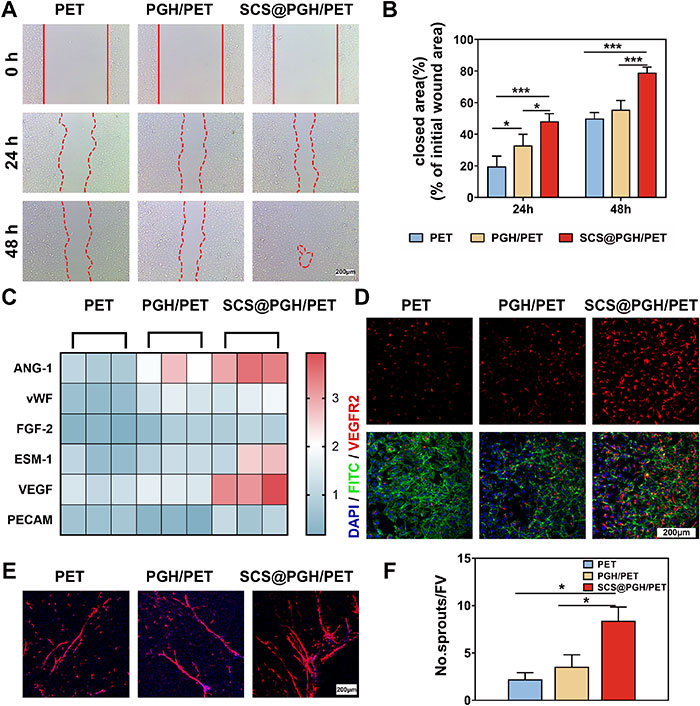
图4. SCS在体外诱导m - φ介导的动脉生成。A)细胞迁移实验:光学图像和B)涂层刺激后24和48 h的伤口愈合定量实验。C) m - φs CM中HUVECs血管生成相关mRNA的相对表达。D) VEGFR2标记的免疫荧光染色。E)具有代表性的大鼠主动脉环生长图像;F)与Mφs共培养7天血管新生芽的定量
(5)减少体内炎症
基于体外实验中优异的免疫调节和促血管生成活性,该研究团队在小鼠ACLR模型中评估了水凝胶涂层对肌腱-骨界面组织修复的效果。H&E染色显示,术后14天和28天,PET组存在显著炎症细胞浸润及异常血管化,而PGH/PET组炎症较少,SCS@PGH/PET组表现出微血管形成及骨组织整合(图5A、B)。免疫荧光染色进一步证实,SCS@PGH/PET组在巨噬细胞极化中显著促进了M2表型(CD206+)的数量增加,抑制了M1表型(CD197+),展现出优越的抗炎性能(图5C)。同时,SCS@PGH/PET组在瘢痕相关标志物(Col 1和SMA)方面表现出持续的细胞外基质重塑,第28天显示Col 1有序排列增加,SMA阳性细胞减少(图5D)。成骨标志物OSX和增殖标志物Ki67在SCS@PGH/PET组的表达明显高于其他组(图5E)。ELISA分析显示,与PET组相比,PGH/PET和SCS@PGH/PET组显著降低了M1相关炎症因子(IL-1β、TNF-α),提高了M2相关愈合因子(IL-4、IL-10、TGF-β),其中SCS@PGH/PET组在术后早期(第2周)TGF-β水平升高,促进炎症向增殖阶段的转变(图5F-K)。综上,SCS@PGH/PET涂层通过调节炎症细胞极化及相关因子释放,显著促进肌腱-骨界面组织修复和功能恢复。
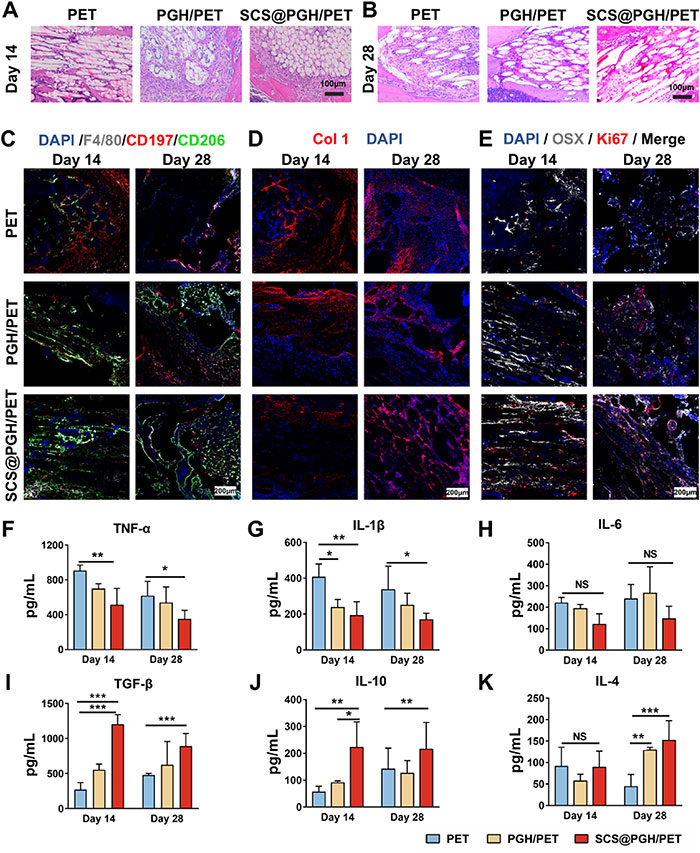
图5.体内炎症减轻,瘢痕形成受到抑制。A)术后14天、B)术后28天各组苏木精、伊红(HE)染色(P: PET;S:疤痕组织界面;黑色箭头表示新血管)。C)术后第14、28天各组界面CD197+CD206- m - φs (M1)、CD197−CD206+ m - φs (M2)、D) Col 1、E) Ki67、OSX免疫荧光染色(n = 3)。F)术后第14、28天TNF-α、G) IL-1β、H) IL-6、I) TGF-β、J) IL-10、K) IL-4水平(n = 4)
(6)抑制疤痕形成
Masson染色和偏振光显微镜显示,SCS@PGH/PET组在肌腱-骨界面形成成熟的胶原排列和类似天然骨组织的各向异性胶原蛋白层,而PET和碳纤维移植物组仅观察到少量再生骨和胶原(图6A、B)。SCS@PGH/PET组在第4周TGF-β和pSmad3表达显著降低,表明TGF-β信号激活减弱(图6C-G)。去除巨噬细胞(Mφs)后,SCS@PGH/PET组胶原蛋白(Col1)表达增加,SMA减少,同时观察到CD31+Emcn+血管显著生成(图6H-J)。结果表明,SCS@PGH/PET涂层通过调控Mφs,抑制疤痕组织形成,促进胶原重建和血管生成。
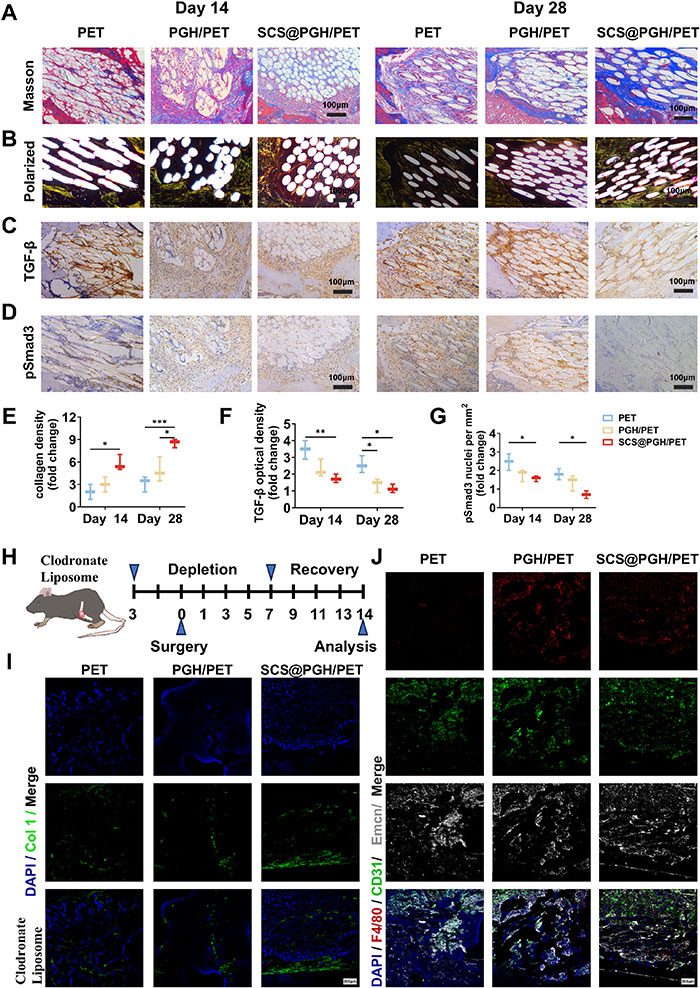
图6.巨噬细胞对体内胶原形成和瘢痕形成的影响。A)具有代表性的马森氏三色染色图像和B)前交叉韧带重建术后14天和28天的偏振光。C) TGF-β和D) pSmad3免疫组化染色。E) Collagen, F) TGF-β和G) psmad3阳性细胞核(n = 3)的定量分析。H) m - φs消耗(氯膦酸脂质体)示意图和治疗策略。I) Mφs耗损模型中Col 1恢复后的代表性荧光图像(n = 3)。J) Mφs耗损后第14天各组界面F4/80、CD31和Emcn的免疫荧光染色(n = 3)
(7)SCS@PGH/PET对小鼠ACL重建模型的治疗作用
通过高分辨率微计算机断层扫描(μCT)评估SCS@PGH/PET在ACL重建中的疗效,结果显示其胫骨和股骨隧道尺寸显著缩小,胫骨隧道中新骨形成信号明显增强(图7A、B)。定量分析表明,8周后SCS@PGH/PET组胫骨隧道直径最小(0.446±0.032 mm),骨体积分数(BV/TV)达34.0%±1.92%,为对照组的4.5倍(图7C、D)。组织学评估显示,该组种植体周围形成明显的骨隧道及整齐排列的胶原结构,显著提高骨整合水平(图7E)。拔出力测试显示,SCS@PGH/PET组拔出强度最高(约12N),为对照组的3倍(图7F)。免疫荧光分析进一步证明,8周后SCS@PGH/PET组opn阳性成骨细胞和Ki67表达显著增加,同时观察到CD31hi和Emcnhi血管结构,表明其增强骨形成和血管网络支持的能力(图7G、H)。结果表明,SCS@PGH/PET涂层通过优化种植体-骨界面的再生微环境,显著促进骨整合,加速愈合。
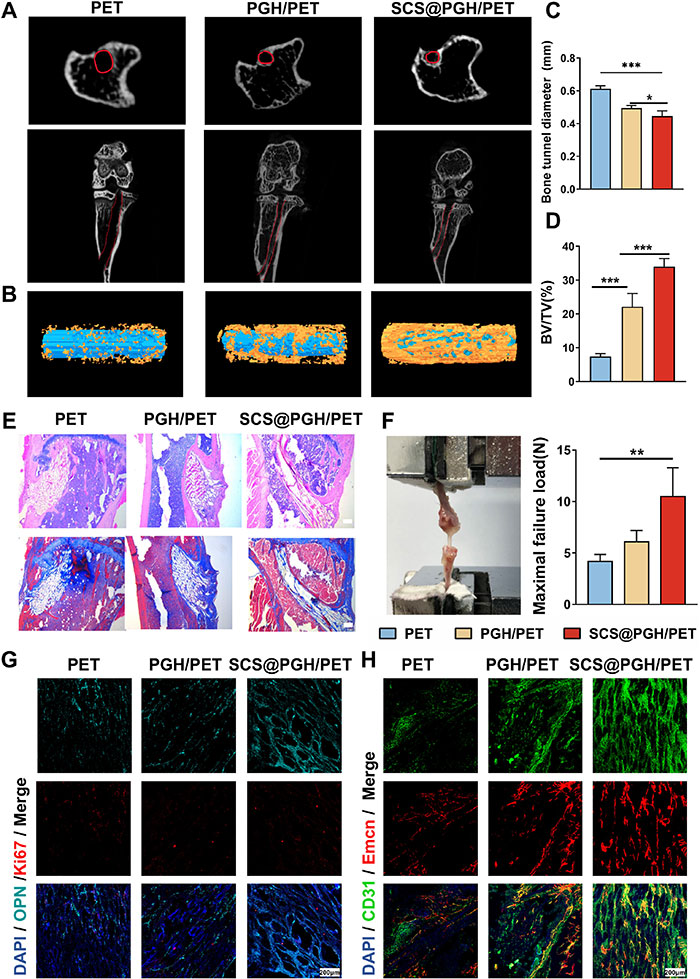
图7.观察各组小鼠前交叉韧带重建8周后的治疗效果。A)胫骨隧道中间和胫骨隧道的二维微CT切面图像。B)有代表性的三维重建显微CT图像显示缺损周围再生骨。定量分析C)各组胫骨隧道中间入口的隧道横截面直径和D) BV/TV。E) HE和Masson染色,标尺,200 μm。F)术后8周不同组生物力学试验及最终失效负荷的数码相机图像。G) OPN, Ki67,DAPI, Scale bars,200 μm染色的代表性荧光图像。H)术后8周CD31hiEmcnhi (H型)内皮细胞代表性免疫染色
研究小结:
该研究开发了一种SCS@PGH/PET水凝胶涂层来调节ACLR后的免疫微环境。这种水凝胶表现出特殊的特性,包括优化的多孔结构,用于细胞浸润,以及对细胞粘附和增殖至关重要的润滑性。经证实,结合硫酸多糖和生物活性分子对调节m - φs极化从促炎M1到再生M2状态至关重要,TGF-β等细胞因子受到调节。这种转变对于减少疤痕形成、促进愈合环境和加速血管生成至关重要。体外和体内研究均证实了水凝胶对组织修复和再生的显著影响。SCS@PGH/PET水凝胶涂层的发现为再生医学中合成韧带的设计和改进提供了坚实的科学基础。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

