
肿瘤微环境(TME)通过代谢重编程影响肿瘤的异质性、侵袭性和转移,导致乳酸增加和免疫抑制性TME的形成。为消耗乳酸,开发了乳酸氧化酶(LOx)等方法,但LOx受缺氧环境限制,氧化应激效应也可能不足以达到最佳治疗效果,因此改善肿瘤氧合至关重要。纳米酶因其类酶活性在肿瘤治疗中有潜力。将LOx与具有催化功能的纳米酶结合,有望增强乳酸催化和细胞毒性·OH的生成,提高治疗效果。光声(PA)成像可实时监测催化过程中的分子变化,为肿瘤催化治疗的临床应用提供支持。

基于上述背景,深圳大学黄鹏团队研究构建了双酶驱动的级联反应平台(ILH),由修饰透明质酸的铱金属纳米酶和乳酸氧化酶(LOx)组成。LOx通过氧化乳酸生成H₂O₂,降低乳酸水平,从而将免疫抑制性TME转化为免疫反应性,促使巨噬细胞从M2型向M1型极化。铱纳米酶具类CAT活性,分解H₂O₂生成O₂,缓解肿瘤缺氧,并通过PA成像监测氧合变化。其类POD和GSHOx活性在酸性环境中生成细胞毒性·OH并消耗GSH,削弱肿瘤抗氧化防御,激活免疫原性细胞死亡(ICD)。此外,铱纳米酶的光热性能增强级联催化效果,并赋予ILH强PA响应,实现实时监控级联治疗过程。该文章于2024年10月21日以《Dual Enzyme-Driven Cascade Reactions Modulate Immunosuppressive Tumor Microenvironment for Catalytic Therapy and Immune Activation》为题发表于《ACS Nano》(DOI:10.1021/acsnano.4c07374)。
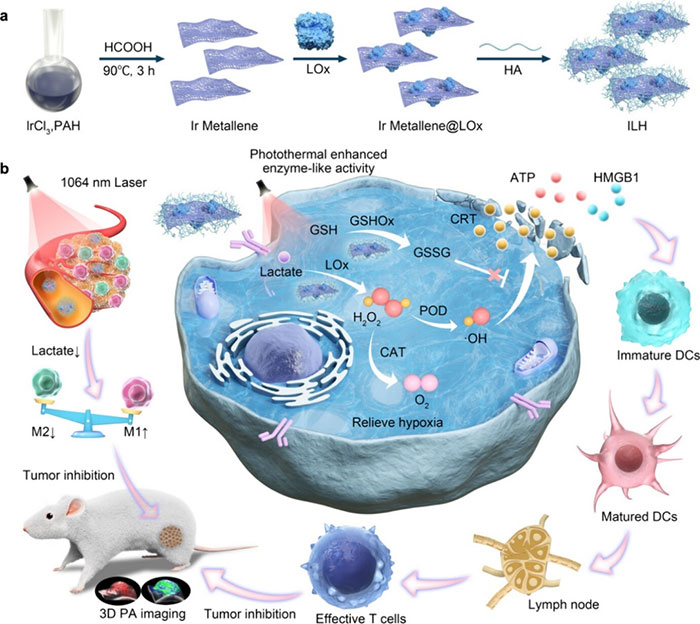
研究示意图
(1)ILH的制备与表征
通过湿化学还原法合成了聚烯丙胺功能化的铱金属纳米酶(Ir-PAH)。HAADF-STEM和TEM图像显示Ir-PAH呈层状结构,平均直径约为100 nm(图1a,b),且高倍率下可见多孔网络结构(图1c)。AC-STEM显示晶格间距为0.21 nm,对应Ir的面心立方结构(111)晶面(图1d)。AFM数据显示Ir-PAH厚度约为6.3 nm(图1e,f)。负载LOx和HA后,Ir金属纳米酶的形貌无明显变化,元素分布图显示硫元素均匀分布,表明LOx成功负载(图1g)。XPS光谱确认了Ir-PAH的形成(图1h)。DLS测得Ir-PAH水动力直径增至150.8 ± 3.7 nm,经HA修饰后约为168.3 ± 5.1 nm(图1i)。表面电位测量表明ILH的zeta电位为−27.5 ± 0.7 mV,而Ir-PAH为36.5 ± 2.6 mV,归因于HA的存在(图1j)。
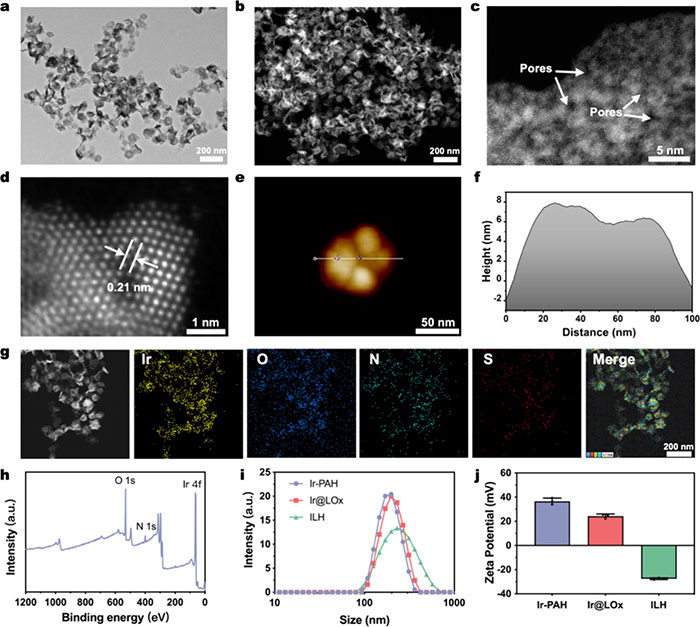
图1. (a) Ir-PAH 的 TEM 图像;(b) Ir-PAH 的 HAADF-STEM 图像;(c) Ir-PAH 的 HAADF-STEM 图像,箭头表示孔隙的存在;(d) Ir-PAH 的高分辨率 TEM 图像,显示晶格距离;(e) AFM 图像;(f) 相应的 Ir-PAH 高度剖面图;(g) ILH 的元素映射;(h) Ir-PAH 的 XPS 光谱;(i) Ir-PAH、Ir@LOx 和 ILH 的大小分布;(j) Zeta 电位
(2)ILH的光热性能与多酶活性
紫外–可见–近红外(UV–vis–NIR)光谱显示ILH在NIR-II区具有显著吸收,且吸收强度随浓度增加(图2a)。1064 nm处的消光系数为7.15 L g⁻¹ cm⁻¹。激光照射下,ILH溶液温度显著升高,随浓度增加而增强(图2b,c)。ILH展现出良好的光热稳定性,NIR-II光热转换效率为39.7%,优于许多用于NIR-II光热治疗的制剂。多次激光开/关循环后,ILH的光热特性和形貌无明显变化,表明其光热稳定性良好。Ir-PAH的GSHOx样活性通过DTNB指示剂验证,结果显示其消耗GSH并生成Ir³⁺,进一步氧化为Ir⁴⁺以消耗GSH(图2d,e)。Ir-PAH的CAT样活性评估显示H₂O₂引入导致溶解氧(DO)逐渐增加,且激光照射下DO产量提升1.42倍(图2f)。Ir-PAH对H₂O₂的转化符合米氏动力学,Km值为44.86 mM。通过基于TMB的比色法测试了Ir-PAH的POD样活性,表现出米氏动力学,Km值为24.12 mM,Vmax为0.57 μM s⁻¹(图2g,h)。激光照射下TMB氧化增加1.56倍。为评估ILH的级联催化性能,通过ESR检测生成的·OH,结果表明ILH在乳酸存在下可生成·OH,且激光照射下·OH产量增加(图2i)。在模拟体液中,TEM图像显示Ir金属纳米酶在12天内逐渐降解,产生超小Ir纳米颗粒,表明其具有良好生物降解性(图2j)。
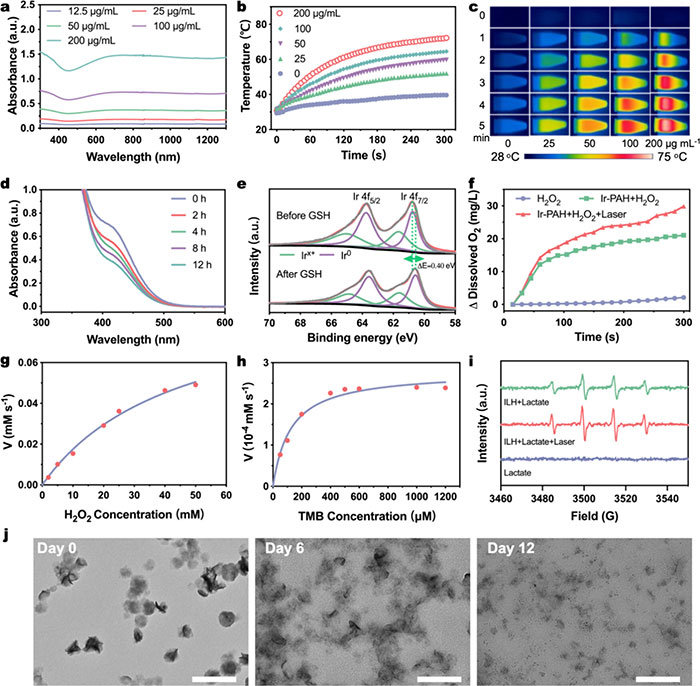
图2. (a) 不同浓度 ILH 的紫外-可见-近红外光谱;(b) 1064 nm 激光照射和不照射时不同浓度 ILH 水溶液的光热谱图;(c) 相应的热像图;(d) DTNB 与谷胱甘肽和不同浓度的 Ir-PAH 在不同时间孵育的紫外可见光谱;(e) GSH 处理前后 Ir-PAH 的 Ir 4f XPS 光谱。加入 GSH 后,Ir 4f 峰向结合能较低的方向移动,表明生成了更多的 Ir³⁺;(f) 不同组(H₂O₂、H₂O₂ + Ir-PAH 和 H₂O₂ + Ir-PAH + 激光)的产氧量。H₂O₂: 1 M, Ir-PAH: 10 μg·mL⁻¹;(g) 室温下 Ir-PAH 的 cat 样活性动力学测定;(h) 室温下 Ir-PAH pod 样活性的动力学测定;(i) 用乳酸溶液(20 mM)孵育 ILH,激光照射或不照射时的 ESR 光谱;(j) 在 37 ℃ 的 SBF 培养基(pH = 7.4)中孵育不同时间后的 ILH 的 TEM 图像
(3)ILH的靶向摄取与抗肿瘤作用
天然透明质酸(HA)因其优异的生物功能、生物相容性和生物降解性,能结合过表达CD44受体的肿瘤细胞,从而实现特异性肿瘤靶向递送。细胞毒性实验显示,Ir@HA(IH)对4T1细胞毒性较低,细胞存活率高于80%;而ILH的细胞毒性显著增加,激光照射进一步提高其毒性(图3a)。细胞迁移分析表明,ILH和激光照射可显著抑制4T1细胞迁移,ILH+激光组的迁移速率最低(图3b,c)。ILH+激光组在共聚焦激光扫描显微镜(CLSM)和流式细胞术中显示出强绿色荧光信号,表明ROS生成(图3d,e),且通过HPF检测到的·OH生成进一步验证了Ir类金属纳米酶的POD样活性(图3f)。通过比率荧光探针C11-BODIPY581/591检测脂质过氧化(LPO),ILH+激光组显示出较强的绿色荧光信号,表明ROS增强引发的LPO(图3g)。此外,ILH+激光组中更高的JC-1单体比例(60.2%)证明了线粒体损伤效应(图3h)。天然透明质酸(HA)因其优异的生物功能、生物相容性和生物降解性,能结合过表达CD44受体的肿瘤细胞,从而实现特异性肿瘤靶向递送。
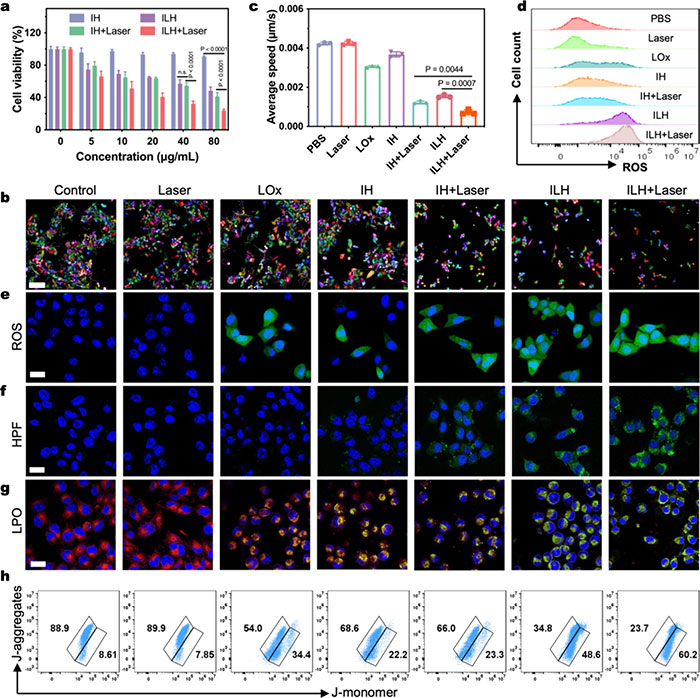
图3. (a) 在 1064 nm 激光照射(0.6 W·cm⁻², 5 min)下,不同浓度 IH 或 ILH 孵育 4T1 细胞后的相对存活率;(b) 采用高含量成像系统捕获不同处理后的 4T1 细胞显微图像,并用 Harmony 软件进行处理;(c) 4T1 细胞迁移率的定量分析。数据以均数 ± 标准差(SD)表示,n = 3;(d) 流式细胞术分析不同处理后 4T1 细胞 ROS 生成情况;(e) DCFH-DA 染色 4T1 细胞的共聚焦图像;(f) 不同处理后的 HPF 图像。标尺:20 μm;(g) 不同处理后 LPO 染色 4T1 细胞的共聚焦图像;(h) 不同处理后 j-单体和 j-聚集体的流式细胞术分析
(4)ILH对TAMs极化的体外调控
乳酸消耗诱导巨噬细胞表型转变,ILH在体外有效减少乳酸浓度,并通过共培养4T1细胞和M2型巨噬细胞,促进巨噬细胞由M2型向M1型转变(图4a, b)。流式细胞术结果显示,ILH+激光组M1型巨噬细胞比例增加(图4c),与RAW264.7细胞结果一致。IH通过催化H2O2分解为O2缓解肿瘤缺氧(图4d,h),NIR-II激光增强该过程,并降低HIF-1α水平(图4e,i)。光热增强催化疗法产生ROS,诱导免疫原性细胞死亡(ICD)。ILH+激光组显著增强CRT暴露和HMGB1释放,促进树突状细胞成熟并激活免疫反应(图4f, g, j, k)。ELISA检测结果显示ILH+激光组中HMGB1、CRT表达和ATP分泌水平显著提高,表明其引发了强烈的ICD反应。
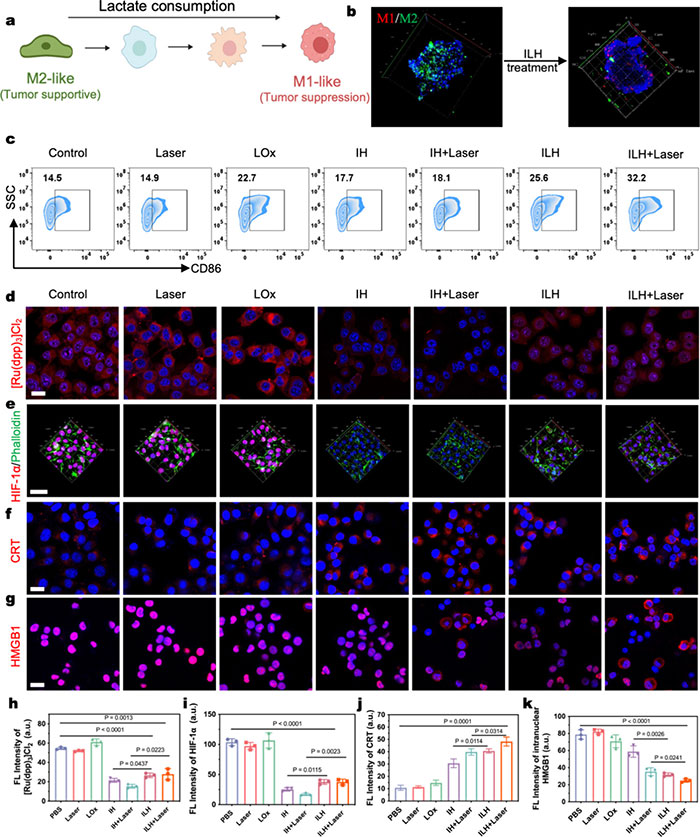
图4. (a) 乳酸诱导的 M2 型巨噬细胞复极化过程中形态学转变示意图;(b) 免疫荧光图像描绘了 ILH 处理后 MCTS 内巨噬细胞的空间排列(红色:M1 巨噬细胞,绿色:M2 巨噬细胞,蓝色:细胞核);(c) 对抗 CD86 染色的 RAW264.7 细胞进行流式细胞术分析;(d) 低氧条件下(1% O₂, 5% CO₂, 94% N₂)不同处理后 [Ru(dpp)₃]Cl₂ 染色的 4T1 细胞代表性共聚焦图像;(e) 缺氧条件下不同处理后的 4T1 细胞共聚焦图像,用 phalloidin(绿色)和抗 HIF-1α(红色)染色;(f) CRT 表达的共聚焦图像;(g) HMGB1 蛋白释放;(h) [Ru(dpp)₃]Cl₂、(i) HIF-1α、(j) CRT 和 (k) HMGB1 在不同处理(PBS、激光、LOx、IH、IH + 激光、ILH 和 ILH + 激光)后荧光信号的定量
(5)In Vivo 3D PA成像引导的级联催化过程
考虑到Ir-PAH在激光照射下的光热特性,该研究评估了IH和ILH的PA成像能力。在体外实验中,IH和ILH在NIR-II区域的PA信号强度与其浓度呈正比(图5a, b)。由于ILH与OxyHb和DeoxyHb在NIR范围的PA吸收光谱差异,可以通过检测其特征信号区分体内级联催化过程的动态分子事件。在小鼠肿瘤模型中,IH或ILH通过静脉注射后,肿瘤部位的PA信号强度在8小时后增加约2.8倍(图5c,d),显示了ILH在PA成像中的潜力。3D PA成像结合OxyHb和DeoxyHb的PA/US图像(图5e)及定量值(图5f,g)表明,PBS组的PA信号稳定,而IH组的OxyHb信号显著增强,约为初始值的3.5倍,同时DeoxyHb信号减弱,表明IH通过催化H2O2生成O2来改善肿瘤缺氧。ILH组的OxyHb信号强度约为IH组的76.3%,可能是由于LOx催化乳酸时部分O2被消耗。通过多波长PA成像实时监测肿瘤内血氧饱和度(sO2)变化,1064 nm激光照射进一步增强ILH的CAT样活性,提升sO2水平,从而缓解肿瘤微环境(TME)的缺氧状态(图5h)。
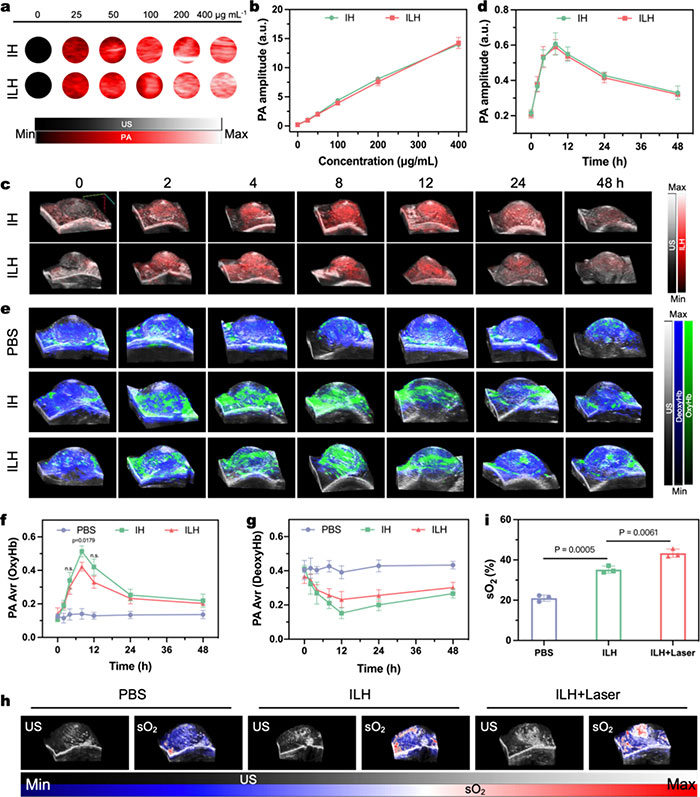
图5. (a) 970 nm 激光激活下不同浓度 IH 或 ILH 溶液的 PA 图像;(b) 相应的 PA 值;(c) 静脉注射 IH 或 ILH 后肿瘤组织随时间变化的 3D PA/US 图像;(d) 随时间变化的 PA 振幅量化;(e) 静脉注射 PBS、IH 或 ILH 后肿瘤组织中 DeoxyHb 和 OxyHb 的 3D 渲染 PA/US 图像;(f) 测定肿瘤部位的 OxyHb 水平;(g) 肿瘤部位脱氧血红蛋白定量;(h) 激光照射和静脉注射 ILH 后小鼠肿瘤组织中 sO₂ 水平的 3D PA/US 图像;(i) 肿瘤组织中 sO₂ 值的定量测定
(6)In Vivo生物安全评估、级联催化治疗与免疫激活
基于ILH的体外治疗效果,该研究进一步考察了其体内抗肿瘤效果。在4T1肿瘤模型中,借助体内PA成像,IH和ILH注射8小时后对肿瘤组织进行NIR-II激光照射。在1064 nm激光下,ILH处理的肿瘤温度升高至47.3 °C(图6a,b)。4T1肿瘤模型被分为PBS、激光、LOx、IH、IH+激光、ILH和ILH+激光7组。结果显示,ILH+激光组的肿瘤生长抑制率(TGI)达90.1%,表现出显著的抗肿瘤效果(图6c,d),且治疗期间体重无显著变化(图6e),证明治疗的安全性。H&E和Ki-67染色表明,ILH+激光组有显著的组织损伤和细胞增殖抑制,TUNEL染色结果显示该组凋亡信号最强(图6g,h)。此外,肺部H&E染色显示,ILH+激光组肺转移灶减少92.1%,表明其强大的抗转移效果(图6i,j)。这些结果表明,光热增强的催化治疗具有诱导癌细胞凋亡和激活免疫系统的潜力,有助于阻止肿瘤转移。
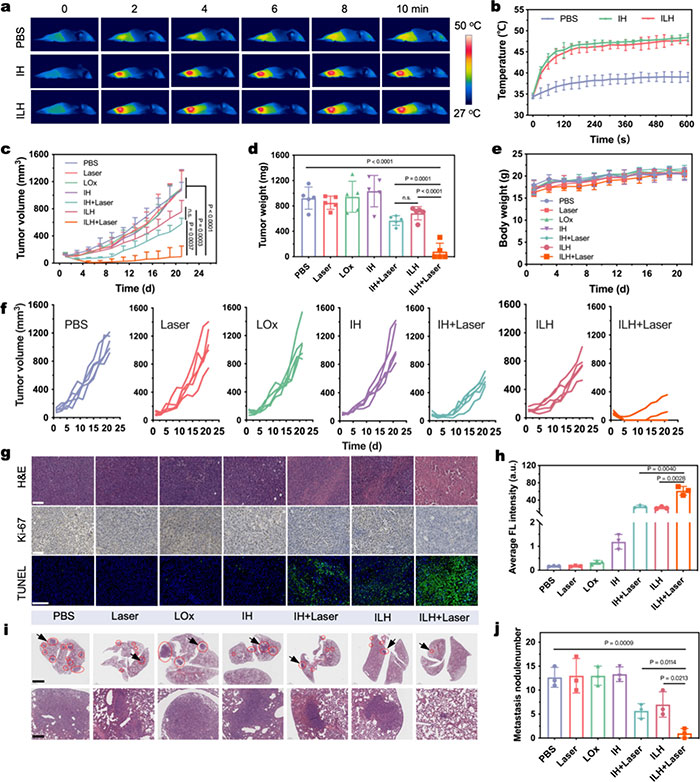
图6. (a) 不同处理下肿瘤部位的光热成像图像;(b) 相应的温度变化。激光参数:1064 nm,0.6 W·cm⁻²,10 min;(c) 指定治疗后的肿瘤生长曲线;(d) 肿瘤平均重量;(e) 小鼠体重;(f) 指示治疗后小鼠肿瘤生长曲线;(g) 指示治疗后肿瘤切片的 H&E、Ki-67 和 TUNEL 染色图像;(h) 指定治疗后肿瘤组织 TUNEL 染色图像阳性率定量;(i) 代表性肺组织的 H&E 染色图像。比例尺:2 mm。如箭头所示的放大图像;(j) 各实验组肺转移结节
(7)免疫抑制TME调控与免疫激活
该研究探索了ILH在抗肿瘤和抗转移应用中的体内免疫调节机制。4T1肿瘤模型及相关干预措施的具体方法如图7a所示。实验证明,实体肿瘤中的缺氧和乳酸积累会引起巨噬细胞大量浸润,但这种浸润往往削弱巨噬细胞功能,从而促进肿瘤发生和转移。通过肿瘤切片的HIF-1α免疫荧光染色分析(图7b,c),研究发现ILH显著缓解了肿瘤缺氧状态,下调HIF-1α表达,并提高了M1型肿瘤相关巨噬细胞(TAMs)的比例。ILH通过氧气生成和乳酸消耗协同作用,有效调控了免疫抑制TME。
进一步的流式细胞术分析表明,与对照组相比,ILH处理后M1/M2比值提高了约5.6倍(图7d,g)。催化治疗产生的ROS诱导肿瘤细胞损伤,释放的肿瘤相关抗原(TAAs)被转移至淋巴结,由树突状细胞(DCs)呈递至T细胞,激发适应性免疫反应。DCs成熟度的分析显示,ILH+激光组中成熟DC比例较PBS组高出2.5倍(图7e,h)。此外,CD8+ T细胞在肿瘤监控中具有关键作用,而CD4+ T细胞则主要调控并协调其他免疫细胞,因此测定了治疗后肿瘤组织中的CD4+和CD8+ T细胞比例(图7f–j)。ILH和ILH+激光组均表现出显著的T细胞浸润,ILH+激光组中CD3+CD8+ T细胞比例较PBS组增加4.2倍。最后,ELISA分析显示,ILH+激光组小鼠血清中IFN-γ、IL-6和TNF-α水平分别提高了1.9倍、2.2倍和2.0倍(图S26),表明ILH有效激活了抗肿瘤免疫反应。
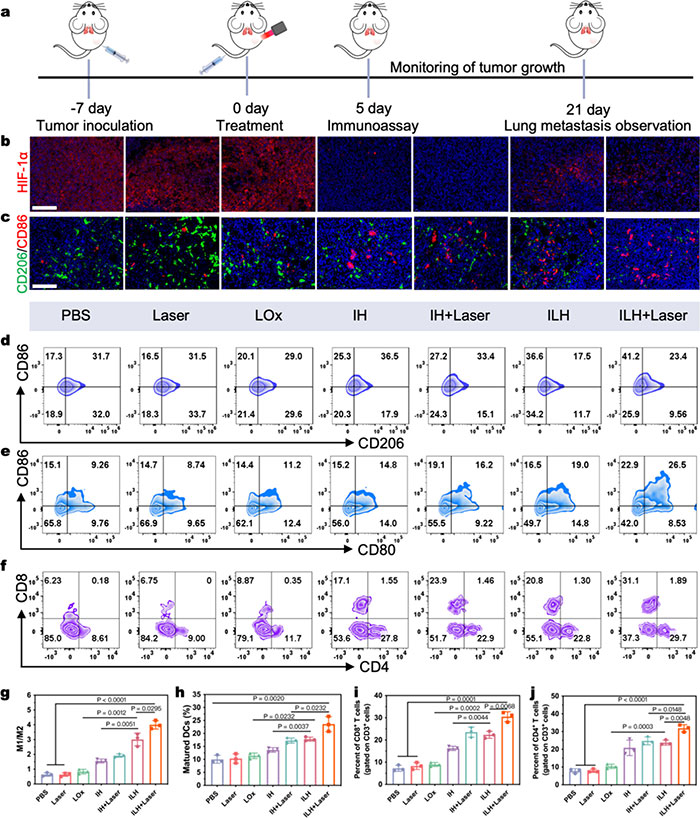
图7. (a) 小鼠处理过程示意图;(b) 不同处理后肿瘤组织 HIF-1α 表达的组织学染色图;(c) 肿瘤组织内巨噬细胞免疫荧光染色。蓝色、绿色和红色荧光分别表示细胞核、CD206 和 CD86;(d) 第 5 天不同处理后浸润肿瘤的 M2 和 M1 巨噬细胞的代表性流式细胞术分析;(e) 不同处理后第 5 天成熟 DC 的代表性流式细胞术分析;(f) 以 CD3+ 细胞为门控,第 5 天不同治疗后肿瘤中 CD8+ 和 CD4+ T 细胞的代表性流式细胞术分析;(g) 不同处理后巨噬细胞 M1/M2 比值;(h) 淋巴结成熟树突状细胞定量分析;(i) CD8+ T 细胞和 (j) CD4+ T 细胞在肿瘤中的定量百分比
研究小结:
综上所述,该研究开发了一种双酶驱动的级联反应平台(ILH),具备免疫抑制TME调控能力,用于PA成像引导的催化治疗。肿瘤内氧气生成与乳酸消耗的协同作用有效改善了免疫抑制TME,促使TAMs从M2型向M1型极化,从而激活抗肿瘤免疫。ILH显著缓解了肿瘤缺氧,并催化产生了大量氧化应激,最终诱导了ICD并激活抗肿瘤免疫。该方法在4T1异种移植模型中实现了90.1%的肿瘤抑制率(TGI)和92.1%的肺转移结节减少。含有Ir金属纳米酶的引入进一步增强了级联催化效率并实现了PA成像。通过3D多光谱PA成像监测内源分子信号的变化,实现了级联催化治疗过程的实时体内监控。该研究展示了一种用于分子影像导航、肿瘤催化治疗和免疫激活的纳米平台。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

