
全球有超过2亿人受到骨质疏松症的影响,这是一种全身性骨代谢障碍,表现为骨量减少、骨微结构改变以及骨折风险增加。在骨质疏松患者中,由于创伤、肿瘤切除手术或感染,骨结构的完整性容易受到破坏,导致骨缺损。尽管自体骨移植在临床上仍是骨缺损修复的金标准,但该方法存在供体部位并发症及资源有限等问题。因此,探索替代性骨组织再生策略显得尤为重要。骨组织修复依赖于健康的血管条件和新生血管的形成,尤其是骨骼系统中的一种特殊血管——H型血管,它在成骨细胞分化和血管生成与成骨作用的耦合中起重要作用。然而,骨质疏松症会导致H型内皮细胞数量减少,影响骨修复过程。氮氧化物(NO)作为内源性气体信号分子,已被证实能够通过调节血管干/祖细胞,促进成骨过程。然而,由于NO靶向性不足,限制了其在骨修复中的应用。

针对上述问题,第四军医大学(空军军医大学)唐都医院郭征主任、钱济先主任、高全有主任、周程沛团队设计了一种仿生纳米材料,通过中孔硅纳米粒子(MSNs)负载S-硝基谷胱甘肽(GSNO)以提供NO,并通过包裹BMSCs和人血管内皮细胞膜(HUVECs)来实现靶向递送。此外,本研究对海藻酸钠(SA)水凝胶进行了共价修饰,以增强其细胞/基质相互作用,改善细胞黏附性能。通过引入短肽序列SKPPGTSS,水凝胶平台可促进BMSCs的归巢,从而为骨缺损的修复提供基础。同时,通过调节SA水凝胶的硬度以优化BMSCs的旁分泌功能,以期增强其在骨缺损修复中的免疫调节作用。该团队开发了一种兼具成骨和成血管耦合功能以及免疫调节特性的仿生纳米材料,为骨质疏松骨修复提供了一种新型策略。该研究于2024年11月1日以《Stem cell–homing biomimetic hydrogel promotes the repair of osteoporotic bone defects through osteogenic and angiogenic coupling》为题发表于《Science Advances》上(DOI: 10.1126/sciadv.adq6700)。
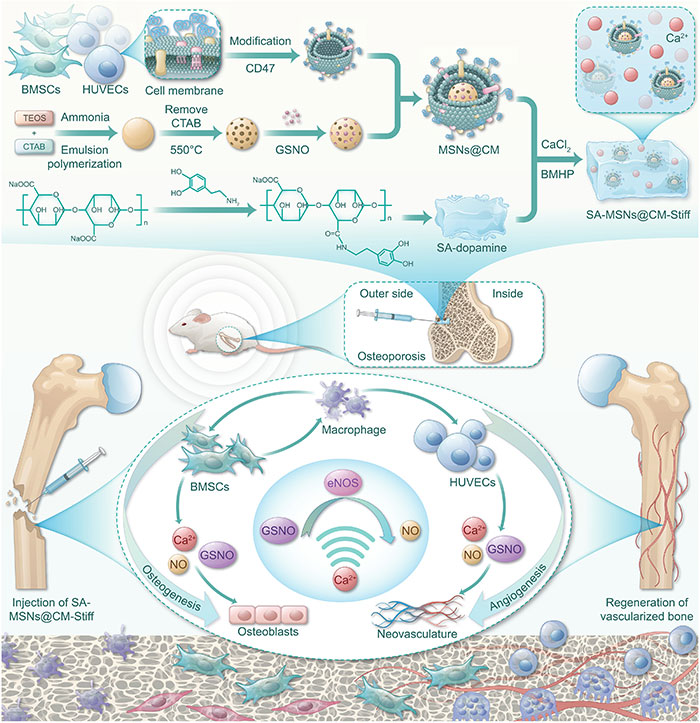
图1 用于骨质疏松性骨缺损的SA-MSNs@CM-Stiff示意图
(1)骨质疏松大鼠的 BMSC 表现出与衰老相关的特性
为深入了解BMSCs的特性,该研究调查了其衰老、干性及成骨潜力。通过micro-CT分析发现,卵巢切除的中年大鼠中,骨小梁的体积、厚度和数量显著减少(图2A)。苏木精-伊红染色(H&E)和Masson染色进一步显示卵巢切除的大鼠表现出明显的骨质疏松特征(图2B和图2C)。如图2D所示,BMSCs对间充质干细胞表面标记物CD44、CD29、CD73和CD90的表达呈阳性,而CD34和CD45的表达水平则几乎可以忽略不计(图2D)。从年轻、中年和卵巢切除的中年大鼠股骨中分离出的BMSCs通过三向分化验证了其表型。骨质疏松大鼠的成骨和成软骨能力显著降低,而成脂能力显著增加(图2E)。骨质疏松大鼠的BMSCs表现出更多SA-β-半乳糖苷酶阳性细胞,较年轻和中年大鼠明显增多(图2F)。在干性方面,骨质疏松组的BMSCs中Nanog、Sox2和Oct4的表达水平与年轻和中年组相比显著降低(图2G)。进一步检测了衰老相关因子,如P53、P21和P16,结果显示骨质疏松大鼠BMSCs中这些衰老相关因子显著升高(图2H)。此外,衰老的特征还包括持续的DNA损伤反应,可通过检测γ-H2AX焦点来识别。结果显示骨质疏松组中γ-H2AX阳性焦点增多(图2I)。成骨潜力方面,骨质疏松组BMSCs的成骨标志蛋白Runx2和OPN的表达较年轻和中年组显著降低(图2J到图2L)。碱性磷酸酶(ALP)染色显示,骨质疏松组的染色较年轻和中年组浅(图2M),并且骨质疏松组的钙结节也较小(图2N)。
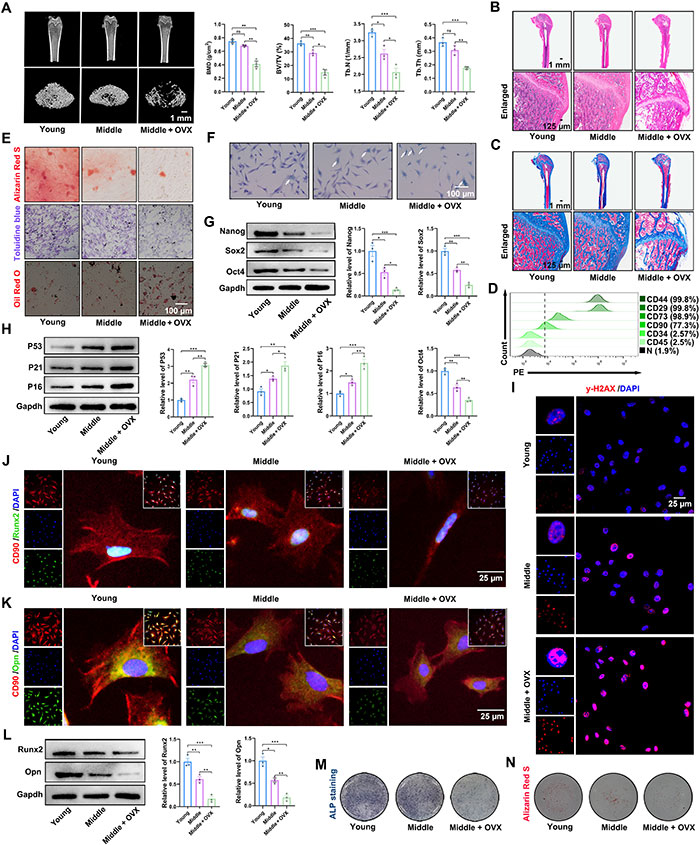
图2. 来自骨质疏松大鼠的BMSCs表现出与衰老相关的特性。(A) 微CT扫描和3D重建结果(比例尺,1 mm);骨密度、体积及其他参数的定量分析。BV/TV,骨组织体积/总组织体积;Tb.Th,小梁厚度;Tb.N,小梁数量。(B) 不同组别的H&E染色图像(比例尺,1 mm和125 μm)。(C) 不同组别的Masson染色图像(比例尺,1 mm和125 μm)。(D) 流式细胞术显示来自骨质疏松大鼠的BMSCs阳性标记为CD44(99.8%)、CD29(99.8%)、CD73(98.9%)和CD90(77.3%),而CD34(2.57%)和CD45(2.5%)为阴性。(E) Alizarin Red S、甲苯胺蓝和Oil Red O染色分别用于检测成骨、软骨和脂肪分化(比例尺,100 μm)。(F) SA-β-半乳糖苷酶染色检测衰老细胞(比例尺,100 μm)。(G) 不同组别BMSCs中Nanog、Sox2和Oct4蛋白表达的Western blot分析。(H) 不同组别BMSCs中P53、P21和P16蛋白表达的Western blot分析。(I) 不同组别BMSCs中γ-H2AX焦点形成的代表性免疫荧光染色(比例尺,25 μm)。DAPI,4′,6-二脒基-2-苯基吲哚。(J) 不同组别BMSCs中CD90和Runx2的代表性免疫荧光染色(比例尺,25 μm)。(K) 不同组别BMSCs中CD90和Opn的代表性免疫荧光染色(比例尺,25 μm)。(L) 不同组别BMSCs中Runx2和Opn蛋白表达的Western blot分析。(M) 不同组别BMSCs的ALP染色。(N) 不同组别BMSCs的Alizarin Red S染色。每组n=3。误差条表示均值±SEM;ns,无显著性;*P < 0.05,**P < 0.01,***P < 0.001
(2)合成 MSN、MSNs@CM、SA、SA-MSNs@CM 和 SA-MSNs@CM-Stiff 的特性
为改善骨质疏松性骨缺损的修复,该研究设计了一种具备干细胞归巢效果的仿生水凝胶。MSNs的制备包括四个步骤:合成MSNs、将GSNO吸附到中孔、提取细胞膜(CM),并将CM包裹在MSNs表面,得到MSNs@CM(图1)。透射电子显微镜(TEM)显示MSNs尺寸为197.6 nm,而MSNs@CM增至229.8 nm(图3A和3B)。MSNs的zeta电位为-27.2 mV,而MSNs@CM为-25.85 mV(图3C)。为延长GSNO的滞留时间,基于SA水凝胶设计了递送系统,并通过多巴胺修饰提升细胞粘附能力(图1和图3D)。1/50比例的多巴胺结合显著增强细胞粘附(图3E和3F),X射线光电子能谱(XPS)验证了多巴胺接枝(图3G)。通过调节二价阳离子的浓度制备不同力学性能的水凝胶,50 mM Ca2+组的弹性模量最高,为25.56 ± 1.41 kPa(图3H和3I)。扫描电子显微镜观察表明,不同组内部结构无显著差异(图3J),孔径也无明显不同(图3K)。SA-MSNs@CM-Stiff水凝胶在弯曲和拉伸时展现出柔软性与柔韧性(图3L),并可制备成多种形状,适用于个性化骨缺损治疗(图3M)。
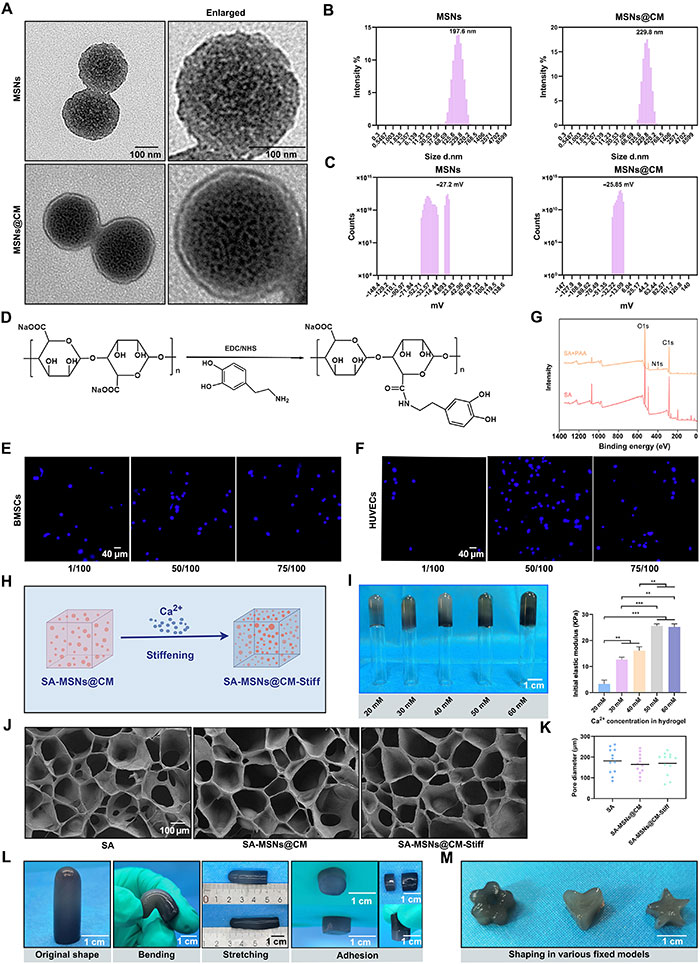
图3. 合成的MSNs、SA、SA-MSNs@CM和SA-MSNs@CM-Stiff的特性。(A) MSNs和MSNs@CM的TEM图像(比例尺,100 nm)。(B) MSNs和MSNs@CM的粒径分布。(C) MSNs和MSNs@CM的Zeta电位分布。(D) SA中多巴胺接枝的示意图。(E) BMSCs在水凝胶表面的细胞核分布(比例尺,40 μm)。(F) HUVECs在水凝胶表面的细胞核分布(比例尺,40 μm)。(G) SA和多巴胺-SA的XPS测量光谱。(H) 通过改变Ca2+摩尔浓度调节水凝胶硬度的示意图。(I) 不同Ca2+摩尔浓度组水凝胶的图像及初始弹性模量(比例尺,1 cm)。(J) 不同SA水凝胶的扫描电子显微镜图像(比例尺,100 μm)。(K) 扫描电子显微镜图像中的孔径。(L) SA-MSNs@CM-Stiff在弯曲和拉伸等不同外部机械力下的图像(比例尺,1 cm)。(M) 使用SA-MSNs@CM-Stiff制备的形状图像(比例尺,1 cm)。每组n=3。误差条表示均值±SEM;*P < 0.05,**P < 0.01,***P < 0.001
(3)SA-MSNs@CM-Stiff 通过体外激活 NO/cGMP 通路促进成骨
将BMSCs与不同水凝胶组间接共培养以评估生物相容性和成骨效果。结果显示,SA-MSNs@CM和SA-MSNs@CM-Stiff组中细胞铺展更好(图4A),Calcein-AM/PI染色证实各水凝胶组具有良好的生物相容性(图4B)。进一步检测GSNO和Ca2+的持续供给是否可协同促进NO生成及下游信号传导。7天共培养后,SA-MSNs@CM和SA-MSNs@CM-Stiff组中的P-eNOS显著增加(图4C),NO水平也显著提高(图4D)。此外,cGMP、sGC和PKG等下游信号分子在SA-MSNs@CM和SA-MSNs@CM-Stiff组中显著增加(图4E和4F)。在成骨方面,Western blot分析显示SA-MSNs@CM和SA-MSNs@CM-Stiff组中Runx2和Opn显著上调(图4G),免疫荧光实验结果一致(图4H和4I)。ALP染色表明SA-MSNs@CM和SA-MSNs@CM-Stiff组的染色较SA和对照组更深(图4J),且观察到更大的钙结节(图4K)。这些结果表明,SA-MSNs@CM和SA-MSNs@CM-Stiff能够激活NO/cGMP通路,促进BMSCs的成骨作用(图4L)。
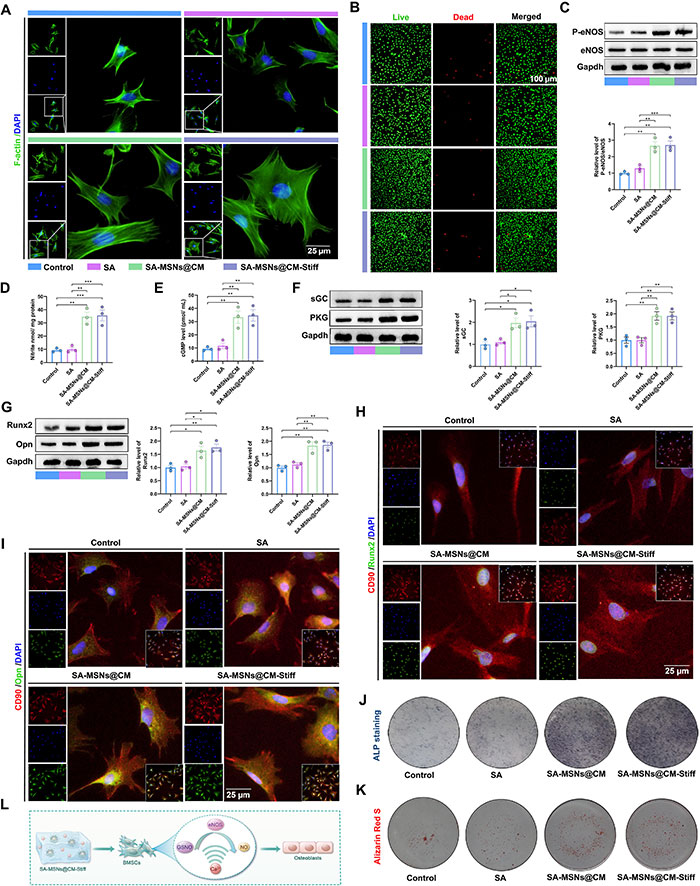
图4. SA-MSNs@CM-Stiff通过激活NO/cGMP通路在体外促进成骨。(A) 用水凝胶培养7天的BMSCs中F-actin的免疫荧光染色(比例尺,25 μm)。(B) 用水凝胶培养3天的BMSCs的活/死细胞检测(比例尺,100 μm)。活细胞呈绿色,死细胞呈红色。(C) 用水凝胶培养7天的BMSCs中P-eNOS和eNOS水平的Western blot分析。(D) 用水凝胶培养7天的BMSCs中通过亚硝酸盐水平表示的NO生成。(E) 用水凝胶培养7天的BMSCs中cGMP的表达。(F) 用水凝胶培养7天的BMSCs中sGC和PKG水平的Western blot分析。(G) 用水凝胶培养7天的BMSCs中Runx2和Opn水平的Western blot分析。(H) 用水凝胶培养7天的BMSCs中CD90和Runx2的代表性免疫荧光染色(比例尺,25 μm)。(I) 用水凝胶培养7天的BMSCs中CD90和Opn的代表性免疫荧光染色(比例尺,25 μm)。(J) 用水凝胶培养7天的BMSCs的ALP染色。(K) 用水凝胶培养7天的BMSCs的Alizarin Red S染色。(L) SA-MSNs@CM-Stiff激活NO/cGMP通路以促进BMSC成骨的示意图。每组n=3。误差条表示均值±SEM;*P < 0.05,**P < 0.01,***P < 0.001
(4)SA-MSNs@CM-Stiff 通过体外激活 NO/cGMP 通路促进迁移和血管生成
将HUVECs与不同水凝胶组间接共培养以评估生物相容性、迁移和血管生成能力。结果显示,SA-MSNs@CM和SA-MSNs@CM-Stiff组中细胞铺展更好(图5A),Calcein-AM/PI染色显示各水凝胶组具有良好的生物相容性(图5B)。进一步检测GSNO和Ca2+的持续供给是否可协同促进HUVECs中的NO生成及下游信号传导。共培养3天后,SA-MSNs@CM和SA-MSNs@CM-Stiff组中的P-eNOS显著增加(图5C),NO水平也显著提高(图5D)。此外,cGMP、sGC和PKG等下游信号分子在SA-MSNs@CM和SA-MSNs@CM-Stiff组中显著增加(图5E和5F)。在迁移实验中,SA-MSNs@CM和SA-MSNs@CM-Stiff组中穿过Transwell小室的细胞数量显著增加(图5G),24小时后,HUVECs在这两个组中通过迁移展现出显著的愈合效果(图5H)。最后,评估了不同水凝胶对血管生成的影响。Western blot分析显示,SA-MSNs@CM和SA-MSNs@CM-Stiff组中CD31和Emcn显著上调(图5I),免疫荧光实验结果一致(图5J)。在管腔形成实验中,6小时后在SA-MSNs@CM和SA-MSNs@CM-Stiff组中观察到管状结构(图5K)。鸡胚尿囊膜(CAM)实验结果显示,SA-MSNs@CM和SA-MSNs@CM-Stiff组形成了更多血管(图5L)。这些结果表明,SA-MSNs@CM和SA-MSNs@CM-Stiff促进了HUVECs的迁移和血管生成(图5M)。
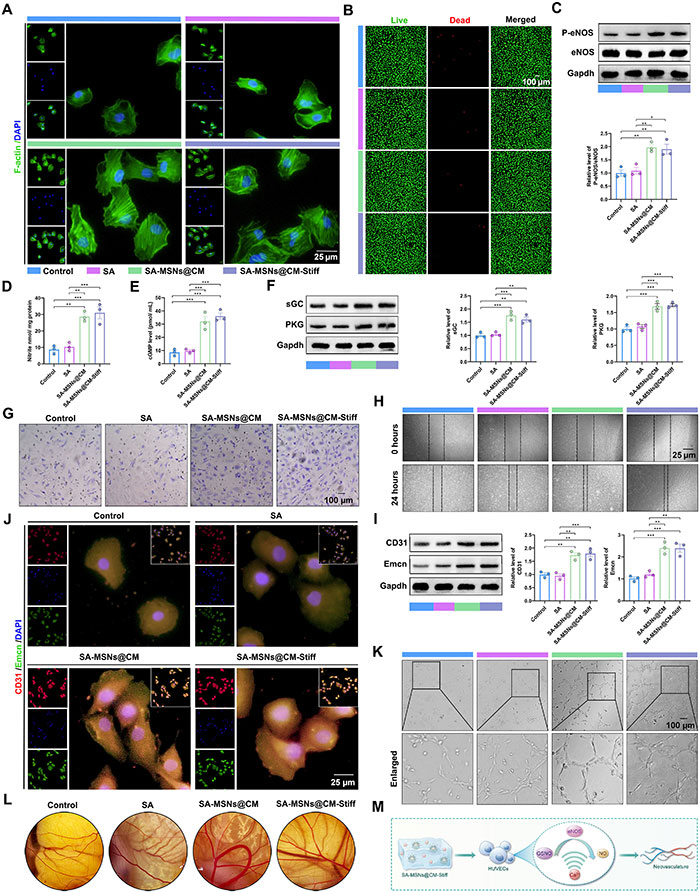
图5. SA-MSNs@CM-Stiff 体外通过激活 NO/cGMP 通路促进迁移和血管生成。(A) 与水凝胶一起培养 3 天的 HUVEC 中的 F-actin 免疫荧光染色(比例尺,25 μm)。(B) 与水凝胶一起培养 3 天的 HUVEC 的活/死测定(比例尺,100 μm)。活细胞呈绿色,死细胞呈红色。(C) 与水凝胶一起培养 3 天的 HUVEC 中的 P-eNOS 和 eNOS 水平的蛋白质印迹分析。(D) 与水凝胶一起培养 3 天的 HUVEC 中的 NO 生成,以亚硝酸盐水平表示。(E) 与水凝胶一起培养 3 天的 HUVEC 中的 cGMP 表达。(F) 与水凝胶一起培养 3 天的 HUVEC 中的 sGC 和 PKG 水平的蛋白质印迹分析。 (G)采用Transwell实验评估水凝胶对HUVEC迁移能力的影响。(H)采用划痕实验评估水凝胶对HUVEC迁移能力的影响。(I)采用Western印迹分析水凝胶培养3天的HUVECs中CD31和Emcn的水平。(J)采用水凝胶培养3天的HUVECs中CD31和Emcn的代表性免疫荧光染色(比例尺,25μm)。(K)采用小管形成实验评估水凝胶对HUVEC血管生成的影响(比例尺,100μm)。(L)采用Chick CAM实验评估水凝胶对血管生成的影响。(M)SA-MSNs@CM-Stiff激活NO/cGMP通路促进HUVECs血管生成示意图。每组n=3。误差线表示平均值±SEM; *P < 0.05,**P < 0.01,且***P < 0.001
(5)SA-MSNs@CM-Stiff 促进 BMSCs 在 3D 条件下的迁移和旁分泌功能
为更好地模拟体内环境,BMSCs在3D条件下培养。Calcein-AM/PI染色显示所有组BMSCs的存活率较高(图6A)。在Transwell小室实验中,SA-MSNs@CM-Stiff组通过小室的细胞数量显著增加(图6B)。鬼笔环肽染色细胞骨架显示水凝胶影响了细胞的延展状态,但在不同基质硬度组之间,细胞形态无明显差异(图6C)。为验证不同水凝胶对BMSCs旁分泌因子表达的影响,结果显示SA-MSNs@CM-Stiff组中的人类生长因子(HGF)、前列腺素E2(PEG2)、基质细胞衍生因子1(SDF-1)和血管内皮生长因子A(VEGF-A)水平显著高于其他组(图6D)。综上所述,SA-MSNs@CM-Stiff促进了BMSCs的旁分泌效应(图6E)。
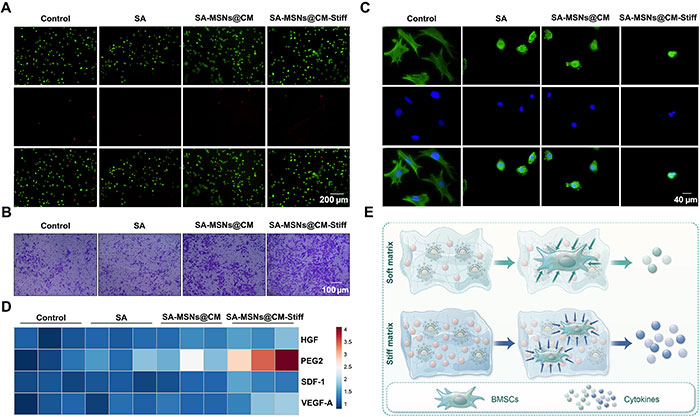
图6. SA-MSNs@CM-Stiff在3D条件下促进BMSCs的迁移和旁分泌功能。(A) 在3D条件下用水凝胶培养3天的BMSCs的活/死细胞检测(比例尺,200 μm)。活细胞呈绿色,死细胞呈红色。(B) Transwell实验用于评估水凝胶对在3D条件下培养3天的BMSCs迁移能力的影响(比例尺,100 μm)。(C) 在3D条件下用水凝胶培养3天的BMSCs中F-actin的免疫荧光染色(比例尺,40 μm)。(D) 在3D条件下用水凝胶培养3天的BMSCs中HGF、PEG2、SDF-1和VEGF-A的表达。(E) SA-MSNs@CM-Stiff在3D条件下促进BMSCs迁移和旁分泌功能的示意图。每组n=3。误差条表示均值±SEM;*P < 0.05,**P < 0.01,***P < 0.001
(6)SA-MSNs@CM-Stiff 通过促进 BMSCs 在 3D 条件下旁分泌来调节巨噬细胞极化
为了探究BMSCs的旁分泌效应对巨噬细胞极化的影响,进行了以下实验。使用BMSCs的条件培养基处理不同组的巨噬细胞,以评估其对巨噬细胞极化的影响(图7A)。流式细胞术分析显示,SA-MSNs@CM-Stiff组中CD86+巨噬细胞显著减少(图7B),而CD206+巨噬细胞的比例显著增加(图7C)。Western blot结果与流式细胞术一致,SA-MSNs@CM-Stiff组中CD86表达明显降低,而CD206表达显著增加(图7D和图7E)。此外,极化的巨噬细胞显著上调了血管生成因子VEGF-A和成骨相关分子骨形成蛋白-2(BMP-2)的分泌(图7G)。这些结果表明,BMSCs的旁分泌效应可能在调节巨噬细胞极化中发挥作用。
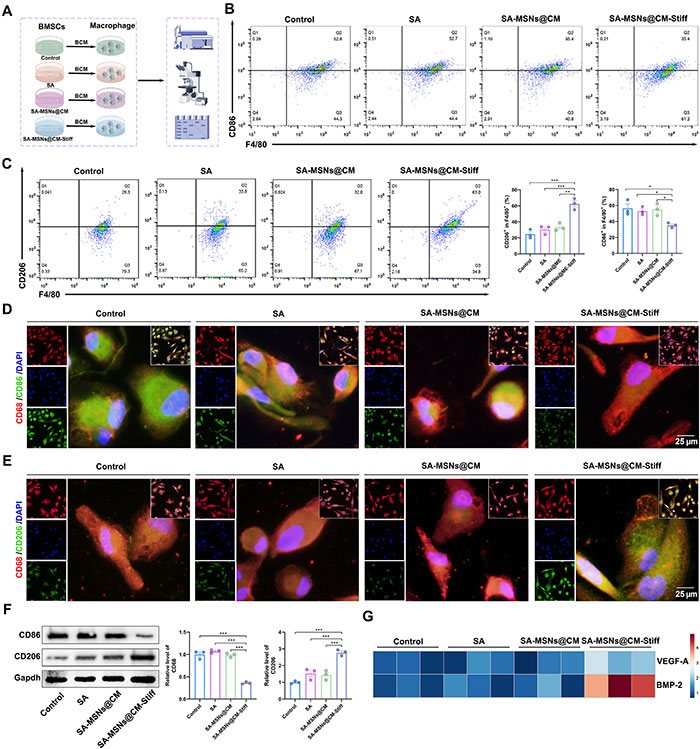
图7. SA-MSNs@CM-Stiff通过在3D条件下促进BMSCs旁分泌调节巨噬细胞极化。(A) 体外实验流程,用于检测由BMSCs旁分泌调节的巨噬细胞极化(由Figdraw绘制)。BMSCs与水凝胶共同培养3天。去除上清液后,细胞在Dulbecco改良Eagle培养基(DMEM)/F12中培养3天,收集上清液作为THP-1条件培养基使用2天。BCM,BMSCs条件培养基。(B) 流式细胞术分析M1型巨噬细胞(F4/80/CD86+)的表达水平。(C) 流式细胞术分析M2型巨噬细胞(F4/80/CD206+)的表达水平。(D) THP-1细胞中CD68和CD86的代表性免疫荧光染色(比例尺,25 μm)。(E) THP-1细胞中CD68和CD206的代表性免疫荧光染色(比例尺,25 μm)。(F) 巨噬细胞中CD86和CD206水平的Western blot分析。(G) 巨噬细胞中VEGF-A和BMP-2的表达。每组n=3。误差条表示均值±SEM;*P < 0.05,**P < 0.01,***P < 0.001
(7)SA-MSNs@CM-Stiff 诱导 BMSCs 募集并促进体内骨整合
由于骨质疏松患者的局部微环境复杂,成骨细胞介导的骨生成显著低于破骨细胞介导的骨吸收,导致骨折愈合速度较慢。虽然SA-MSNs@CM-Stiff在体外可促进成骨,但其在体内的潜在效果尚不明确。为此,采用骨质疏松大鼠骨缺损模型评估各水凝胶在促进骨重建方面的能力(图8A)。尽管所有组别的大鼠均出现新骨生成,但在注射SA-MSNs@CM-Stiff组中最为显著(图8B和图8D)。经过8周治疗,SA-MSNs@CM-Stiff组的骨矿密度增加了1.78倍,骨组织体积/总组织体积增加了2.54倍(图8C)。此外,SA-MSNs@CM-Stiff组的骨小梁厚度和数量显著增加(图8C)。H&E和Masson染色也进一步证实了SA-MSNs@CM-Stiff优越的促骨能力(图8E和图8F)。为进一步研究水凝胶在成骨-血管生成耦合中的作用,使用免疫荧光染色进行分析。结果显示,SA-MSNs@CM-Stiff组中高度阳性的CD31和Emcn细胞数量显著多于其他组(图8G)。骨内血管具有功能特化,H型血管的内皮细胞高表达CD31和Emcn,通过作用于BMSCs实现血管生成和成骨的耦合。此外,对Runx2和Opn与细胞标志物(CD90)的双重免疫染色表明,SA-MSNs@CM-Stiff组BMSCs中Runx2和Opn表达显著增加(图8H和图8I)。以上结果证实,SA-MSNs@CM-Stiff通过促进成骨和血管生成耦合,有助于骨质疏松性骨缺损的愈合。
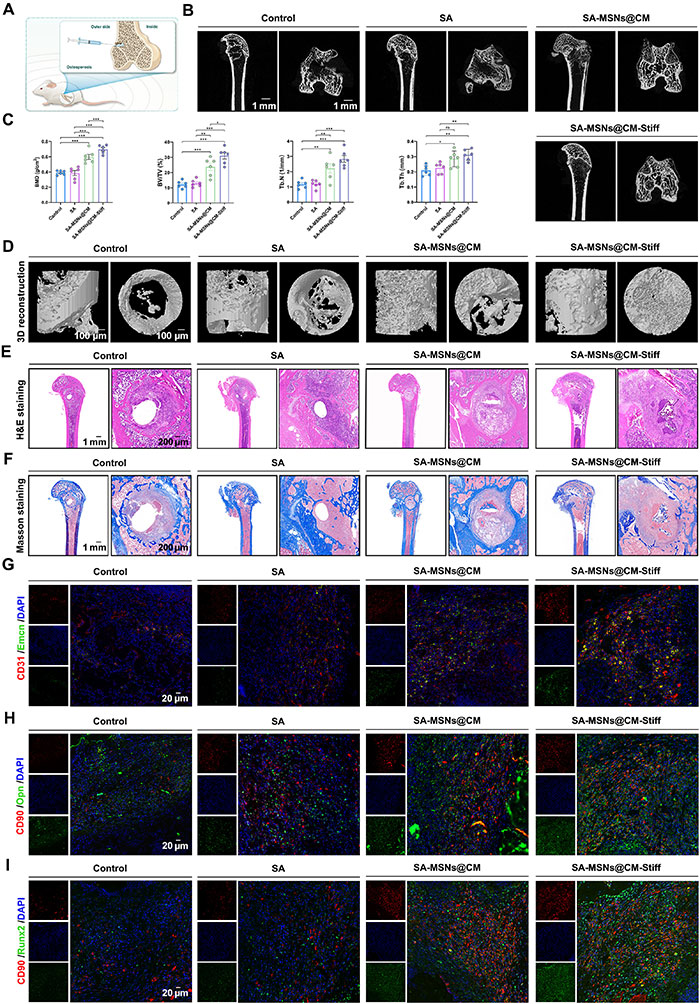
图8. SA-MSNs@CM-Stiff在体内诱导BMSCs募集并促进骨整合。(A) 水凝胶植入的示意图。(B) 具有骨质疏松性骨缺损的大鼠远端股骨在8周时的典型微CT图像。(C) 骨密度、体积及其他参数的定量分析。BMD,骨矿物质密度。(D) 3D重建结果。(E) 不同组别的H&E染色图像(比例尺,1 mm和200 μm)。(F) 不同组别的Masson染色图像(比例尺,1 mm和200 μm)。(G) 水凝胶植入8周后骨质疏松大鼠股骨髁中CD31和Emcn的代表性免疫荧光染色(比例尺,20 μm)。(H) 水凝胶植入8周后骨质疏松大鼠股骨髁中CD90和Opn的代表性免疫荧光染色(比例尺,20 μm)。(I) 水凝胶植入8周后骨质疏松大鼠股骨髁中CD90和Runx2的代表性免疫荧光染色(比例尺,20 μm)。每组n=6。误差条表示均值±SEM;*P < 0.05,**P < 0.01,***P < 0.001
研究小结:
该研究设计的仿生纳米粒子可通过GSNO供给NO,并使用海藻酸钠(SA)释放Ca2+以促进NO生成,从而激活NO/cGMP信号通路,进而促进血管内皮细胞的迁移与血管生成。与传统材料不同的是,SA-MSNs@CM-Stiff还促进BMSCs的归巢和旁分泌效应,进而调控巨噬细胞的极化,促进组织修复而非炎症反应。为了实现更好的靶向传递和持久滞留,该研究团队利用了CD47分子修饰抗噬作用并结合了可注射水凝胶的支架功能。SA水凝胶与多巴胺共价修饰后,表现出更佳的生物相容性,并通过钙离子螯合提高了基质刚度,从而促进BMSCs的旁分泌功能。这种复合材料成功激活NO/cGMP信号通路,协调成骨-血管生成耦合反应,为骨修复提供了有利的微环境。综上所述,SA-MSNs@CM-Stiff具有良好的成骨和促血管生成效果,并通过基质刚度调节实现免疫调节功能,预计将成为解决骨质疏松性骨缺损延迟或难愈合问题的重要工具。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

