
【研究背景】
慢性糖尿病溃疡 (DUs) 伤口由于其漫长的愈合过程对全球健康和经济构成了重大挑战,高血糖水平已被认为是 DUs 的主要诱因,它导致抗氧化剂表达降低并诱导氧化应激,从而加剧炎症。尿道狭窄病变通常具有复杂的微环境,其特征是血糖水平升高、炎症反应增强、缺氧、弱碱性 pH 值范围等。所有这些因素都对当前的非手术临床方法提出了巨大的挑战。由于其功能有限,难以有效管理尿道狭窄。多功能纳米剂可以有效重塑慢性糖尿病伤口管理环境。然而,它们的传递主要依赖于布朗运动和随机增强的扩散。它们表现出与血糖水平无关的移动性,这对应对糖尿病伤口内血糖水平的潜在差异提出了挑战,也无法有效解决伤口不愈合或延迟愈合的根本原因。

针对上述问题,武汉理工大学官建国教授团队研究开发了一种由半涂层Janus树枝状介孔二氧化硅纳米粒子制成的纳米马达,利用葡萄糖氧化酶(GOx)和过氧化氢酶(CAT)修饰,以糖尿病伤口中的内源性葡萄糖作为动力。这些纳米马达能够在模拟伤口微环境中,利用葡萄糖浓度梯度自主导航到高血糖区域,显著提高了靶向递送的效率。与游离酶相比,这种方法提高了约35%的葡萄糖还原率,并改善了pH值和氧气水平。体内实验显示,糖尿病小鼠的伤口愈合速度比对照组快近30%,并且炎症和活性氧水平降低,血管内皮生长因子水平上升。这项研究提供了一种新策略,通过利用伤口异质性实现靶向纳米药剂输送,有效管理糖尿病伤口。该文章于2024年10月30日以“Hyperglycemia Targeting Nanomotors for Accelerated Healing of Diabetic Wounds by Efficient Microenvironment Remodeling”为题发表于《Advanced Functional Materials》(DOI:10.1002/adfm.202417146)。
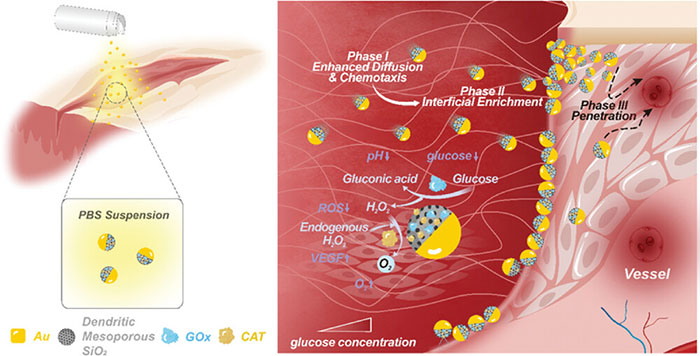
图1 JNDMSN 通过高血糖靶向和多功能伤口微环境重塑有效治疗糖尿病伤口的示意图
(1)纳米马达的制备与表征
所制备的纳米马达的制造过程如图2A 所示。采用阴离子辅助合成法制备树枝状介孔二氧化硅纳米粒子(DMS)载体。为了进一步修饰GOx和CAT,对DMS进行功能化(3-氨基丙基)三乙氧基硅烷 (APTES) 改性得到氨基功能化样品 (NDMS)。 然后半溅射金层制备 Janus 结构 (JNDMS),其特点是对比度的差异 (图 2B ) 和金元素分布的不对称 (图2C )。 随后通过戊二醛 (GA) 在 JNDMS 未涂层侧交联实现酶的固定化,得到制备好的纳米马达 (JNDMSN)。在 DMS 和 NDMS 中都观察到 Zeta 电位从负到正的转变(图2D),证实了氨基功能化成功。 随后向负电位的转变揭示了金涂层和酶的固定化。此外,FTIR 光谱表征也证明了氨基官能化和酶固定化的成功。此外,还使用二辛可宁酸(BCA)蛋白质测定试剂盒测定了酶量(图2F),两种方法获得的结果接近,说明纳米马达上酶的负载效率很高。这些结果证明了它们具有良好的胶体稳定性,并有望在复杂的生理环境中应用。

图2 制备好的 JNDMSN 的制造和特性。A) JNDMSN 制备示意图。B) SEM 和 C) JNDMSN 的 TEM 图像以及元素映射。比例尺:250 nm。D) 制备好的样品的 Zeta 电位和 E) FTIR 光谱。F) 酶负载的标准曲线。插图是 NDMSN 和 JNDMSN 中的酶负载量
(2)增强扩散
纳米马达由 GOx 和 CAT 级联反应产物(例如葡萄糖、葡萄糖醛酸和 O2)的不对称分布产生的界面扩散电泳滑移推动(图 3A )。不同葡萄糖浓度下 JNDMSN 的典型轨迹如图3A所示。随后,扩散系数随着葡萄糖浓度的进一步增加,迁移率缓慢增加(图 3B)。与之前报道的涉及类似 Janus 结构的结果相比,在生理葡萄糖水平下,所制备的 JNDMSN 的迁移率提高了四倍,这与其减小的粒径和高酶负载密切相关。JNDMSN在纯水中的扩散系数约为 1.81 ± 0.39 µm2/s,并且随着离子浓度从 1.5 mM 增加至 150 mM 而逐渐降低(图 3C),值得注意的是,在系统中引入蛋白质不仅不会降低纳米马达的移动性,而且还在一定程度上对其运动产生了刺激作用,表现出增强的扩散作用。制备的 JNDMSN 在富含离子和蛋白质的环境中表现出优异的移动性,这表明其在生理环境中具有潜在的应用价值。JNDMSN 的密度分布以彩色编码图表示(图3D)。通过绘制所选感兴趣区域的像素强度分布的时间变化直方图,进一步定量呈现它们的扩散动态(图3E)。这极大地突显了 JNDMSN 分布的不均匀性,表明其扩散增强,并具有预期的群集迁移行为。增强的移动性允许在更短的时间内覆盖更大的面积,从而有助于有效的伤口管理。
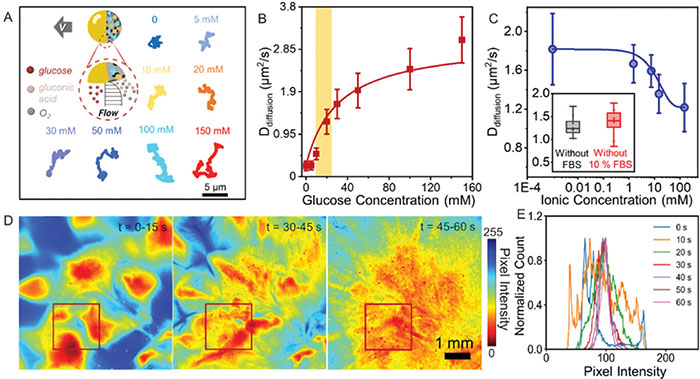
图3 JNDMSN 的增强扩散行为。A) 制备好的 JNDMSN 在 3 秒内的级联反应推进和代表性运动轨迹示意图。制备好的 JNDMSN 的扩散系数 B) 在不同葡萄糖浓度下和 C) 在不同离子浓度的 PBS 溶液和 10% FBS 补充的 DMEM 中。黄色部分对应糖尿病伤口的生理血糖范围。D) 在 60 秒内,在含有 20 mM 葡萄糖的模拟伤口环境中获得的活性 JNDMSN 的彩色编码密度分布图。E) 所选感兴趣区域 (D) 中像素强度分布的时间变化直方图
(3)趋化性增强靶向作用以增强微环境调节
与 JNDMSs 相比,GOx 和 CAT 修饰的 NDMSN 和 JNDMSN 表现出明显的向高糖区域趋化行为,如图4A所示。其中,具有Janus结构的JNDMSN表现出最高的趋化效果,表明纳米粒子在葡萄糖浓度梯度场中的移动性是基于增强扩散的趋化行为,而非梯度场的扩散泳动吸引或凝胶引起的对流。通过趋化速度、趋化指数和趋化方向性三个参数进一步比较它们的趋化能力(图 4B-D)。这种增强可以归因于它们的不对称 Janus 结构,赋予它们更大的扭矩。这种增强的趋化性可能使其更倾向于优先在高血糖水平的区域积累,从而实现对糖尿病伤口的有效治疗。如图4E所示,基于非平衡朗之万方程,模拟了 JNDMSNs 在高葡萄糖界面趋化性增强的积累功效 。纳米载体 JNDMS、完全改性的 NDMSN 和制备的 JNDMSN 在伤口模型中的动态分布如图 4F所示。单个 JNDMSN 的轨迹最具方向性,这意味着通过其强大的趋化性可以最佳地校正扩散。由于粒子与粒子和粒子与界面之间更频繁的碰撞而导致的这种界面富集可能导致局部压力升高,从而促进纳米粒子进一步渗透到伤口组织中的界面。此外,JNDMSNs的增强扩散和在高葡萄糖界面上的增强富集有利于葡萄糖消耗达到最高(图 4G),相应地,大量的葡萄糖酸生成,导致pH值迅速降低,同时体系中的 O2产生量达到最大(图4H,I),而且O2的产生进一步促进了葡萄糖的氧化。这一现象可用于通过降低葡萄糖水平同时支持O2供应来改善糖尿病伤口微环境,从而通过自主选择工作区域实现伤口微环境的有效重塑。
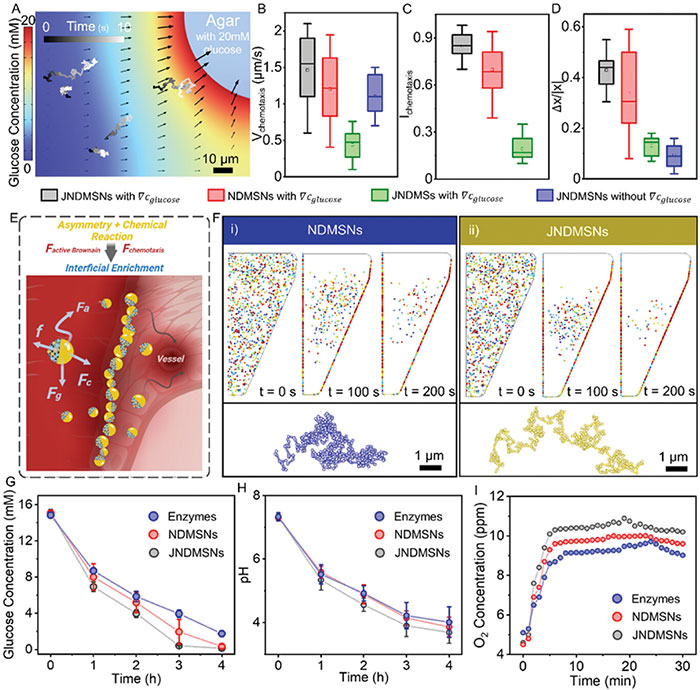
图4 趋化性增强的界面富集和增强的动态微环境调节功能。A) JNDMSN 的趋化行为。背景颜色表示伤口微环境内的模拟葡萄糖浓度梯度(∇c葡萄糖)。B) 趋化速度(V趋化)、C) 趋化指数(I趋化)和 D) 在不同实验条件下获得的趋化方向性:具有∇c葡萄糖的 JNDMSN 、具有∇c葡萄糖的 NDMSN 、具有∇c葡萄糖的 JNDMS和不具有∇c葡萄糖的JNDMSN。E ) 趋化性增强的界面富集图示。F) 模拟伤口模型中纳米粒子分布的数值模拟。插图为不同纳米粒子相应的运动轨迹。在游离酶(GOx 和 CAT)、NDMSN 和 JNDMSN 存在下,几种微环境因素随时间的变化。G) 葡萄糖浓度,H) pH 值,和 (I) O2浓度
(4)体外评价
研究使用人角质形成细胞(HaCaT)和人脐静脉内皮细胞(HUVEC)评估了纳米材料NDMSNs和JNDMSNs的细胞效应,包括清除活性氧(ROS)、缓解缺氧、促进细胞迁移以及细胞毒性。通过CCK-8试验,发现不同浓度的JNDMSNs对细胞活力和增殖没有明显影响,显示出良好的生物相容性。使用DCFH-DA探针检测ROS水平,结果表明JNDMSNs在HaCaT和HUVEC细胞中均表现出显著的ROS清除能力,清除率分别提高约21.2%和23.4%。氧气含量测定显示,JNDMSNs显著增加了细胞内O2含量,促进了葡萄糖的氧化和H2O2的分解。进一步评估发现,JNDMSNs能显著提高HUVEC细胞中血管内皮生长因子(VEGF)的表达,增加幅度达133%。此外,JNDMSNs还显著促进了HUVEC细胞的增殖和迁移,迁移速度比NDMSNs增加了27.6%。总的来说,JNDMSNs通过增强氧气供应和ROS清除能力,显著改善了细胞的生存和功能。
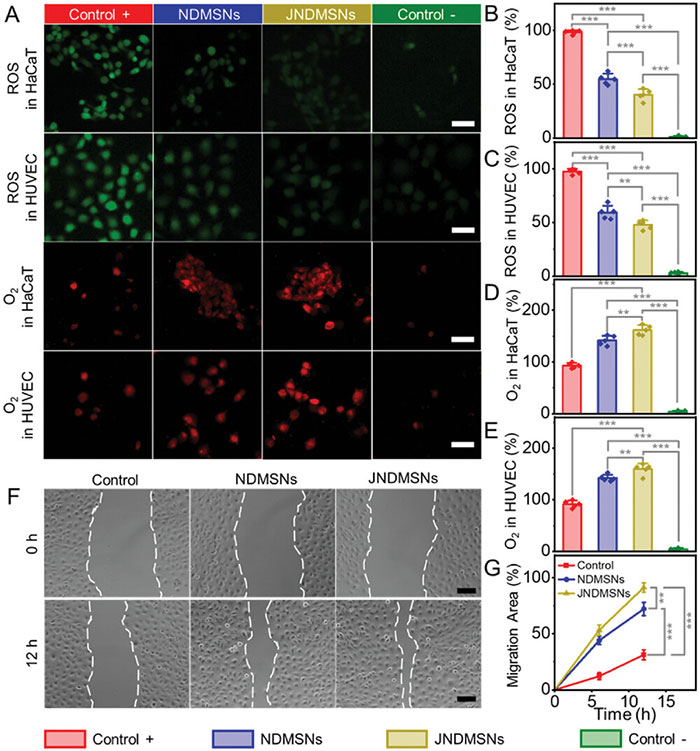
图5 细胞水平的体外评估。A) HaCaT 和 HUVEC 细胞中不同组别的 ROS 清除和缺氧缓解表现。H 2 O 2和 PBS 分别用作阳性 (+) 和阴性 (-) 对照。比例尺:50 µm。B、C) ROS 水平和 D、E) O 2含量的相应统计分析。F) HUVEC 细胞迁移的图像和 G) 量化。比例尺:100 µm。显著差异:* p < 0.05,** p < 0.01,*** p < 0.001。
(5)糖尿病伤口的体内治疗
基于体外研究结果,进一步评估了JNDMSNs在糖尿病小鼠(db/db,平均血糖浓度为27.4 ± 2.4 mM)伤口治疗中的潜力。JNDMSNs与PBS混合后,每两天喷洒在伤口上。结果显示,经过10天的治疗,JNDMSNs显著促进了伤口愈合,仅留下轻微的痂皮,14天后表皮恢复正常,优于游离酶和NDMSN治疗的效果。组织学分析表明,尽管所有组在治疗7天后都有炎症细胞浸润,JNDMSNs组的炎症反应明显减弱,伤口面积最小,结痂最薄。而对照组和JNDMS组在治疗14天后仍有大量炎症细胞。JNDMSNs组的胶原沉积明显高于其他组,且毛囊、血管和皮脂腺再生增强。统计分析证实,JNDMSNs治疗后的皮肤结构更接近健康皮肤,显示出加速伤口愈合的效果,这得益于其移动性和葡萄糖激活的级联反应的协同作用。
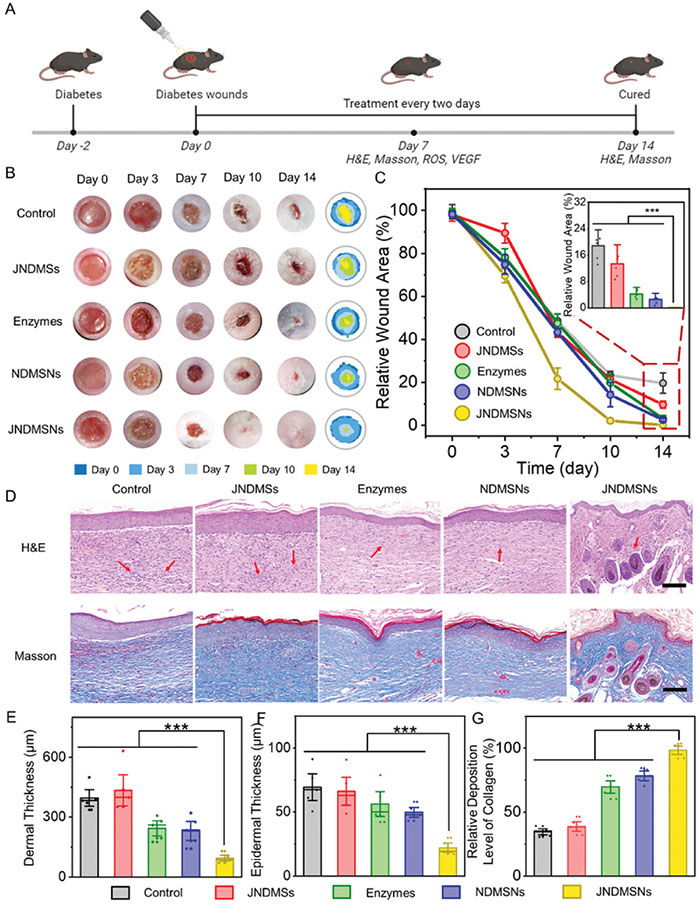
图6 JNDMSNs 在体内治疗加速糖尿病伤口愈合。A) 体内实验设计。B) 不同组别在第 0、3、7、10 和 14 天治疗的糖尿病伤口的代表性照片图像和相应的伤口痕迹。C) 伤口面积随时间变化的曲线。D) 第 14 天不同组别伤口的苏木精和伊红 (H&E) 和 Masson 染色皮肤组织。标尺:1 毫米。第 14 天 E) 表皮厚度、F) 真皮厚度和 G) 胶原沉积水平的统计分析。显著差异:* p < 0.05,** p < 0.01,*** p < 0.001
(6)加速愈合机制
为了阐明JNDMSNs加速伤口愈合的机制,研究评估了不同治疗组中纳米粒子在伤口中的渗透情况。采用线性切口以保持伤口组织结构完整性。荧光成像显示,JNDMSNs在伤口界面表现出最强的荧光,表明其具有较好的界面富集和趋化能力,增强了葡萄糖消耗。通过引入“特征渗透深度”(CPD)参数,发现JNDMSNs的CPD最大(2.44 ± 0.26 µm),显著高于其他组。JNDMSNs处理的伤口pH约为7.15,组织中的葡萄糖浓度显著降低,葡萄糖还原效率提高约40%,证明了伤口微环境的体内重塑。在评估ROS清除、缺氧缓解和VEGF上调的效果时,结果显示JNDMSNs组在免疫组织化学染色中HIF-1α表达显著降低,表明其具有良好的缺氧缓解能力。此外,JNDMSNs组的ROS水平显著降低,VEGF表达上调至对照组的2.5倍,促进血管生成,有助于糖尿病伤口的愈合。关于血管生成和巨噬细胞调节,JNDMSNs组显示更高的血管密度和成熟度,且巨噬细胞的M1标志物CD86减少而M2标志物CD206增加,表明其能有效降低炎症反应。综上所述,JNDMSNs通过增强扩散、清除ROS、降低血糖和pH值,促进内皮细胞增殖和迁移,从而加速糖尿病伤口的愈合。
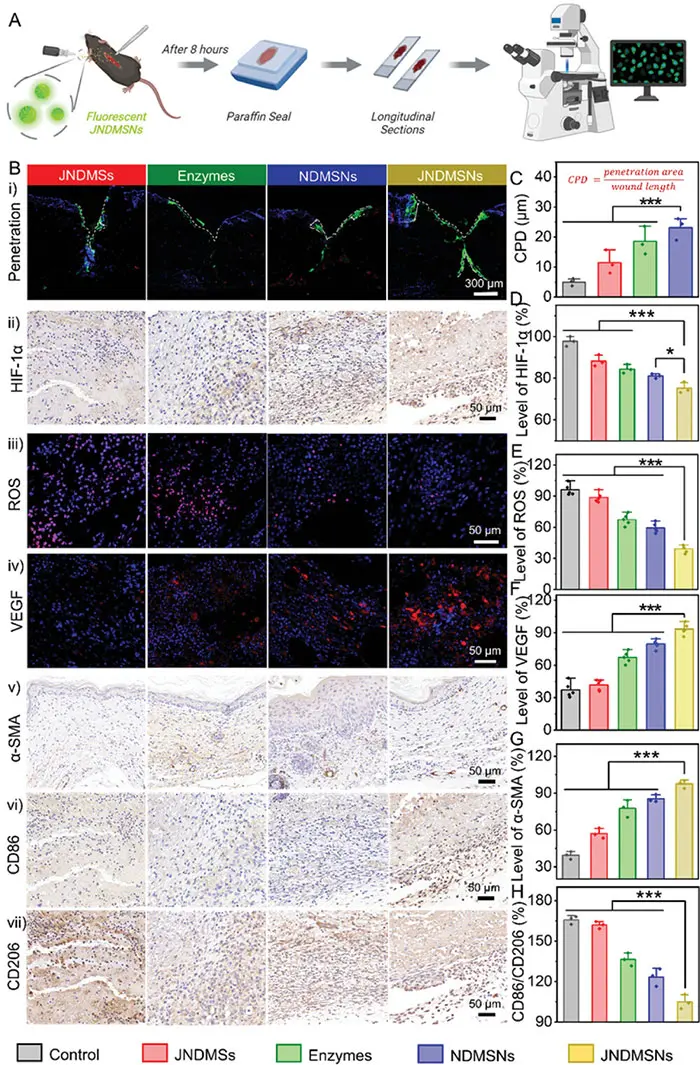
图7 糖尿病伤口在体内的愈合机制。A) 纳米粒子渗透评估过程说明。B) 用不同纳米粒子治疗的伤口的免疫荧光和免疫组织化学染色图像。渗透切片用分化簇 31 (CD31,红色)、4′,6-二脒基-2-苯基吲哚 (DAPI,蓝色) 标记,所用的纳米粒子用 FITC (绿色) 标记。ROS 切片用 DHE (红色) 标记。VEGF 切片用 Alexa Fluor 594 (红色) 标记。不同治疗组中 C) 特征渗透深度 (CPD)、D) HIF-1α、E) ROS 和 F) VEGF、G) α-SMA 水平和 H) CD86/CD206 的统计分析。显著差异:* p < 0.05、** p < 0.01 和 *** p < 0.001
(7)生物安全评价
研究评估了各种纳米粒子的生物安全性,通过血液相容性、常规血液学和生化检查以及主要器官的组织学分析。溶血试验结果显示,未修饰的JNDMS纳米粒子在200 µg/mL浓度下的溶血率高达68%,主要是由于其负电荷表面与带正电荷膜脂的静电相互作用。相比之下,酶修饰的纳米粒子(NDMSN和JNDMSN)及游离酶显示出优异的血液相容性,未发现红细胞碎片和可忽略的溶血率在对糖尿病小鼠进行为期14天的常规血液学和生化测试后,所有实验组的血液指标(如MCV、MCHC、HGB等)均未出现显著变化。组织学分析显示,注射不同样本后主要器官的切片未观察到损伤或炎症。这些结果共同证明了JNDMSN在体内的安全性和生物相容性,显示其未来临床应用的潜力。
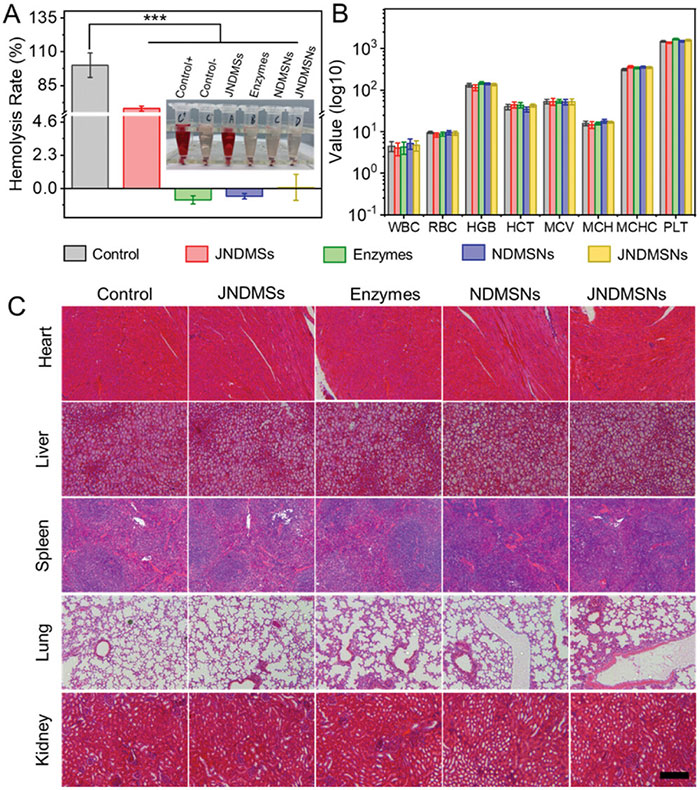
图8 JNDMSNs 的生物安全性评价。A) 暴露于 JNDMSs、酶、NDMSNs 和 JNDMSNs 后的红细胞溶血率和数码照片(插图)。PBS 和去离子水分别用作阴性 (-) 和阳性 (+) 对照。条形图中的“Control”为“Control +”。B) db/db 小鼠在 14 天治疗后的常规血液学检查。E) db/db 小鼠在 14 天治疗后皮下注射不同样品后主要器官 H&E 切片的代表性照片。比例尺:100 µm
【研究小结】
该研究提出了葡萄糖驱动的双酶级联推进纳米马达,这是通过在 Janus 树枝状介孔二氧化硅纳米球上改性 GOx 和 CAT 获得的。这些纳米马达能够通过消耗葡萄糖在富含离子和蛋白质的液体中自主移动。它们的趋化性使它们能够响应内源性葡萄糖梯度,从而能够导航到高血糖界面。在高血糖界面的有效积累和渗透促进了伤口环境的重塑,导致葡萄糖减少 25%,同时伴随 pH 值降低和氧气输送。体内实验证明,改善的微环境通过降低炎症反应和 ROS 水平、促进胶原沉积、提高 VEGF 增强血管形成等,极大地促进了伤口愈合。此外,制备的纳米马达表现出生物安全性。这些发现为基于纳米马达通过有针对性和全面的微环境调节(而不是简单的运动增强策略)治疗糖尿病伤口提供了新的见解。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

