
适应性T细胞疗法(ACT)是一种通过改造T细胞以表达肿瘤特异性受体(如T细胞受体TCR或嵌合抗原受体CAR)的免疫疗法,已在临床前和临床研究中展示出显著潜力。虽然在治疗B细胞恶性肿瘤方面取得了高达90%的完全缓解率,但对大多数实体瘤的疗效仍然有限。实体瘤的独特结构和特征构成了限制效应T细胞(Teff细胞)疗效的主要障碍。实体瘤周围的物理屏障会降低Teff细胞的浸润,如T细胞从内皮细胞外渗到肿瘤所需的粘附分子表达下调,以及细胞外基质的异常沉积导致的致密和纤维化环境,均限制了T细胞的迁移。此外,大量存在的免疫抑制细胞类型(如调节性T细胞Treg)会显著抑制Teff细胞,导致免疫耐受。因此,通过突破物理屏障促进Teff细胞浸润,同时调节肿瘤微环境(TME)以克服免疫抑制,有望增强T细胞疗法治疗实体瘤的效果。

针对上述问题,浙江大学顾臻、张宇琪、郭雨刚、俞计成团队开发了一种表面修饰了趋化因子CCL22的沟槽微针(MN)贴片,以促进TCR T细胞或CAR T细胞向实体瘤的局部渗透,并将Treg细胞从肿瘤微环境(TME)中分流,从而增强抗肿瘤疗效。该团队利用冰模板法制备了由聚苯乙烯组成的凹槽微针贴片,表面形成开放的凹槽,为T细胞的装载提供了足够的空间。插入肿瘤后,体温会触发T细胞从微针中释放,并浸润到实体瘤中。先前的研究表明,凋亡的Treg细胞能有效抑制T细胞的活化,甚至比活的Treg细胞更有效。该团队在微针上装饰了CCL22,以转移Treg细胞,而不是直接诱导其凋亡。作为趋化因子CCL22的受体,CCR4在Treg细胞中高表达,并调节其向TME的迁移。CCL22修饰的微针贴片能有效吸引Treg细胞,产生的CCL22梯度提高了CD8+ T细胞/Treg细胞的比例,从而增强抗肿瘤免疫力。这种由微针介导的T细胞免疫治疗局部策略有可能增强各种ACT疗法,并将其全身副作用降至最低。相关研究在2024年4月21日以“Grooved Microneedle Patch Augments Adoptive T Cell Therapy Against Solid Tumors via Diverting Regulatory T Cells”为题发表于《Advanced Materials》 (DOI: 10.1002/adma.202401667)上。
(1)凹槽微针贴片的示意设计图和表征
MNs由10%聚苯乙烯溶液(溶剂:对二甲苯)制成,采用冰模板法,通过冷冻铸造控制冰晶成核和生长,并通过固液相分离获得有序凹槽结构。扫描电子显微镜(SEM)图像显示,这些纳米颗粒表面具有多个开放且排列有序的凹槽,有助于提高药物递送的有效性。随后,研究团队通过在表面聚合多巴胺来修饰MNs,提高其亲水性和可修饰性,有利于细胞负载和细胞因子修饰。水接触角测量结果显示,聚多巴胺修饰后MNs的润湿性显著增加。此外,微针贴片具有良好的组织穿透机械强度。免疫荧光成像显示,轻轻按压贴片即可使MN彻底破坏实体肿瘤的物理屏障。
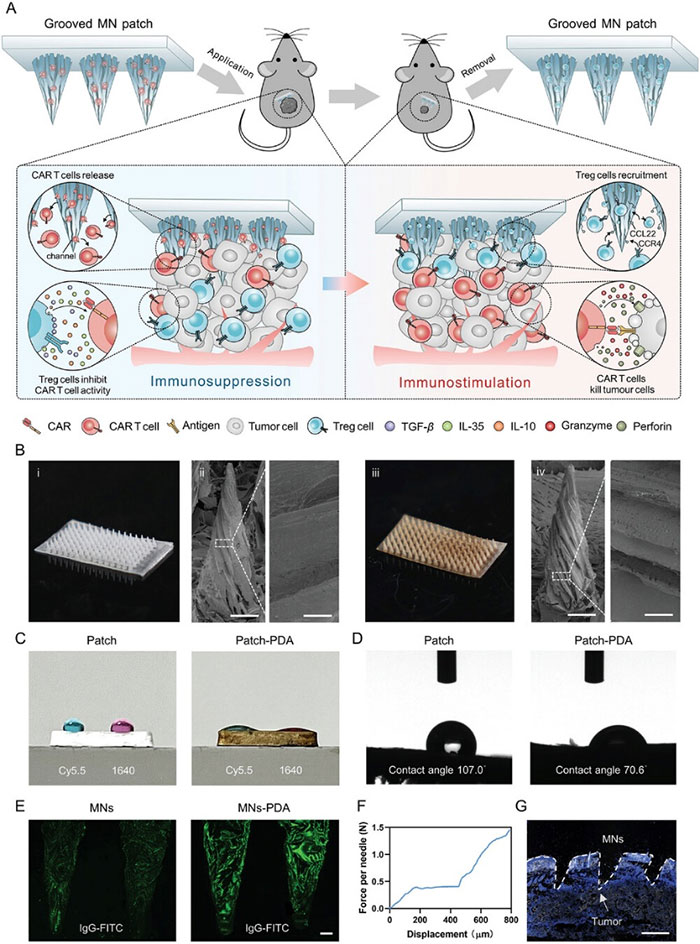
图1 凹槽微针贴片的示意设计图和表征
(2)CCL22修饰的MNs介导Treg细胞迁移
研究人员使用体外Transwell迁移试验评估了CCL22修饰的微针(MNs-CCL22)对Treg细胞迁移的能力。流式细胞术(FACS)分析结果显示,经MNs-CCL22处理的活细胞中,Treg细胞(CD3+CD4+CD25+CD127-)数量在24小时后显著减少(1.15±0.26%),相比于未经修饰的MNs组(2.17±0.29%),而CD8+ T细胞数量差异不显著。MNs-CCL22组的Treg/CD8+ T细胞比例(4.76±0.51%)显著低于MNs组(11.53±1.74%),这对于增强抗肿瘤免疫力至关重要。在体内抗转移能力实验中,不同修饰比例的MNs-CCL22也显著抑制了肿瘤生长,进一步证明了通过募集Treg细胞所做的贡献。
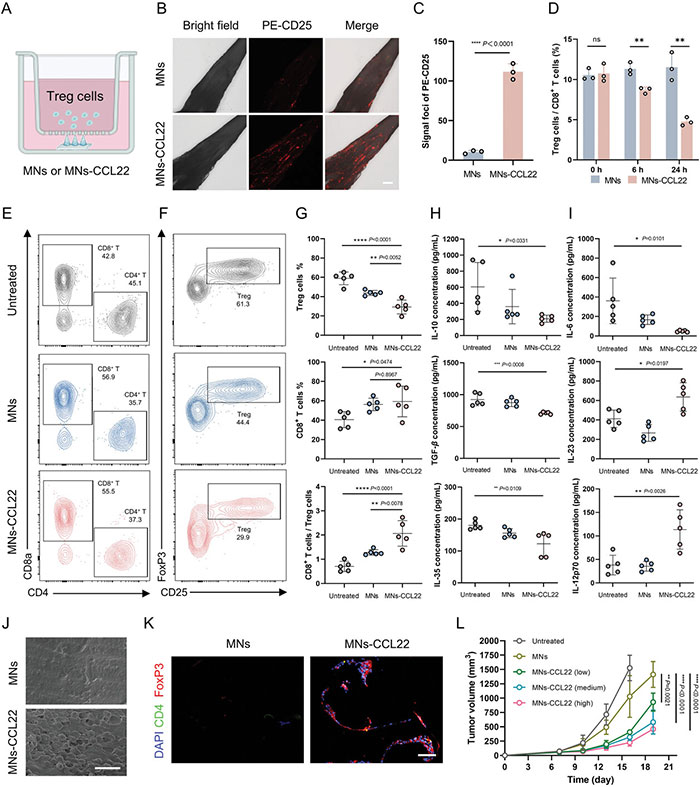
图2 CCL22修饰的MN介导Treg细胞迁移
(3)T细胞的局部递送和控释
除了充当招募免疫抑制性Treg细胞的陷阱外,凹槽微针(MN)还可作为细胞递送装置,将T细胞局部输送到实体肿瘤中。为了进行体外研究,研究人员从OT-I转基因小鼠中分离出CD8+ T细胞,并通过在真空条件下将微针浸入高浓度T细胞的培养基中,将T细胞加载到微针中。此外,还研究了T细胞在37oC下的释放行为。结果表明,微针贴片可以有效地将T细胞局部送入实体瘤。聚多巴胺改性的微针提高了T细胞的装载效率,并通过热响应性明胶凝胶实现T细胞的控释。
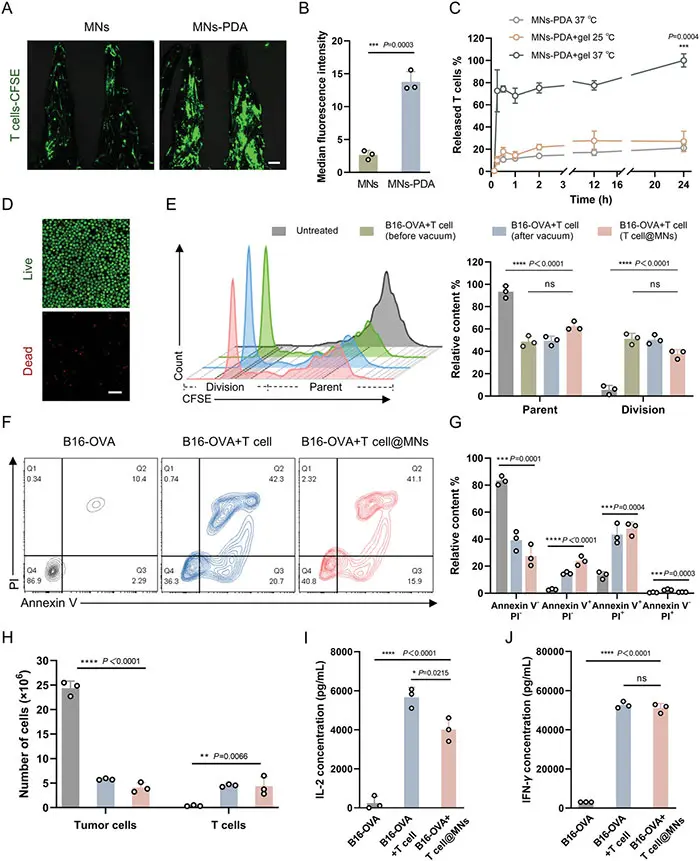
图3 使用微针贴片进行T细胞的体内输送和分布
(4)凹槽MN贴片增强TCR T细胞治疗
为了验证上述微针(MNs)在TCR T细胞疗法中的抗肿瘤效果,研究人员利用小鼠黑色素瘤模型进行了体内实验。结果显示,裸露微针贴片治疗组的小鼠肿瘤生长与未治疗组相似,而MNs-CCL22或TCRT@MNs治疗组显示出中等抗肿瘤效果。当用TCRT@MNs-CCL22治疗时,肿瘤生长显著抑制,40%的小鼠存活至少60天,而未治疗组和MNs治疗组的小鼠无一存活。H&E染色图像显示,治疗组的细胞核收缩和减少,尤其在装载TCR T细胞的MNs-CCL22组中,MNs的变化可以忽略不计。TUNEL测定法进一步揭示该组中凋亡信号最多,TUNEL阳性细胞为95.17±0.25%,证实了凋亡介导的肿瘤细胞杀伤机制。免疫荧光结果表明,MNs-CCL22具有免疫调节作用,能够增强细胞毒性T细胞的抗肿瘤免疫力。
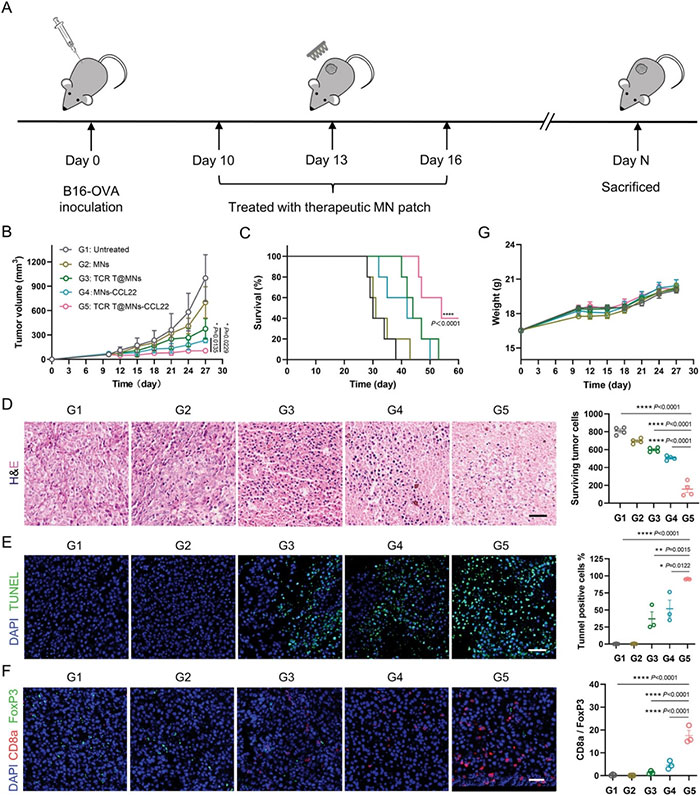
图4 微针介导的T细胞疗法在小鼠黑色素瘤模型中的治疗效果评价
(5)凹槽MN贴片增强CAR - T细胞治疗
研究人员还探索了微针贴片对CAR T细胞疗法的增强效果。通过使用靶向黑色素瘤相关抗原的CAR T细胞,研究人员发现,与未处理的对照组相比,经微针贴片处理的小鼠肿瘤生长得到了有效控制,生存时间延长。此外,微针贴片制剂进行局部治疗不仅能消除局部实体瘤,还能诱导全身抗肿瘤免疫记忆。
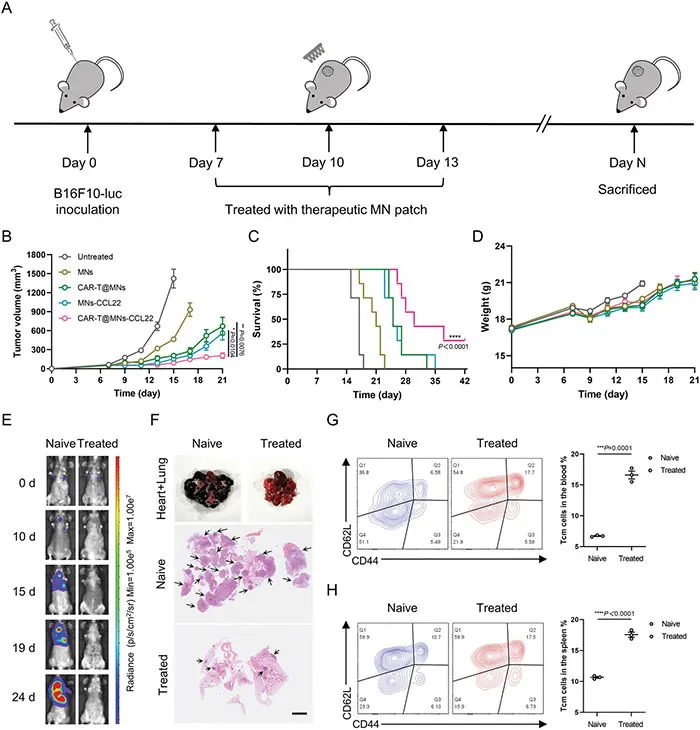
图5 微针治疗后Teff/Treg比例和抗肿瘤反应的分析
(6)Treg细胞转移介导的免疫治疗机制研究
为了证实Treg细胞转移在CAR-T细胞治疗增强中的关键作用,研究人员使用Treg细胞缺失的小鼠进一步评估了CAR T@MNs-CCL22微针的抗肿瘤功效。外周血样本的FACS分析结果显示,CD25抗体处理可诱导Treg耗损(CD3+CD4+CD25+ T细胞)为0.62±0.14%,而未处理的小鼠为7.94±1.14%。用CAR T@MNs和CAR T@MNs-CCL22制剂处理的小鼠具有相似的肿瘤生长特征和生存时间,进一步证实了用MNs-CCL22转移Treg细胞以增强ACT的重要性。此外,各组在治疗期间体重变化无显著差异。
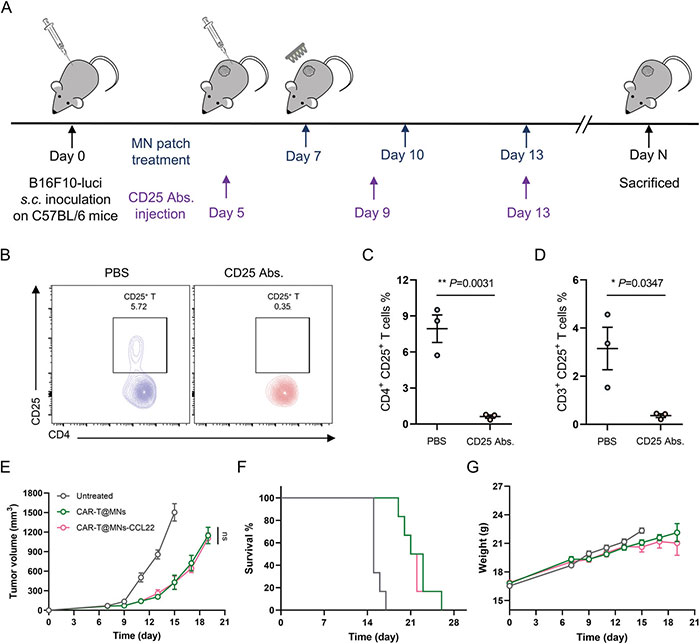
图6 微针介导的CAR T细胞分散接种增强实体瘤的抗癌功效
小结:
针对T细胞浸润不足和免疫抑制微环境的问题,该团队设计了一种带凹槽的微针(MN)贴片,能够将T细胞局部输送到肿瘤部位,并选择性地将Treg细胞转移到微针上。与化疗或单克隆抗体治疗相比,这种带凹槽的MN贴片作为局部微环境,不仅能增强效应T细胞(Teff细胞)在实体瘤中的浸润,还能通过非凋亡途径消除Treg细胞。该装置的制备采用了基于相分离过程的冰模板法,形成垂直通道,用于细胞递送或细胞转运。此外,团队选择了模型趋化因子CCL22,通过温和的化学偶联锚定在微针上,以招募远离肿瘤微环境(TME)的Treg细胞,将微针贴片从体内取出即可清除TME中的Treg细胞。在小鼠黑色素瘤模型中,这些改良的MN贴片展示了在增强TCR T细胞和CAR T细胞疗法方面的治疗潜力。在小鼠体内清除Treg细胞后,虽然未提高CAR-T细胞疗法的效果,但这进一步证明了Treg细胞迁移可增强抗肿瘤效果。这种策略还可用于增强细胞或药物制剂的输送,以治疗各种疾病,如自身免疫性疾病。
原文链接:https://doi.org/10.1002/adma.202401667

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

