
研究背景:
慢性牙周炎是一种由细菌引起的炎症性疾病,导致牙槽骨逐步吸收。在感染过程中,牙菌斑微生物破坏牙周稳态,异常的宿主-细菌相互作用引发持续的炎症反应,导致骨质流失。巨噬细胞介导的炎症反应有助于病原体的清除,但同时产生的活性氧(ROS)和促炎细胞因子会加剧组织破坏。研究表明ROS和牙龈卟啉单胞菌等病原体通过经典或非经典途径激活巨噬细胞NLRP3,不仅增加破骨细胞主导的骨吸收和核因子κB(NF-κB)通路的刺激,而且还损害间充质干细胞的成骨分化能力。靶向抑制巨噬细胞NLRP3炎症小体的激活为牙周炎的治疗提供了一种独特的方法。

针对上述问题,中山大学口腔医院谭家莉主任医师团队提出一种新型双交联水凝胶体系pGM/cPL@NI,该体系具有较高的机械强度和多功能性,可以满足牙周炎治疗的各种需求。通过用苯硼酸(PBA)和邻苯二酚分别对明胶甲基丙烯酰(GelMA)和ε-聚赖氨酸(ε-PL)进行功能化修饰,通过动态硼酸酯键和辐照下光诱导交联的结合,形成负载MCC950的pGM/cPL@NI。利用ε-PL和邻苯二酚的固有特性,实现良好的抗菌和抗氧化性能。在ROS和酸性环境下,pGM/cPL@NI响应性地释放MCC950并抑制巨噬细胞中的NLRP3炎症小体活化,从而减弱促炎极化和细胞因子级联。相关研究在2024年2月5日以“Multifunctionalized and Dual-Crosslinked Hydrogel Promotes Inflammation Resolution and Bone Regeneration via NLRP3 Inhibition in Periodontitis”为题发表于《Small Structures》(DOI:10.1002/sstr.202300281)上。
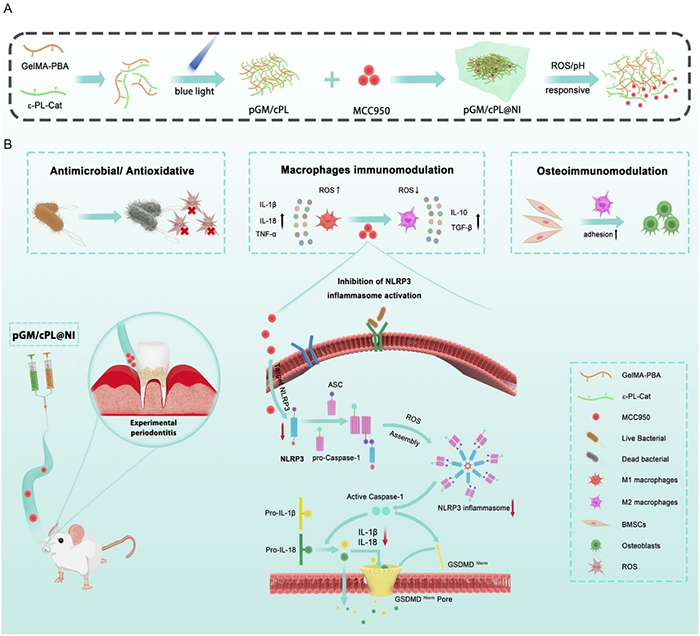
图1 多功能双交联pGM/cPL@NI水凝胶通过免疫调节促进牙周骨再生的机制示意图
(1)可注射双交联响应水凝胶的表征
该研究团队将PBA和儿茶酚基团分别接枝到明胶和ε-PL上,生成GelMA-PBA(pGM)和ε-PL-cat(cPL)(图2A)。通过GelMA-PBA和ε-PL-cat两步交联。第一重交联为动态硼酸酯键,能够响应ROS和酸性环境断裂。第二重交联为碳碳双键,光交联网络保持稳定并有效释放嵌入的药物,而不会快速破坏水凝胶结构。在中性缓冲环境中,pGM/cPL水凝胶的降解速度慢于GelMA。然而,在酸性或富含ROS的环境中,pGM/cPL的降解速度明显加快,且呈H2O2浓度依赖性,进一步证实了其刺激响应性。此外,负载MCC950后,pGM/cPL@NI的药物释放行为与上述结果一致(图2K),模型药物罗丹明B在正常环境下40d内表现出缓释行为。然而,当pH为5.5或存在0.1和1 mm H2O2时,释放速度在2天内显著加快。
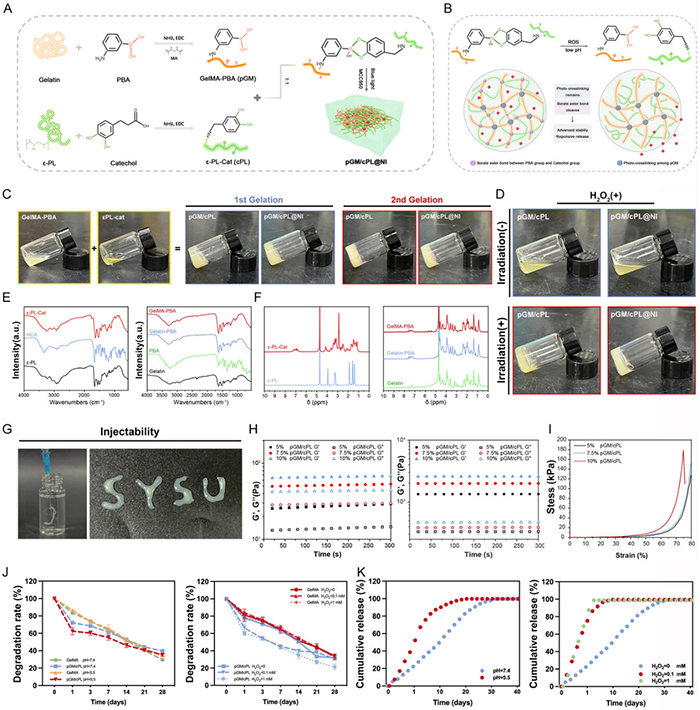
图2 水凝胶的合成与表征
(2)双交联水凝胶的生物相容性和抗菌性能
原代大鼠骨髓干细胞(rBMSCs)和鼠成纤维细胞(L929)活/死染色表明与pGM/cPL和pGM/cPL@NI共培养后细胞活力良好,并且与GelMA水凝胶相比,在培养7天后更能促进细胞的增殖、迁移和细胞内连接。水凝胶溶血率均低于5%,足以支持长期体内使用。与水凝胶培养后的大肠杆菌(E. coli)和牙龈卟啉单胞菌(P. gingivalis)的存活率 分别不到15%和2%(图3G)。E. coli的生长在2小时后受到显著抑制,而P. gingivalis在6小时后也呈现出类似的模式。细菌扫描电子显微镜结果表明,细菌表现出形状不规则、膜收缩或破裂的现象。其抗菌机制主要归因于阳离子诱导的ε-PL细胞/壁膜裂解,儿茶酚中的多巴胺残基通过自氧化协同杀死微生物。
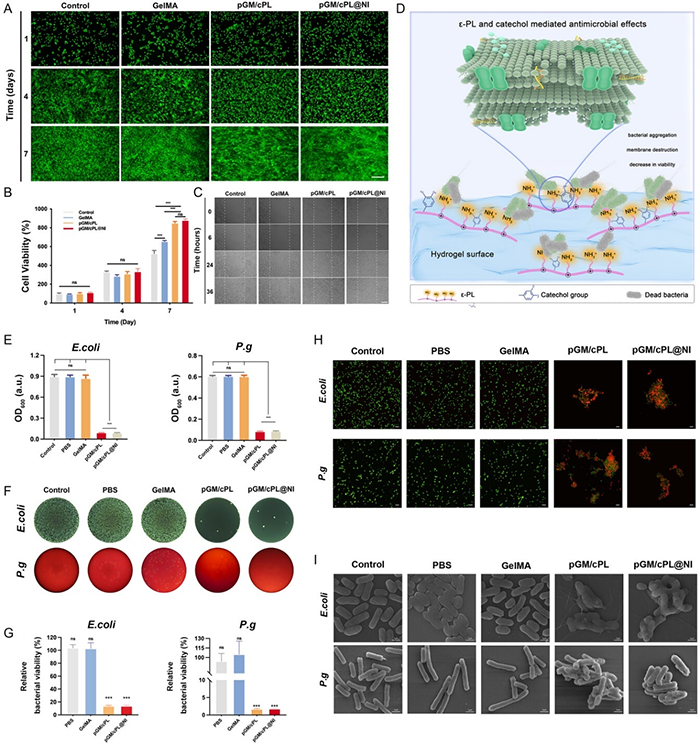
图3 水凝胶的体外生物相容性和抗菌性能
(3)pGM/cPL@NI有效减弱P. gingivalis诱导的NLRP3炎症小体活化和巨噬细胞中促炎细胞因子的过度产生
MCC950以浓度依赖性方式抑制P. gingivalis-LPS/Nigericin刺激后细胞外IL-1β的表达水平。NLRP3炎症小体的激活介导细胞焦亡,膜通透性增加,乳酸脱氢酶(LDH)释放到细胞外。pGM/cPL和pGM/cPL@NI水凝胶处理后细胞膜的活力和通透性大大恢复,感染P. gingivalis的BMDM因膜破裂而逐渐分泌LDH;pGM/cPL和pGM/cPL@NI水凝胶在4小时内显著降低了LDH释放的增加。经pGM/cPL@NI水凝胶处理后,Nlrp3、Caspase1和Gsdmd的表达均呈明显下降趋势,pGM/cPL和pGM/cPL@NI之间存在显著差异。水凝胶处理后促炎细胞因子(IL-1β、IL-18和TNF-α)的分泌量显著减少。
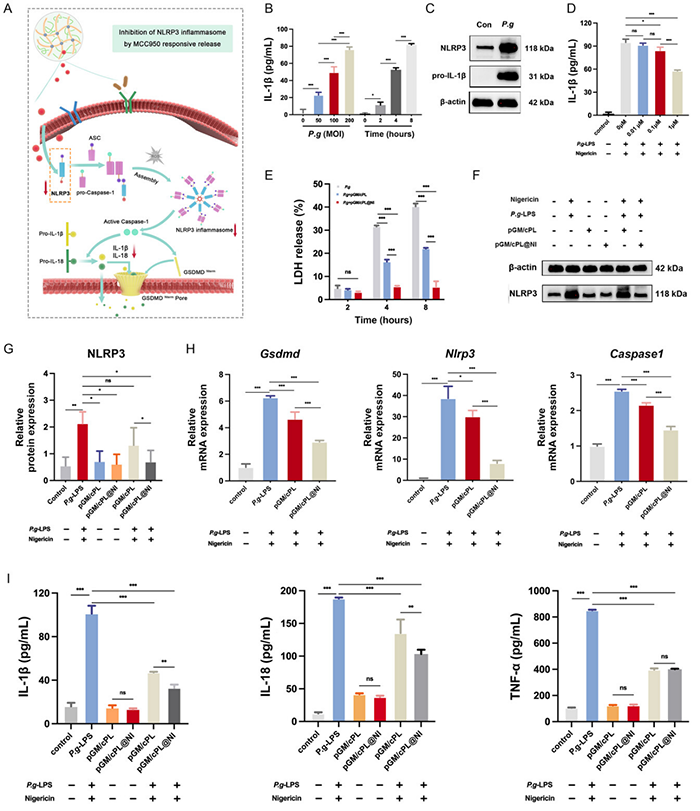
图4 pGM/cPL@NI体外通过释放MCC950抑制NLRP3炎症小体活化
(4)pGM/cPL@NI体外清除细胞内氧化应激并促进抗炎巨噬细胞极化
由于ε-PL上儿茶酚的修饰,酚羟基成为ROS的最佳氢或电子供体,有效清除高浓度的ROS。将细胞与pGM/cPL或pGM/cPL@NI共培养后,DCF的荧光强度明显降低。流式细胞术结果显示,经pGM/cPL和pGM/cPL@NI处理后,ROS表达下降约50%。与对照组相比,P. gingivalis -LPS诱导的炎症显著降低了线粒体膜电位,单体/聚集体比例提高了24.59±4.33倍。相反,pGM/cPL和pGM/cPL@NI恢复了膜电位,并且存在更多的JC-1聚集体。通过将BMDM与pGM/cPL和pGM/cPL@NI共培养,能够显著降低P. gingivalis-LPS对M2极化的抑制作用,并促使细胞从M0型极化为M2型。
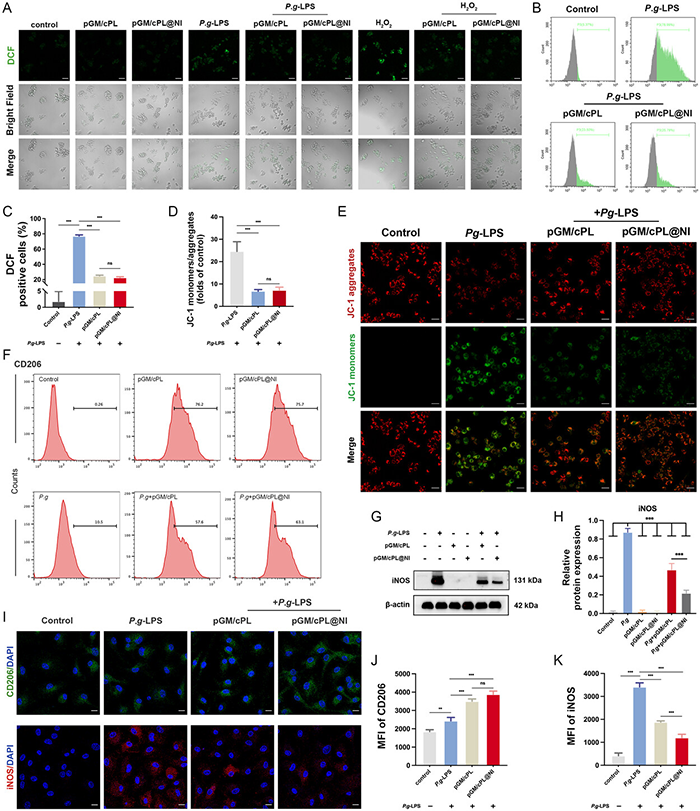
图5 体外评估水凝胶在 ROS 清除和巨噬细胞极化调节中的活性
(5)pGM/cPL@NI促进rBMSCs体外成骨分化
碱性磷酸酶(ALP)染色和茜素红S(ARS)染色结果显示pGM/cPL和pGM/cPL@NI组的基质矿化均显著增加,显示出更优异的成骨效果。虽然P. gingivalis -LPS诱导后rBMSCs的成骨潜能减弱,但通过pGM/cPL和pGM/cPL@NI处理细胞后,炎症条件下成骨作用得到了改善。与P. gingivalis -LPS组相比,pGM/cPL和pGM/cPL@NI组的成骨相关基因(Runx2、Alp、Ocn和Osx)的mRNA表达显著上调(p < 0.05)。当不存在P. gingivalis -LPS时,pGM/cPL和pGM/cPL@NI水凝胶均显著增加Runx2和OCN的表达。P. gingivalis -LPS 显著降低成骨作用,随后通过水凝胶干预成功恢复。为了确定通过巨噬细胞调节间接控制成骨作用,将rBMSCs与由P. gingivalis -LPS和Nigericin预先诱导的巨噬细胞条件培养基(Mφ-CM)共培养,以模拟NLRP3炎症小体活化环境。通过pGM/cPL@NI的免疫调节作用,条件培养基显着增强了rBMSCs的基质矿化。pGM/cPL@NI干预后,qRT-PCR数据显示RUNX2和OCN上调,但P. gingivalis -LPS/Nigericin组与pGM/cPL组之间无显著差异。
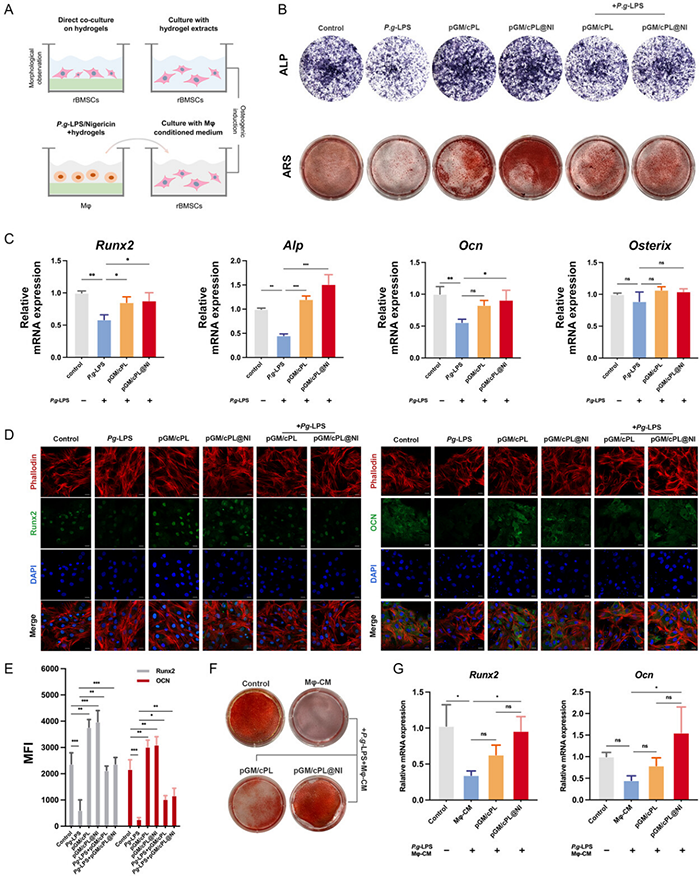
图6 pGM/cPL和pGM/cPL@NI直接和间接促进rBMSCs体外成骨分化
(6)pGM/cPL@NI减少实验大鼠牙周炎的炎症性骨质流失
采用丝线结扎联合牙龈卟啉单胞菌注射法建立大鼠实验性牙周炎模型,每3天注射一次水凝胶。在牙周炎诱导4周和水凝胶干预4周后,micro-CT显示组间存在明显差异。丝线结扎和牙龈卟啉单胞菌感染导致第二磨牙周围近远中部分均出现明显的骨吸收,甚至达到根尖1/3。pGM/cPL@NI将CEJ-ABC距离减少至0.43±0.02 mm,比对照组和PBS组减少近50%。Micro-CT分析显示pGM/cPL和pGM/cPL@NI水凝胶治疗的组与对照组和PBS组相比,均使骨量显著增加。组织学染色结果显示,牙槽骨及连接上皮附着正常,高度正常,但均在牙周炎后出现根尖萎缩,形成深牙周袋,并伴有大量炎症细胞浸润和牙间乳头破坏。水凝胶组牙周状况明显改善。Masson三色染色结果显示,pGM/cPL和pGM/cPL@NI组牙槽骨新生及胶原沉积增多,与PBS组相比,新骨表面相对光滑、连续。CD206、IL-1β和Runx2的免疫荧光染色显示PBS处理后,炎症因子IL-1β表达较高,而水凝胶治疗后牙周炎症明显减轻。同时,与PBS组相比,荧光标记的CD206和Runx2在pGM/cPL和pGM/cPL@NI组中分布广泛,体现了多功能水凝胶对牙周组织修复的正向调控作用。载MCC950的pGM/cPL@NI在调节这些标志物方面发挥了优异的潜力,在促进炎症消退和骨再生方面有更显著的改善。
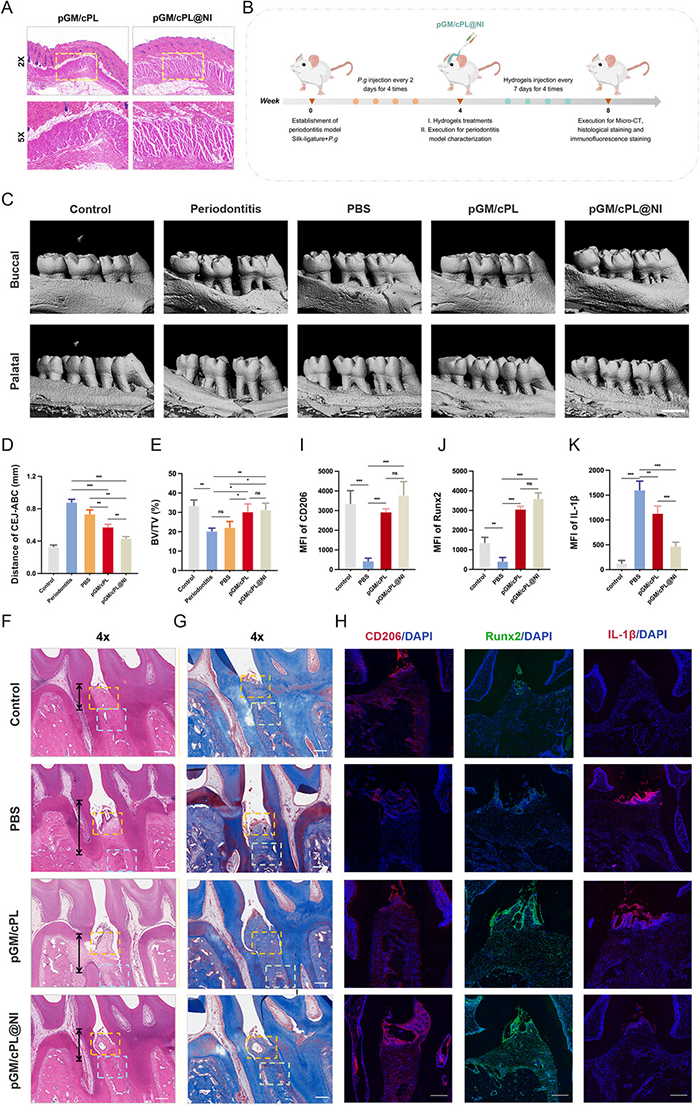
图7 pGM/cPL 和 pGM/cPL@NI 促进体内牙周炎症消退和骨再生
小结:
该团队开发了一种具有双交联网络的多功能药物输送水凝胶系统pGM/cPL@NI,该系统结合了抗菌、ROS清除、免疫调节和促进成骨分化等作用,发挥了良好的牙槽骨再生作用。动态化学键和光诱导双重交联增强了水凝胶的机械强度,并赋予pGM/cPL@NI水凝胶牙周微环境响应释放NLRP3抑制剂MCC950的能力。通过ε-PL 和儿茶酚的固有特性实现杀菌和抗氧化作用,无需引入其他物质。本研究明确了牙龈卟啉单胞菌诱导的NLRP3炎症小体活化与牙周炎进展之间的相关性,而pGM/cPL@NI释放的MCC950可有效阻断这种相关性,进一步促进巨噬细胞的抗炎调节。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/sstr.202300281
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

