
由冠状动脉阻塞引起的心肌梗死(Myocardial infarction,MI)是世界范围内心血管疾病发病率和死亡率的主要原因。在心肌梗死的初始阶段,局部缺血、缺氧微环境导致大多数心肌细胞不可逆坏死,并引发炎症反应。然而,这些影响往往延伸到遥远的非梗死区域,导致更严重的心肌细胞损失,收缩功能受损,心室壁完整性破坏,甚至心脏破裂。这些后果主要归因于广泛的氧化应激和炎症。传统的治疗方法包括药物治疗、冠状动脉介入治疗和外科手术,这些方法在改善患者预后方面虽有显著成效,但仍存在一些局限性,例如无法完全恢复受损心肌的功能。近年来,随着生物材料和再生医学的迅速发展,水凝胶贴片作为一种创新的治疗手段,逐渐受到研究者和临床医生的关注。此前有研究证实导电水凝胶贴片有助于心肌梗死后的心脏修复和电传导,但是大多数导电水凝胶存在稳定性差、湿性粘附能力较弱和生物相容性差等缺点。因此,亟需制定一种兼具稳定导电特性和湿性自粘附的心脏贴片策略来长期改善MI后的心功能。

针对上述问题,南方医科大学第十附属医院(东莞市人民医院)区彩文研究员、西南交通大学鲁雄教授以及中国海洋大学韩璐教授合作,创新设计了一种兼具稳定导电特性、湿性自粘附性和生物可降解性的水凝胶自粘贴片,用于修复心肌梗死。该水凝胶(PPG)由导电的聚多巴胺杂化PEDOT纳米颗粒(PPEDOT NPs)和聚没食子酸(PGA)-互渗透-明胶甲基丙烯酰胺(GelMA)网络组成。由于其亲水性,PPEDOT NPs均匀分布在聚合物网络中,在聚合物网络中形成了连接良好的电通路,具有稳定的导电性。这种具有内在导电性的水凝胶对于MI后电通信的维持至关重要。此外,作者提出了一种去溶剂化策略,赋予水凝胶的湿粘附特性,即水凝胶通过在乙醇中进行脱溶剂后以调节聚合物链的缠结,形成脱溶网络。当水凝胶接触潮湿的组织表面时,脱溶的网络迅速吸收界面水,打断水化层,使粘合剂之间直接相互作用各组在水凝胶和心脏组织中。同时,PPEDOT NPs不仅在水凝胶网络中建立了高导电性路径,而且还建立了苯酚和醌基团的动态氧化还原平衡系统,因此赋予了持久的组织粘连性,并且引起异物反应的风险很小。PPG水凝胶具有高度柔韧性和机械弹性,可适应舒张和收缩运动;在水凝胶和心肌之间建立一个适形、稳定、无缝且电耦合的界面,以支持心脏同步收缩/舒张并恢复恶性心律失常。除此以外,PGA赋予水凝胶固有的抗氧化和免疫调节能力,减少氧化损伤,解决早期炎症反应,防止心室重构。因此,PPG水凝胶能有效改善心肌梗死后大鼠的心功能,并在小型猪心肌梗死模型中表现出巨大的转化潜力。相关研究在2024年1月12日以“A polyphenol-derived redox-active and conductive nanoparticle-reinforced hydrogel with wet adhesiveness for myocardial infarction repair by simultaneously stimulating anti-inflammation and calcium homeostasis pathways”为题发表于《Nano Today》(DOI:https://doi.org/10.1016/j.nantod.2024.102157 )上。韩璐教授、鲁雄教授和区彩文研究员为该文的通讯作者。
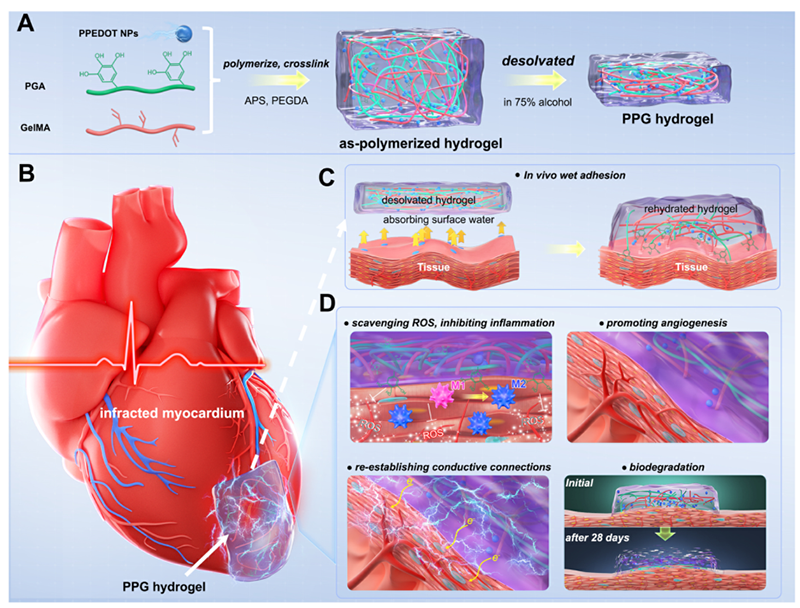
图1 导电水凝胶PPG的制备过程及其用于MI修复的示意图
(1)PPG水凝胶优异的机械、导电和湿粘合性能
PPG水凝胶具有良好的柔韧性、导电性和湿粘性,可以作为贴片粘附于心脏表面传输生物电信号,与心肌组织建立电通信。PPG水凝胶具有高柔韧性(断裂应变> 90%)、柔软性(杨氏模量为138 kPa)和高抗疲劳性能。由于水凝胶中PPEDOT纳米颗粒的纳米增强作用,PPG水凝胶具有较高的拉伸强度和杨氏模量。表明PPG水凝胶的结构能够顺应心脏跳动的动态变形,提供有效的机械支撑,防止心肌梗死后心脏进一步膨胀。同时,PPG水凝胶具有固有的导电性,从而支持其在潮湿环境中的应用,有利于构建与心肌组织的电通信。除此以外,PPG水凝胶中的多酚基团和RGD序列分别与组织表面的氨基和巯基形成共价键和非共价键相互作用(氢键和静电相互作用),实现瞬间粘附。PPG水凝胶的这些特性促进了它作为粘接和导电心脏贴片在心肌梗死治疗中的应用。此外,PPG水凝胶的小膨胀率和长期粘附特性的协同作用,极大地防止了长期体内植入过程中心脏表面的几何失配和分层。
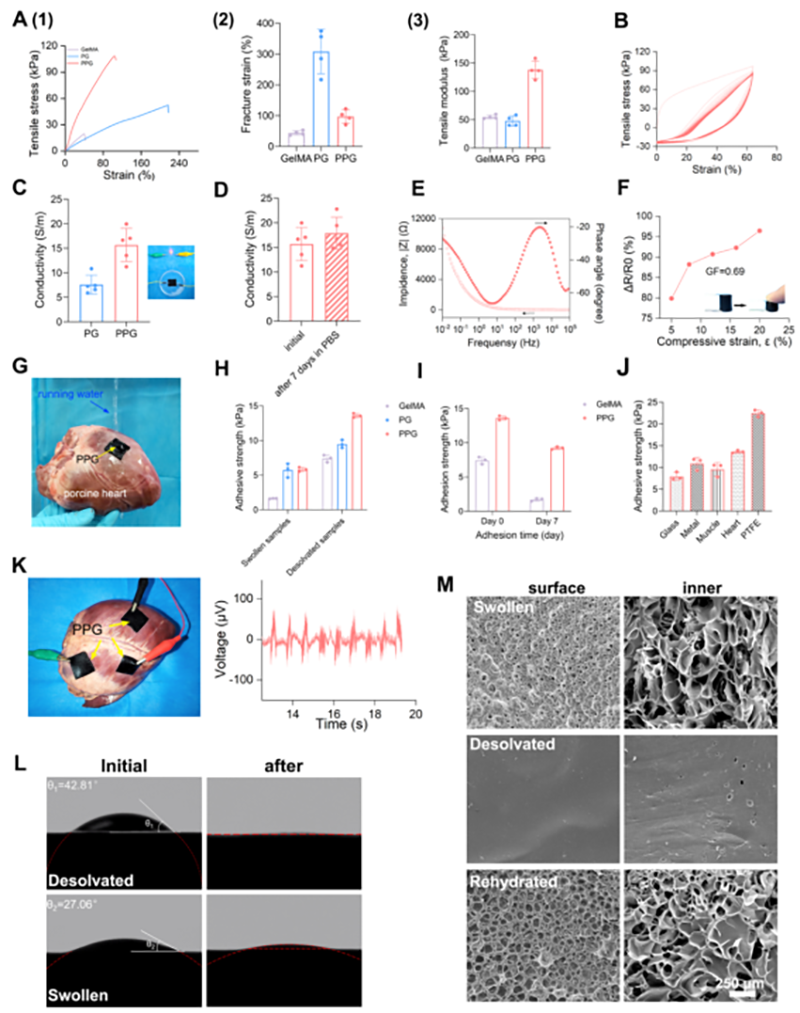
图2 PPG水凝胶的理化性能表征
(2)PPG水凝胶的生物学效应
PPG水凝胶能够促进新生乳鼠原代心肌细胞活性和增殖,减少细胞凋亡,同时增强心肌缝隙连接蛋白CX-43的表达,增加心肌细胞Ca2+定量峰值。可见,PPG水凝胶具有良好的细胞相容性和细胞亲和性,能有效促进细胞粘附和迁移,无明显细胞毒性,并且有利于促进心肌细胞的电信号传导,表现出优异的抗氧化性能,可以保护心肌细胞免受氧化应激。以上结果表明,导电PPG水凝胶不仅产生有效的电脉冲,同步心肌细胞的有序跳动,而且具有抑制肌成纤维细胞形成和限制心室重构的免疫调节能力。

图3 PPG水凝胶上的体外生物学效应评估
(3)PPG水凝胶的体内湿黏附心肌整合特性
PPG水凝胶在大鼠心脏表面的粘附可达28天,且随着时间逐渐降解。同时,PPG水凝胶通过抑制M1型巨噬细胞极化和促进M2型巨噬细胞极化,抑制促炎细胞因子的表达和促进抗炎细胞因子的表达来调节梗死心脏的免疫反应,从而在早期心肌梗死中发挥心脏保护作用。
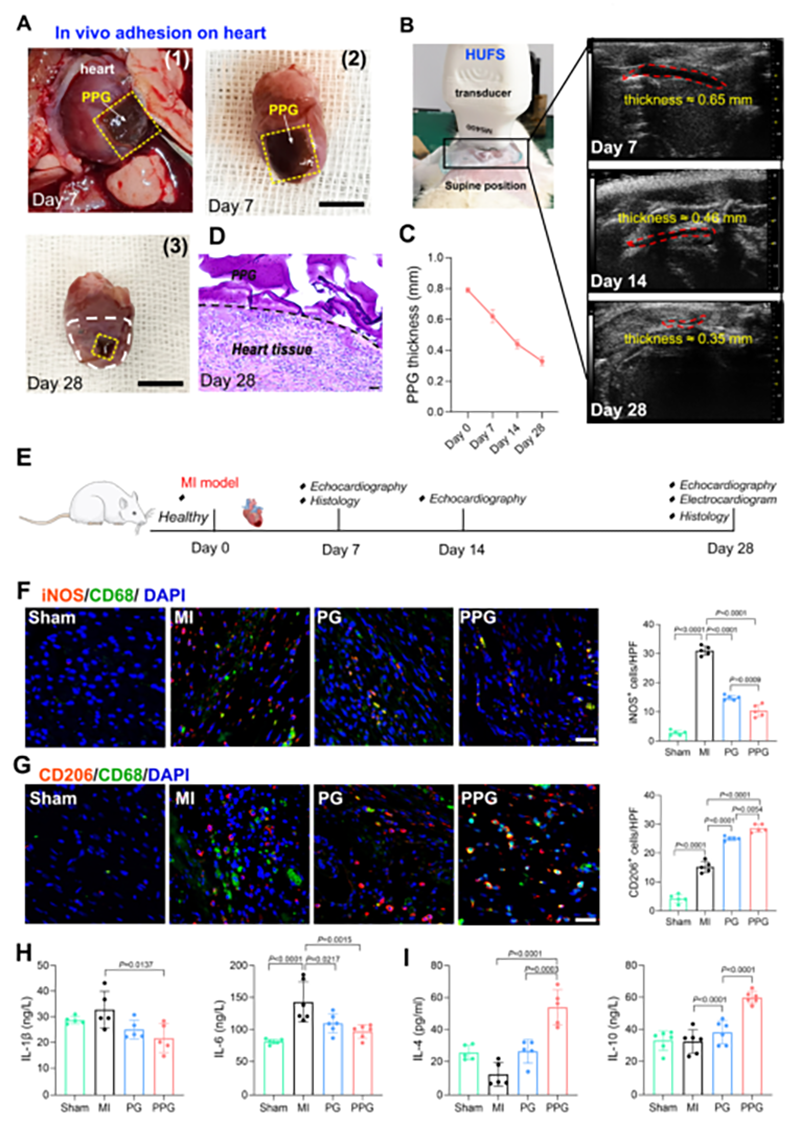
图4 PPG水凝胶在MI大鼠体内的湿黏附及免疫调节能力的评价
(4) PPG水凝胶促进心梗大鼠心脏收缩功能,防止心室重构
PPG水凝胶改善心肌梗死大鼠的心脏功能并防止心室重构。在植入损伤心脏后,PPG水凝胶具有良好的导电性和抗炎特性,能够减小心梗面积和左室纤维化,从而改善心肌梗死大鼠的心脏收缩功能。
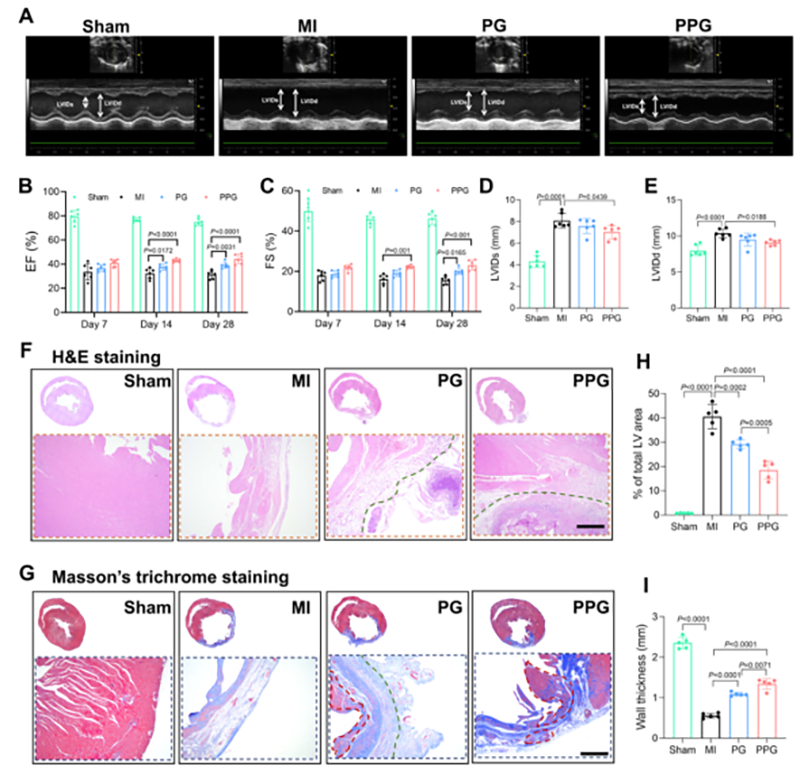
图5 PPG水凝胶促进MI大鼠心脏收缩功能,防止心室重构
(5) PPG水凝胶促进MI大鼠心肌修复和血管生成
PPG水凝胶促进了CX-43和心肌肌钙蛋白T (cTnT)的表达水平,抑制了心肌边缘区肥厚,可以重新同步对侧心肌电流,协调了心室梗死心肌的收缩。这表明,PPG水凝胶可促进心肌梗死后大鼠血管生成和血运重建,进一步促进心肌血供重建和左心室功能恢复。
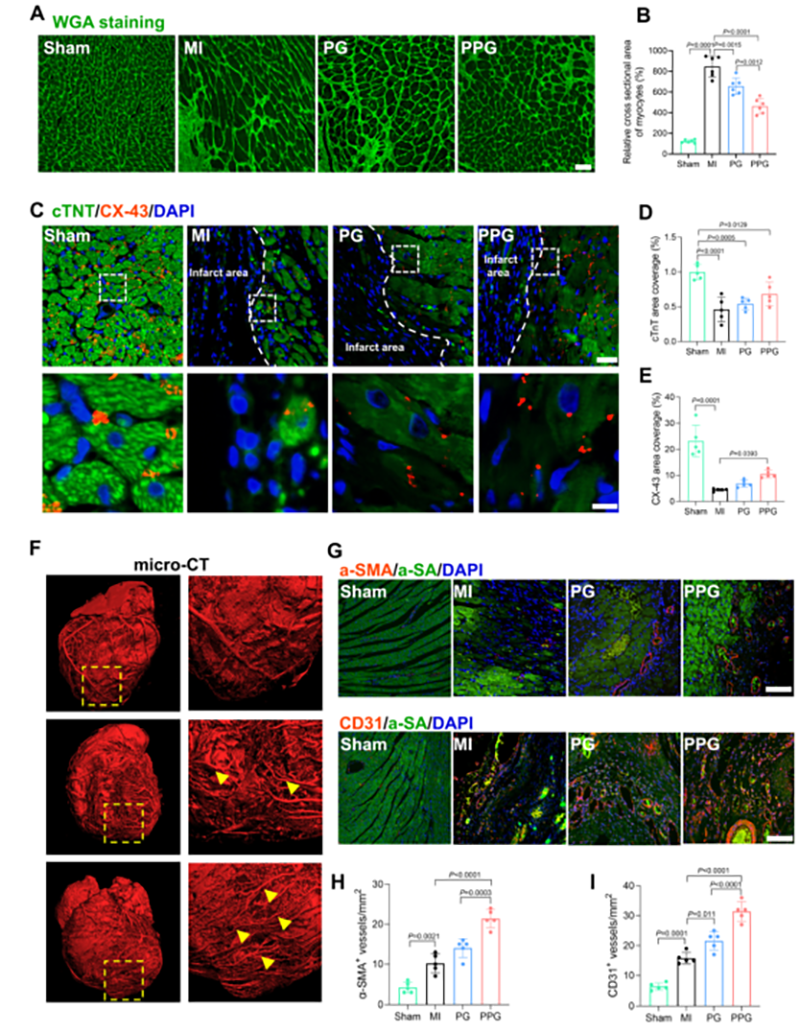
图6 PPG水凝胶促进心肌梗死大鼠心肌修复和血管生成
(6) PPG水凝胶在心肌梗死中的作用机制
PPG水凝胶贴片通过抑制 NF-κB和 CaMKⅡ-RyR2信号通路的激活,来抑制炎症细胞因子和NGF的表达水平,从而逆转心肌梗死后心脏结构和神经重构,从而降低了 MI后心力衰竭和恶性室性心律失常的发生率,以改善MI的预后。
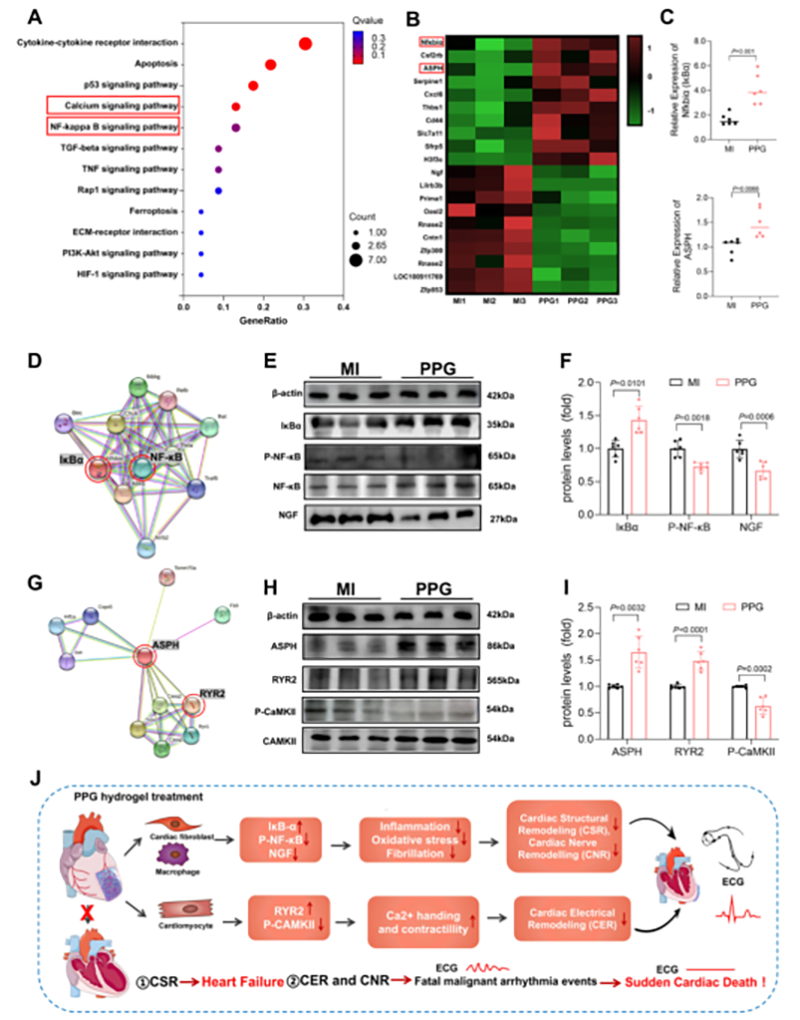
图7 PPG水凝胶预防心肌梗死后心室重构作用的机制
(7) PPG水凝胶在猪MI模型中的应用
PPG水凝胶处理显著降低了LVIDs和LVIDd,表明PPG水凝胶可以改善梗死猪心脏的形态和收缩功能。同时,PPG水凝胶处理后的心脏梗死面积明显变小。除此以外,PPG水凝胶在猪心脏表面稳定粘附至少28 d,证实了水凝胶的长期体内稳定性和粘附性能。综上所述,这些结果表明PPG水凝胶移植可以改善MI后猪心脏功能。
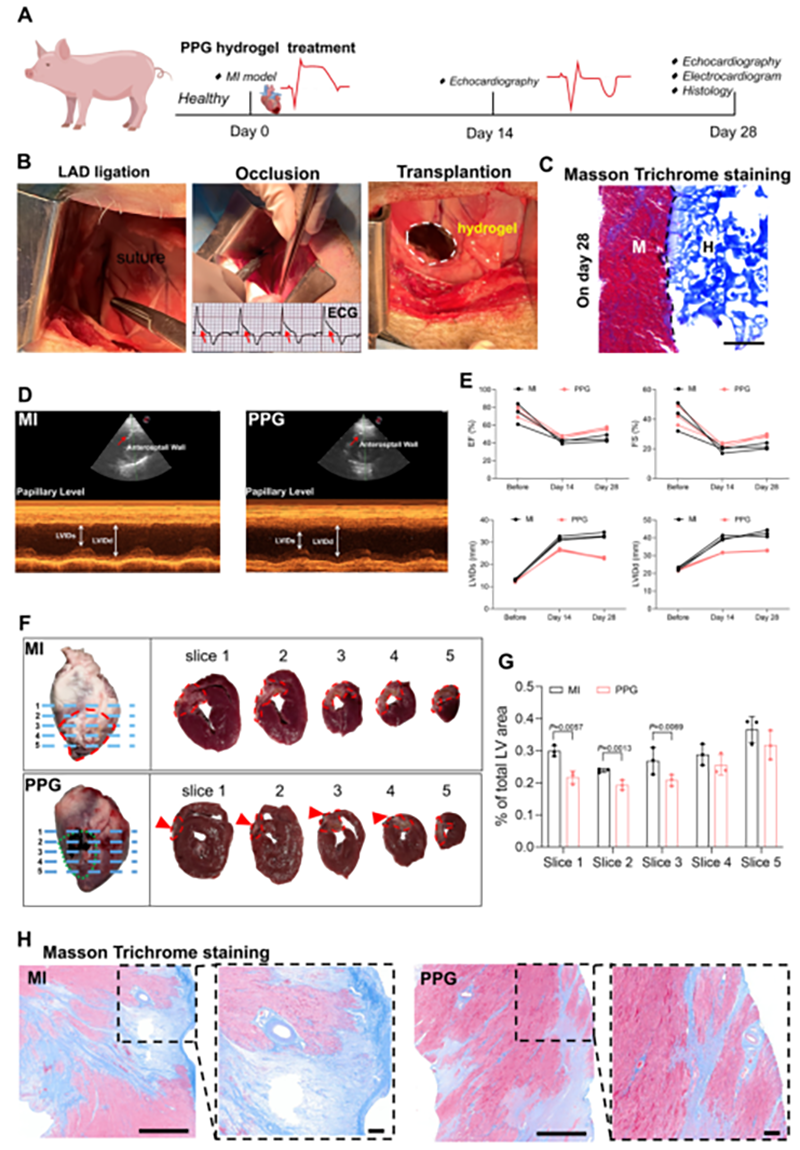
图8 PPG水凝胶在小型猪MI模型中的应用
小结:
综上所述,该团队利用多酚衍生的导电和氧化还原活性的PPEDOT NPs,成功地设计了一种导电和湿粘附的PPG水凝胶,以增强GelMA网络,并表征了其修复MI的治疗效果。同时,该团队提出了一种脱溶策略,通过提供干燥的界面,使PPG水凝胶具有湿粘附性,从而促进湿生理环境中粘附基团之间的相互作用。PPG水凝胶同时具有较高的生物稳定性、组织黏附性、细胞亲和性、抗炎能力,心肌匹配电导率和机械性能,这代表了基于水凝胶的心脏贴片的突破。PPG水凝胶具有抗氧化应激的细胞保护作用,并通过抑制NF-κB信号通路减轻早期炎症反应,减少心肌纤维化,促进梗死区血管生成。除此以外,PPG水凝胶与梗死心肌形成稳定的电界面,通过调节CaMKII- RyR2信号通路恢复电传递,改善心功能。PPG水凝胶移植后,梗死面积明显缩小改善心功能。综合而言,导电湿粘PPG水凝胶在心脏病治疗方面具有巨大的应用潜力。
原文链接:https://doi.org/10.1016/j.nantod.2024.102157

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

